Cell Res:中国科学技术大学朱书等团队合作发现来自炎症性肠病风险位点的lncRNA维持肠道宿主共生稳态
时间:2023-04-18 11:15:38 热度:37.1℃ 作者:网络
已知炎症性肠病(IBD)具有复杂的、受遗传影响的病因,涉及肠道免疫系统和微生物组之间功能失调的相互作用。
2023年4月13日,中国科学技术大学朱书、耶鲁大学Richard A. Flavell、哈佛医学院黄海亮及上海交通大学李华兵共同通讯在Cell Research(IF=46)在线发表题为“A lncRNA from an inflammatory bowel disease risk locus maintains intestinal host-commensal homeostasis”的研究论文,该研究表明来自炎症性肠病风险位点的lncRNA维持肠道宿主共生稳态。该研究描述了来自IBD相关的长非编码RNA位点(“CARIN-结肠炎相关IRF1肠道稳态反义调节因子”)的RNA转录本如何保护IBD。该研究发现CARINH及其邻近的转录因子IRF1编码基因在宿主髓系细胞中共同形成前馈循环。
该环的激活由微生物因子维持,并通过诱导抗炎因子IL-18BP和被称为鸟苷后期结合蛋白(GBPs)的抗微生物因子来维持肠道宿主-共生的稳态。将这些机制的见解扩展到人类,作者证明CARINH/IRF1环的功能在小鼠和人类之间是保守的。从遗传学上讲,rs2188962的T等位基因削弱了CARINH/IRF1环的诱导表达,从而增加了IBD的遗传易感性。因此,该研究阐明了与IBD相关的lncRNA如何维持肠道内稳态并保护宿主免受结肠炎的侵害。
另外,2023年2月3日,中国科学技术大学朱书,耶鲁大学Richard A. Flavell及广州医科大学李明松共同通讯在Science Advances 发表题为“Nucleic DHX9 cooperates with STAT1 to transcribe interferon-stimulated genes”的研究论文,该研究生成了髓系特异性和肝细胞特异性DHX9敲除小鼠,并确认DHX9对于宿主对体内RNA病毒感染的抵抗至关重要。通过在DHX9缺陷小鼠中增加敲除MAVS或STAT1,证明了核DHX9在调节I型干扰素下游干扰素刺激基因(ISG)表达中起积极作用。在机制上,在干扰素刺激下,DHX9直接与STAT1结合,并将Pol II募集到ISG启动子区域以参与STAT1介导的ISG转录。总的来说,这些发现揭示了核酸DHX9在抗病毒免疫中的重要作用。

炎症性肠病(IBD)是一种多基因慢性炎症性疾病,迄今为止已经发现了数百个IBD相关的遗传位点。然而,有关这些基因座的分子和致病机制的解释仅限于少数基因座,而且大多是编码变异。长链非编码RNA (lncRNAs)是许多发育和生理过程的调节因子,也是自身免疫等病理过程的介质。
lncRNAs在基因调控中具有重要功能,从表观遗传重编程到转录后调控。据报道,约98%的人类基因组突变发生在非编码区域。此外,NIH基因型组织表达(GTEx)项目数据的系统分析确定了1432个lncRNA基因-性状关联,将lncRNA与复杂性状和人类疾病联系起来。
一项最近IBD精细定位研究在Chr5: 131.2MB-132.2MB的非编码区域确定了因果变异候选基因的遗传关联;它是IBD最显著相关的区域之一,也是IBD显著相关的非编码位点,但描述具体的因果机制和/或基因已被证明具有挑战性。精细定位已将该区域的遗传关联解析为95%可信的8个遗传变体(包括该区域相关性最强的变体rs2188962),所有这些变体都位于lncRNA位点C5orf56。
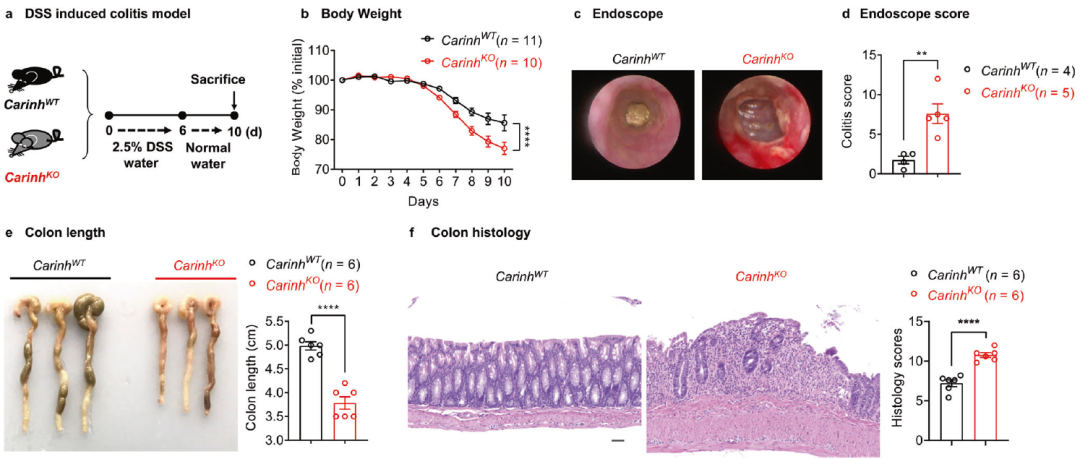
Carinh可以预防DSS诱导的结肠炎(图源自Cell Research )
该研究鉴定了来自IBD相关区域的lncRNA-C5orf56,并确定了其在IBD中的保护作用。由于该lncRNA与肠道菌群相互作用并控制肠道炎症,作者将其命名为结肠炎相关IRF1反义调节肠道稳态(CARINH)。该研究发现CARINH局部促进IRF1的转录,并在骨髓细胞中形成CARINH / IRF1调节环,以维持肠道菌群稳态并控制肠道炎症。该研究揭示了非编码遗传元件与IBD之间的关联机制,首次揭示了IBD相关lncRNA在肠道稳态和炎症中的作用。
原文链接:
https://www.nature.com/articles/s41422-023-00790-7


