浙大高建青教授/张添源研究员《自然·通讯》:构建“干细胞超级电池2.0”,实现对纤维化病变细胞精准和持续高效的线粒体补充治疗!
时间:2023-10-08 20:21:01 热度:37.1℃ 作者:网络
线粒体与肺纤维化
线粒体是真核细胞重要的能量供应“电池”,其在维持细胞稳态,调控胞内能量代谢以及细胞凋亡中发挥着重要作用。近年来的研究进一步显示,线粒体在细胞内的角色不仅仅局限于“电力”供应,其还是细胞内重要的“信号调节中心”,在细胞感受外界压力后的应激反应、细胞动力学以及相关蛋白的表达中发挥着重要的调节作用。因此,越来越多的研究者开始关注线粒体在疾病过程中扮演的重要角色。
肺纤维化(Pulmonary fibrosis)是一种能导致肺功能进行性丧失的严重间质性肺疾病,也是间质性肺疾病在临床上最常见的形式。其诊断后平均生存期为3-5年,死亡率不亚于一些恶性肿瘤,因而也被称为“类肿瘤疾病”。当前,肺纤维化已经成为世界范围内主要的难治性疾病之一,并呈现低龄化发展的趋势。近年来的研究指出,肺部细胞的线粒体功能受损是引起肺纤维化发生和发展的重要病因之一。当肺上皮细胞的线粒体功能受损时,其电子传递链功能效率降低,胞内能量(ATP)代谢失调,活性氧(ROS)产生增多。这些不断增多的ROS会最终导致细胞内的稳态被打破,引起肺上皮细胞生理功能的紊乱并向成纤维细胞进行转化。此外,由于线粒体功能受损导致的ROS失衡还会促进纤维化信号通路(如转化生长因子β,TGF-β)的激活和线粒体自噬的抑制等,进一步促进肺纤维化的发展。因此,恢复受损肺上皮细胞的线粒体功能以维持胞内能量代谢稳态,抑制过度生成的ROS,进而干预纤维化的发展被提出并有望成为一种新的肺纤维化干预治疗策略。
高效和持续的线粒体递送
然而,从成千上百万的肺部细胞中发现线粒体功能受损的肺细胞,并进行针对性的线粒体修复治疗犹如大海捞针,难以实现。幸运的是,我们机体自身保留了针对受损细胞的线粒体功能修复机制,当某个细胞应激受损时,其周边的健康细胞可以主动向受损细胞传递线粒体,以此简单和直接地维持受损细胞内的线粒体功能稳定。然而,这种机体自发的线粒体修复机制的疗效却受到细胞间有限的线粒体传递效率的限制,难以有效抑制受损细胞的持续病变。细胞间的线粒体递送效率与细胞间隙连接(Gap junction)密切相关。因此,浙江大学药学院的高建青教授和张添源研究员等人利用氧化铁纳米粒改良的间充质干细胞(Mesenchymal stem cell, MSC)构建了第一代“干细胞超级电池”(V1.0),通过氧化铁纳米粒促进MSC的细胞间隙连接蛋白高表达,实现了向受损细胞的高效线粒体递送(Science Advances. 2021,7(40):eabj0534)。然而,MSC在未分化状态下的低能量需求虽然有利于其向其他细胞的线粒体输出,但也同时限制了其可以输出的线粒体数量,导致这种线粒体转移在短时间内就会因为MSC胞内的线粒体耗竭而终止,无法实现对损伤细胞持续高效的线粒体递送。由此,对已经进展的肺纤维化的疗效有限。为了攻克这一难题,高建青教授/张添源研究员团队进一步开发了第二代“干细胞超级电池”(V2.0),通过对MSC的进一步工程化改造,同时提高了MSC的线粒体“容量”和线粒体的“输出效率”,实现了靶向受损肺细胞高效和持续的线粒体“再充电”,显示了针对已经进展的严重肺纤维化模型的有效治疗。研究发现,降糖药吡格列酮可以通过PGC-1α–NRF1–TFAM信号通路激活MSC的线粒体生物发生,显著提高MSC胞内的线粒体含量,进而进一步促进和延长依赖细胞间隙连接的线粒体转移,实现对博来霉素诱导损伤的肺细胞持续高效的线粒体递送。其体外递送效率可以从天然MSC的约10%最高提升至约40%,并可以持续维持高效递送超过72 h。最终,在小鼠和人肺细胞纤维化模型上均显示了应对已经进展的严重肺纤维化的良好干预治疗。相关工作以“Efficient intervention for pulmonary fibrosis via mitochondrial transfer promoted by mitochondrial biogenesis”为题发表在Nature Communications。博士研究生黄婷为本文的第一作者,浙大药学院的高建青教授和张添源特聘研究员为本文的通讯作者。

【文章要点】
肺纤维化的发生和发展与肺细胞的线粒体功能受损密切相关。利用细胞间自发的线粒体转移将功能正常的线粒体递送至损伤细胞,实现对损伤肺细胞线粒体功能的修复已经被研究者在前期工作中证实可以成为一种潜在的治疗肺纤维化的新策略。但是,这一治疗策略的疗效却受到细胞间线粒体的转移效率和可持续转移能力的制约。因此,如何实现对损伤肺细胞高效和持续的线粒体递送就成为有效治疗肺纤维化的关键。为了解决上述线粒体递送的关键问题,研究者们进一步构建了兼具线粒体高效生物发生和高效细胞间转移的工程化改良干细胞载体。其通过吡格列酮预处理激活PGC-1α–NRF1–TFAM信号通路,激发了MSC的线粒体生物发生能力。同时,利用氧化铁纳米粒被摄取后在胞内被部分降解成铁离子激活细胞间隙连接蛋白的高表达,实现线粒体依赖细胞间隙连接的高效细胞间转移。最终,通过工程化改良的MSC实现向肺部损伤细胞精准、高效和持续的线粒体递送,有效恢复损伤细胞的线粒体稳态,降低胞内的ROS水平和TGF-β表达,重新激活线粒体自噬,最终有效缓解和抑制肺上皮细胞的纤维化病变(图1)。
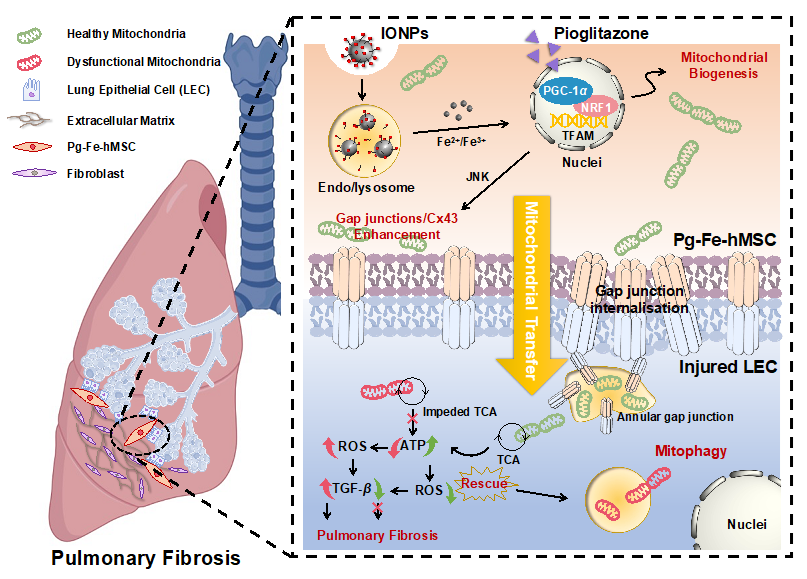
图1. 通过构建“超能干细胞”实现向损伤肺上皮细胞高效和持续的线粒体“再充电”,有效干预肺纤维化的进展。
研究者们首选发现临床用于降血糖的一线药物吡格列酮可以通过激活PGC-1α–NRF1–TFAM信号通路,有效促进人胎盘来源MSC(hMSC)的线粒体生物发生,提高hMSC胞内的线粒体含量。研究进一步发现,通过提高hMSC胞内的线粒体含量可以一定程度上促进细胞间的线粒体转移。但是,依然需要细胞间隙连接的协助。当用吡格列酮和氧化铁纳米粒协同处理hMSC(Pg-Fe-hMSC)时,可以获得目前报道的最高效率的线粒体转移(> 40%)。此外,研究还首次发现,激发hMSC的线粒体生物发生可以有效延长其持续线粒体递送的能力,相比只用氧化铁纳米粒处理的hMSC(Fe-hMSC)在线粒体高效传递后的快速耗竭,Pg-Fe-hMSC可以维持高效的线粒体递送达72 h(图2)。
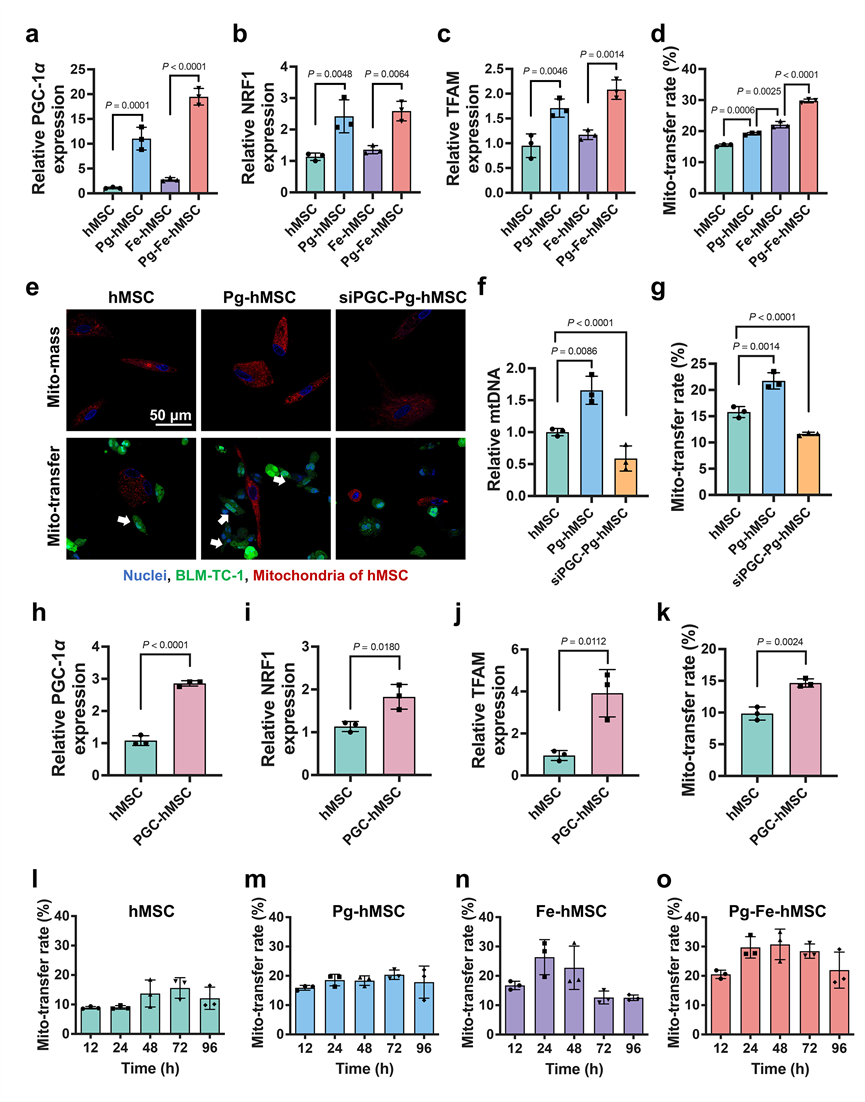
图2. 吡格列酮处理可以促进hMSC的线粒体生物发生,维持线粒体的高效和持续递送。
进一步地,研究者们证实Pg-Fe-hMSC持续高效的线粒体递送能力确保了其可以有效恢复严重受损的肺上皮细胞的线粒体功能(ATP水平),降低胞内的过量ROS,进而有效拯救受损的肺上皮细胞(图3)。
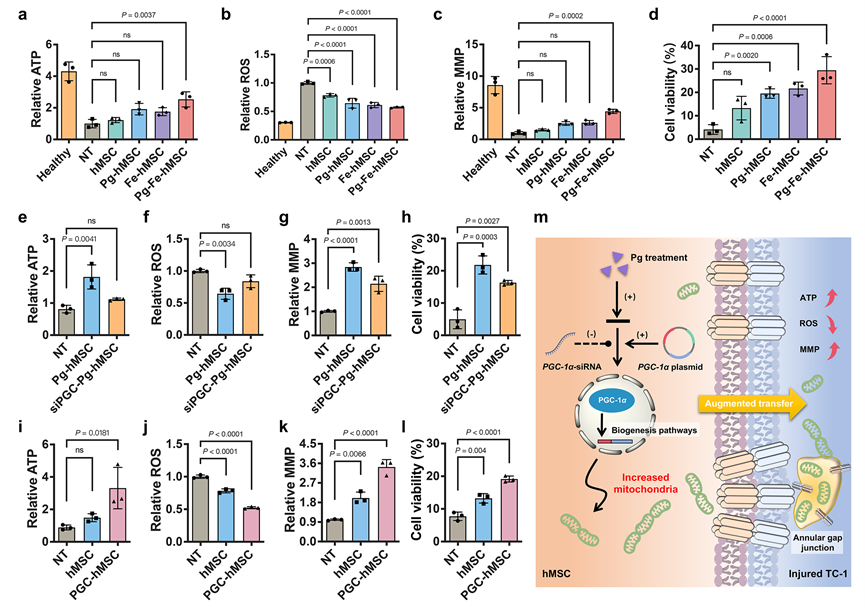
图3. 通过改良MSC持续高效的线粒体递送实现对严重损伤肺上皮细胞的线粒体功能恢复。
最终,利用这一具有持续高效的线粒体递送能力的Pg-Fe-hMSC,研究者们在已经进展了7天的小鼠肺纤维化模型上取得了良好的抗纤维化治疗效果,并证明这一疗效与高效持续的线粒体递送密切相关(图4)。
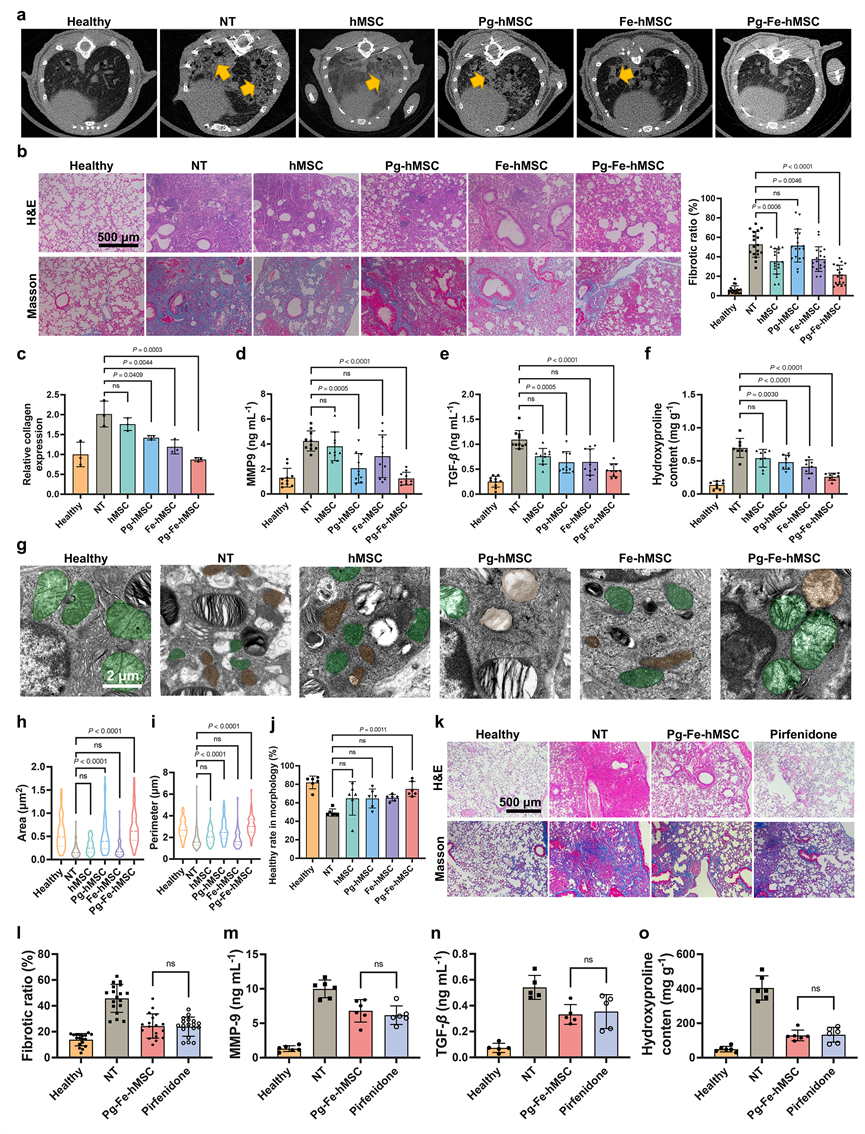
图4. 通过改良MSC持续高效的线粒体递送实现对已经进展的小鼠肺纤维化的有效干预治疗。
考虑到小鼠肺组织与人肺组织的差异性和小鼠纤维化模型普遍存在的自限性问题,研究者们进一步在原代人肺细胞模型上验证了上述线粒体的高效传递,并证明了这一治疗策略的有效性。研究团队还构建了由人肺上皮细胞和人肺巨噬细胞组成的三维人肺细胞球模型,并利用该细胞球模型构建人肺纤维化模型,进一步证实通过向受损人肺细胞高效和持续的线粒体“充电”可以有效缓减人肺细胞向纤维化的进展(图5)。
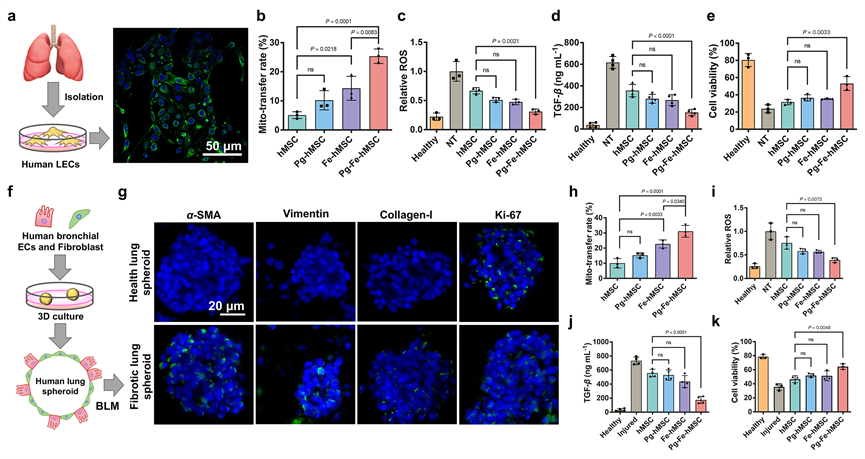
图5. 通过改良MSC持续高效的线粒体递送实现对纤维化的人肺细胞模型的有效干预治疗。
此外,研究者还从基因层面证实了通过高效和持续的细胞间线粒体递送可以有效恢复损伤细胞的线粒体功能(图6)。研究还首次发现通过高效的外源性线粒体导入可以重新激活损伤细胞内被抑制的线粒体自噬,恢复细胞内线粒体的动态平衡。相关研究为解释线粒体补充治疗的具体机制提供了重要的研究方向和新的研究思路参考。
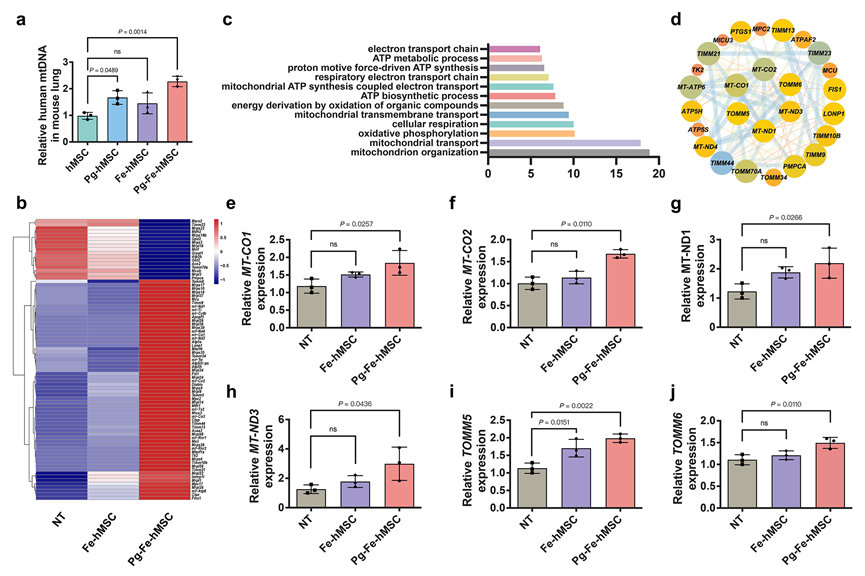
图6. 外源性线粒体导入可以有效恢复损伤细胞的线粒体功能。
『结论与展望』
该研究通过对MSC的工程化改良实现了向损伤细胞精准、高效和持续的线粒体递送。为通过将外源性线粒体靶向递送至损伤细胞,有效替换损伤细胞内已经失效的线粒体功能,进而拯救损伤细胞,实现疾病治疗提供了新的递送策略和实验参考,并为一些难治性疾病的治疗提供了一条基于高效线粒体补充治疗策略的新的康庄大道。
本论文得到了国家自然科学基金区域创新联合基金重点项目,浙江省自然科学基金重大项目和浙江大学“启真计划”交叉研究重点项目的支持。研究工作中还得到了浙江大学医学院附属第二医院胸外科和药学部以及浙江大学长三角智慧绿洲创新中心范晓辉教授团队的帮助。
高建青教授团队一直致力于基于干细胞及其衍生物的生物载体靶向递送系统的构建及用于重大疾病的治疗研究,近年来在Nature Communications, Science Advances, Advanced Materials, Advanced Functional Materials, ACS Nano, Advanced Healthcare Materials, Advanced Drug Delivery Reviews, Chemical Engineering Journal, Nano Letters, Small, Journal of Controlled Release, Stem Cells Translational Medicine等期刊持续发表了系列研究成果,显示了干细胞及干细胞来源的外泌体在脊髓损伤、脑卒中、纤维化和肿瘤等疾病治疗中的良好应用前景,部分成果已经推进至临床治疗研究。
论文链接:
Efficient intervention for pulmonary fibrosis via mitochondrial transfer promoted by mitochondrial biogenesis. Nat Commun14, 5781 (2023). DOI https://doi.org/10.1038/s41467-023-41529-7

