上海交大医学院附属瑞金医院陈生弟教授等《STTT》:小胶质细胞在神经退行性疾病中的作用——机制和潜在的治疗靶点
时间:2023-10-08 11:19:53 热度:37.1℃ 作者:网络
2023年9月22日,上海交通大学医学院附属瑞金医院陈生弟教授和谭玉燕副主任医师作为通讯作者在《Signal Transduction and Targeted Therapy》杂志发表题为 “Microglia in neurodegenerative diseases: mechanism and potential therapeutic targets” 的综述文章。本文由上海交通大学医学院附属瑞金医院神经内科高超和江静雯共同撰写。

在该文中,作者综述了小胶质细胞的研究历史,小胶质细胞的起源和生理功能,重点介绍了小胶质细胞在包括阿尔茨海默病、帕金森病、多系统萎缩、肌萎缩侧索硬化、额颞叶痴呆、进行性核上性麻痹、皮质基底节变性、路易体痴呆和亨廷顿病在内的神经退行性疾病中的作用,并总结了针对小胶质细胞的靶向治疗,包括细胞实验、动物实验和临床试验的证据。
在各种神经退行性疾病中可观察到小胶质细胞的激活。单细胞技术的最新进展揭示了这些反应性小胶质细胞具有高度的空间和时间异质性。一些特定状态下的小胶质细胞与病理标志物相关并且具有特定功能。小胶质细胞通过吞噬和清除病理蛋白聚集物发挥保护功能,但同时由于过度摄取病理蛋白而发挥有害作用。过度吞噬病理蛋白会导致小胶质细胞吞噬能力受损,诱发神经炎症,并最终导致神经变性。此外,外周免疫细胞的浸润使小胶质细胞形成促炎表型并加速疾病进展。小胶质细胞还作为传播病理蛋白聚集物的移动载体。小胶质细胞释放的细胞外囊泡和小胶质细胞的自噬受损都会导致病理进展和神经退行性变。因此,增强小胶质细胞吞噬作用,减少小胶质细胞介导的神经炎症,抑制小胶质细胞外泌体的合成和分泌,以及促进小胶质细胞转化为保护性表型被认为是治疗神经退行性疾病有前景的策略。
小胶质细胞在阿尔茨海默病中的作用机制
小胶质细胞对Aβ 和 tau 病理的影响。生理状态下,小胶质细胞吞噬 Aβ 和 tau,限制 Aβ 和 tau 的病理进展。但在病理条件下,小胶质细胞促进Aβ 和 tau 的传播并导致神经变性。小胶质细胞识别Aβ后会增加 IL-3Rα 的表达,星形胶质细胞来源的 IL-3 与小胶质细胞上调的 IL-3Rα 结合,增强小胶质细胞向Aβ 斑块迁移,促进 Aβ清除。TREM2 促进小胶质细胞向 DAM 表型转化;抑制小胶质细胞中的BACE-1促进小胶质细胞表型从稳态向 DAM-1 的转变。DAM 和 DAM-1 表型增强Aβ清除。小胶质细胞中的 LC3 相关的内吞作用 (LANDO) 促进 Aβ 受体循环,增加小胶质细胞表面Aβ受体,从而促进 Aβ 清除。相反,小胶质细胞有氧糖酵解增强,抑制Aβ的吞噬和清除。Aβ 诱导小胶质细胞免疫激活,形成和释放ASC斑点,释放的ASC斑点与 Aβ 结合并促进 Aβ 播种,从而促进Aβ传播。TREM2依赖的疾病相关小胶质细胞(DAM) 限制淀粉样斑块周围的tau蛋白播种和传播。反应性小胶质细胞通过激活NLRP3炎症小体或NF-kB信号通路促进神经炎症,进而加速tau蛋白传播和神经毒性。小胶质细胞自噬缺陷导致脂质代谢失调,从而增加神经元内tau相关的病理改变及其传播。神经退行性表型的小胶质细胞(MGnD)分泌过多含有 pTau 的细胞外囊泡从而加速 tau病理进展。(图1)
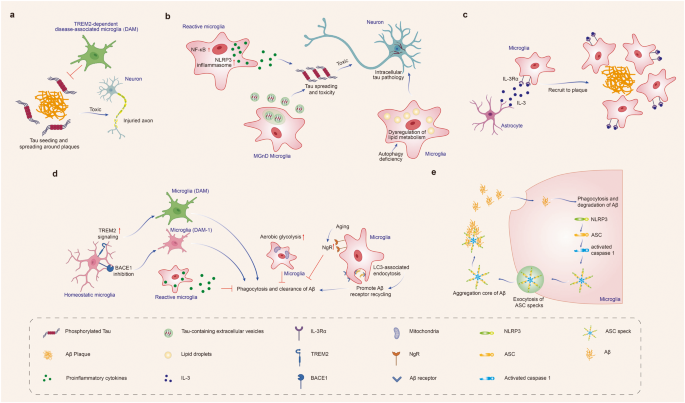
图1
功能失调的小胶质细胞削弱神经元活动。 功能失调的小胶质细胞促进突触和神经元周围网络(PNN)的清除,并削弱神经元可塑性和神经元活动。携带 APOE4 等位基因的小胶质细胞发生细胞代谢改变,细胞内和细胞外脂质沉积增加。细胞外脂滴通过增加钾离子内流降低神经元活性。小胶质细胞释放含有Aβ的细胞外囊泡导致突触功能障碍。小胶质细胞对突触的吞噬作用还会受到星形胶质细胞的影响。纤维蛋白原从损伤的脑血管渗漏进入大脑并随后与小胶质细胞表面受体 CD11b 结合。纤维蛋白原与CD11b相互作用促进小胶质细胞激活并导致神经元突触棘丧失。小胶质细胞吞噬PNN并促进淀粉样斑块依赖性PNN丧失。(图2)
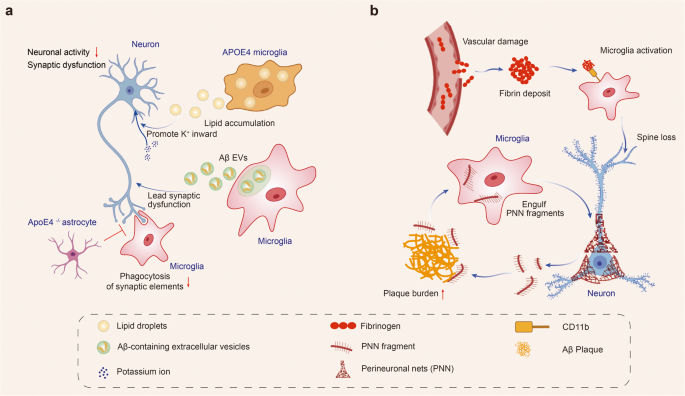
图2
小胶质细胞在帕金森病中的作用机制
小胶质细胞在帕金森病(PD)的激活和多样性:PD患者的大脑广泛存在小胶质细胞激活的现象,也是PD早期发生的病理改变。小胶质细胞呈现出形态学的变化,表明它们处于一种反应性状态。通过对PD患者的冷冻脑组织进行snRNA-seq分析,其中,最主要的三个小胶质细胞亚群分别高表达P2RY12、HSP90AA1和GPNMB标记基因。另外,研究还明确了一种特殊类型的小胶质细胞,这些细胞被称为表达Cspg4的小胶质细胞,它们具备在α-syn的刺激下增殖的能力。
α-syn对帕金森病中小胶质细胞的影响:α-syn可以通过神经元突触的吞噬作用以及邻近神经元释放的囊泡使得小胶质细胞转变为反应型状态。α-syn存在不同的形式,包括单体、寡聚体和纤维蛋白形式。小胶质细胞对α-syn的识别、摄取和吞噬取决于所遇到的α-syn的形式以及涉及的受体。已经证明,α-syn通过与膜受体相互作用,激活NF-κB信号通路并通过各种介质组装成NLRP3炎症小体,引发促炎反应,进而产生炎症介质和自由基。此外,外周免疫细胞的激活、招募以及其通过血脑屏障浸润至脑部的过程,会引发小胶质细胞的激活,促进神经退行性疾病的发展。CCL2-CCR2轴参与了单核细胞浸润到中枢慢性炎症的脑组织中。已经在PD小鼠模型和患者的脑组织中观察到CCR2的上调和活化,表明浸润性单核细胞在PD中可能具有潜在的有害作用。局部细胞因子和组织信号可以诱导单核细胞向巨噬细胞的转化。这些级联反应还导致小胶质细胞的增殖和迁移。因此,在PD病程中,外周适应性免疫可能间接促进小胶质细胞的激活(图3)。
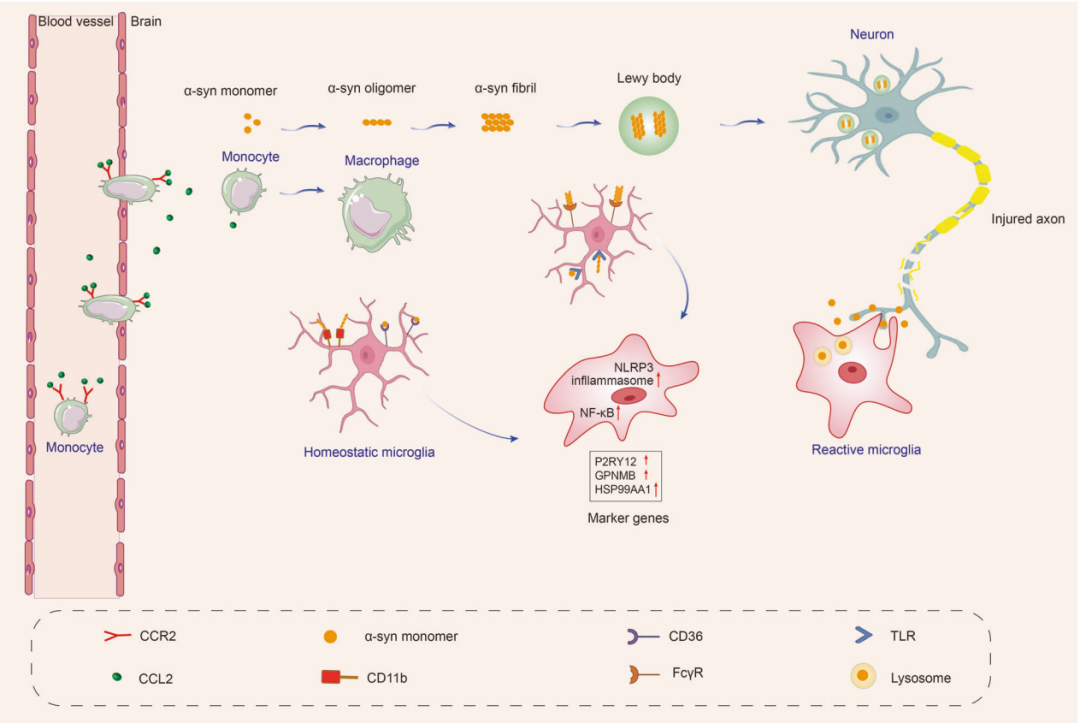
图3
小胶质细胞在多系统萎缩中的作用机制
α-syn 可以与小胶质细胞 Toll 样受体 (TLRs) 相互作用,然后被小胶质细胞吞噬。但小胶质细胞过度摄取α-syn导致小胶质细胞的吞噬能力显著下降,诱发小胶质细胞的炎症反应,包括 NF-κB 和 NLRP3 炎症小体信号通路激活、活性氧自由基产生、促炎细胞因子上调,并最终导致神经变性。此外,CD4 和 CD8 T 细胞耗竭可减轻 MSA 小鼠中 α-syn 诱导的神经炎症和脱髓鞘。小胶质细胞还作为传播α-syn的移动载体。(图4)
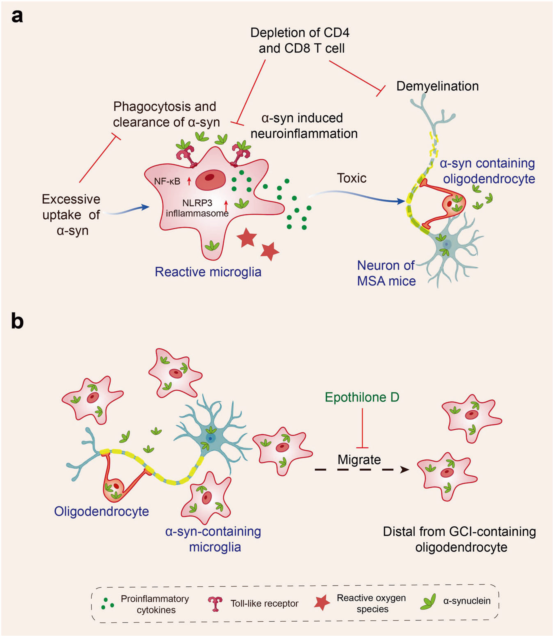
图4
小胶质细胞在肌萎缩侧索硬化和额颞叶痴呆中的作用机制
TDP-43 可以通过外泌体或细胞死亡被释放到细胞外基质中。TDP-43与小胶质细胞 TREM2 相互作用,增强小胶质细胞对病理蛋白的吞噬和清除。小胶质细胞对 TDP43 聚集物的吞噬可以激活小胶质细胞和NLRP3 炎症小体,上调促炎细胞因子,这些神经炎症对运动神经元具有神经毒性作用。 此外,小胶质细胞中颗粒前体蛋白(progranulin)缺乏会激活小胶质细胞 NF-κB 信号通路并促进促炎细胞因子的释放,导致中型多棘神经元过度兴奋。Progranulin缺乏会加重 TDP-43 病理,促进小胶质细胞的突触剪切,导致突触丧失和神经变性。Progranulin缺乏也会导致小胶质细胞溶酶体功能障碍并减少对髓鞘碎片的降解,导致髓鞘碎片在白质中累积。 此外,C9orf72功能丧失促进了小胶质细胞从稳态向炎症状态的转变,并促进小胶质细胞对突触的修剪,导致神经元突触丧失。在肌萎缩侧索硬化小鼠模型(SOD1 小鼠)的早期阶段,小胶质细胞呈抗炎表型,对运动神经元具有保护作用。但疾病晚期,小胶质细胞呈促炎表型,对运动神经元具有神经毒性。外周免疫细胞的浸润使小胶质细胞形成促炎表型并加速疾病进展。(图5)
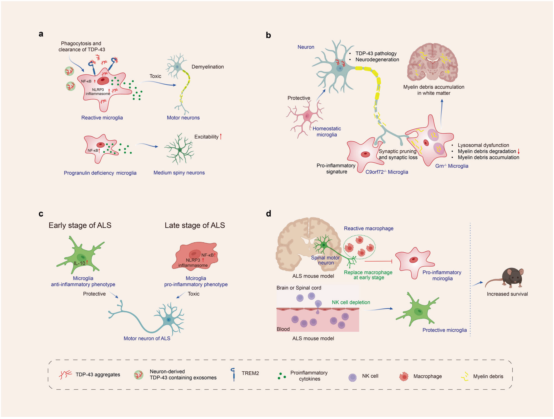
图5
神经退行性疾病中小胶质细胞靶向治疗
调节神经炎症,抑制小胶质细胞外泌体合成和分泌、改变小胶质细胞代谢、改变小胶质细胞表型以及 TREM2 激活都是潜在的神经退行性疾病的治疗策略。其中,调节神经炎症应用最广泛。(图6)
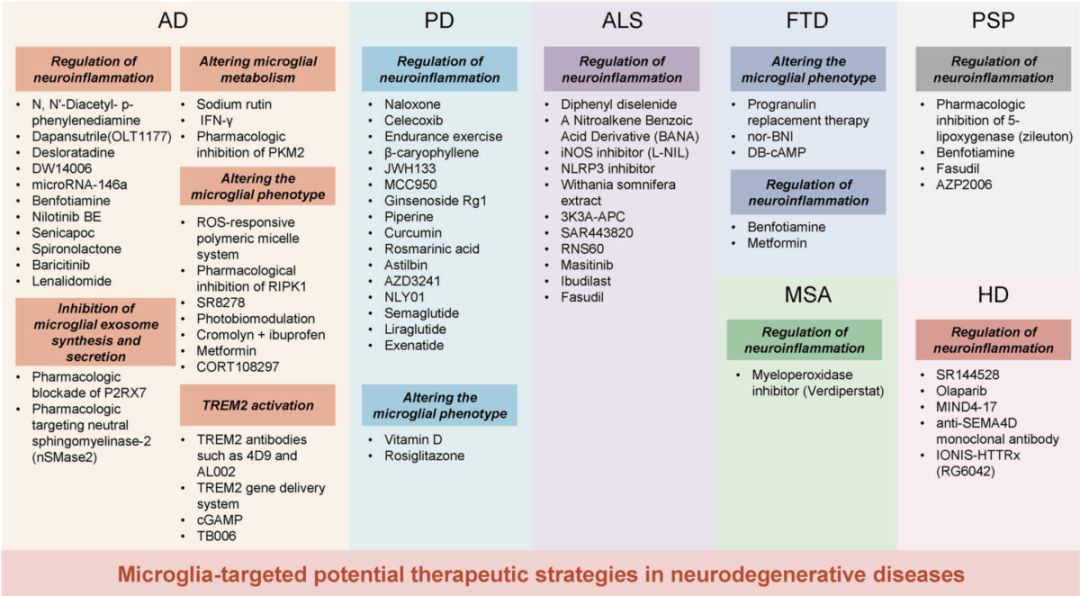
图6
【小结和展望】
尽管近年来对神经退行性疾病中小胶质细胞作用的理解取得了重大进展,但在疾病进展过程中小胶质细胞的异质性和动态变化仍需要更好地分析和阐释。最近高通量组学数据分析的出现有助于鉴定处于特定状态的小胶质细胞功能。此外,这一进展还促进发病机制中异常调控通路和关键分子的发现,这将有助于开发新的治疗策略。在未来十年中,对神经退行性疾病中小胶质细胞的研究应包括:(i)鉴定不同的小胶质细胞亚群并了解其功能;(ii)发现特定小胶质细胞表型的调节因子,并在疾病早期将小胶质细胞重新编程为保护性表型;(iii)揭示小胶质细胞与其他细胞类型的相互作用;(iv) 建立人源小胶质细胞嵌合小鼠模型;(v)从患有神经退行性疾病的新鲜脑组织中获得原代小胶质细胞或重编程人类干细胞诱导为小胶质细胞。以上这些措施将为机制研究和治疗药物筛选提供有力工具,对于开发靶向小胶质细胞的治疗策略治疗神经退行性疾病至关重要。
原文链接:
https://doi.org/10.1038/s41392-023-01588-0


