文献解读 | 解密aDBS:从实验证据到实践实施
时间:2023-10-06 23:16:57 热度:37.1℃ 作者:网络
前言
闭环自适应脑深部电刺激(adaptive deep brain stimulation,aDBS)可以以前所未有的瞬时精度为神经系统疾病提供个性化治疗。这项技术有可能促进神经技术的突破,但将其转化为临床实践仍是一项重大挑战。aDBS可以感知并选择性地调节病理生理学脑回路活动,研究不同aDBS控制策略的试点研究显示出有前景的结果,但短期试验研究设计尚不支持对生物标志物和治疗反应动力学中的患者特异性因素进行个体化分析。尽管为患者量身定制的方法具有明显的理论优势,但这些新的刺激可能性打开了一个巨大的且大部分未经探索的参数空间,从而导致临床试验的实施和开发面临实际障碍。因此,彻底了解aDBS相关的神经生理学和神经技术方面对于开发临床实践的循证治疗方案至关重要。aDBS治疗的成功取决于反馈信号识别、伪影消除、信号处理和控制政策调整策略的综合开发,从而为个体患者提供量身定制的精确刺激。
2023年6月发表在《Movement Disorder》杂志上的一篇综述介绍了aDBS帕金森病(Parkinson’s disease,PD)和其他网络障碍的神经生理学基础,解释了目前可用的aDBS程控策略,并强调了在未来几年中需要解决的实际缺陷和困难。最后,本文强调了DBS中心内部和跨DBS中心之间的跨学科临床神经技术研究的重要性,朝着以患者为中心的个体化治疗发展。
研究内容
闭环自适应脑深部电刺激植入式器械
用于全嵌入式、侵入性、闭环自适应神经调控的植入式脑深部电刺激(deep brain stimulation,DBS)器械现已进入临床阶段。这些器械能够根据皮质下或皮质电生理反馈信号,通过生理学上的刺激传递,在时域内优化DBS。第一代市售和广泛使用的下一代神经刺激器(美敦力Percept™ PC)于2020年发布。这代表了一个重大的开发进步,但是,该器械不可充电的事实限制了数据流和实验的时间,因为脑部信号和无线数据流会导致电量耗尽。越来越多的制造商正在开发支持脑感知型器械,这将有助于在研究和临床实践中实施完全嵌入的aDBS。然而,随着DBS、感知技术和aDBS出现新的进展,给治疗增加了大量的参数和复杂性。如果没有适当的支持工具和教育,则可能无法完全实现生物标志物传感或aDBS的实用性和临床用途。
靶向脑节律
在aDBS中,可以选择性地输送电流,其目的是调节脑回路活动。目标脑节律可以是脑部信号的某些特征和/或其特定的时空特征,这些特征指示了症状状态以告知刺激的传递。多年来,随着帕金森病(PD)的重大发现,关于如何将单个电生理生物标志物作为反馈信号嵌入aDBS控制策略的概念框架已日趋成熟,并有可能转化为其他DBS适应症。β波活动与PD运动迟缓/僵硬的运动体征严重程度相关。如果测量到高或低水平的β波活动,则代表了一种自动调整刺激参数(例如刺激强度)的控制策略。迄今为止已检验过的各种控制策略包括:(1)单阈值快速控制;(2)双阈值控制;和(3)较慢的比例控制。
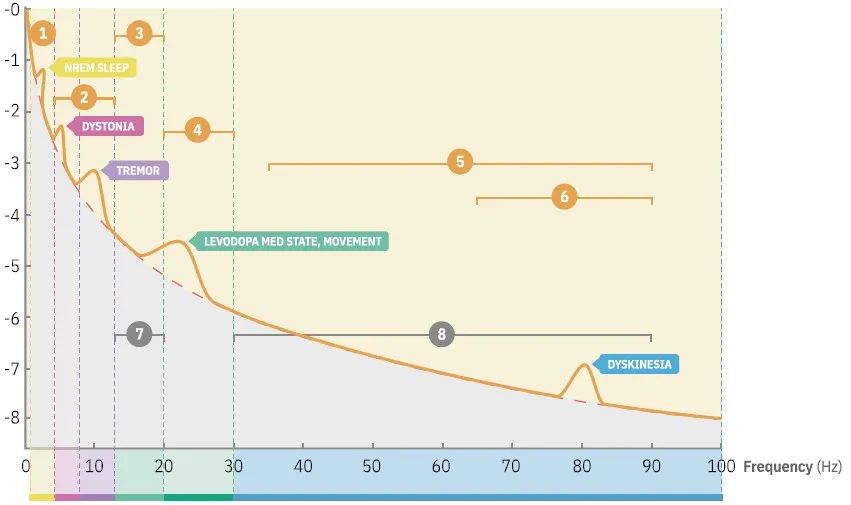
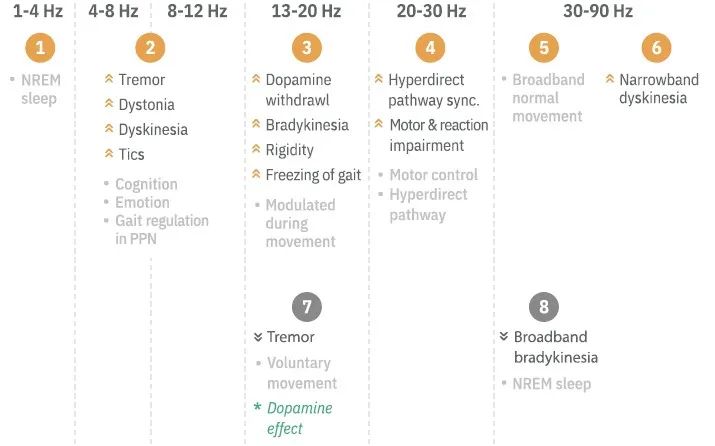
已在PD中初步进行的不同aDBS控制策略包括记录来自运动皮质脑皮层电图学(electrocorticography,ECoG)的微调γ波活动,作为可指示运动障碍的反馈信号。此外,使用相同的DBS电极进行感知和刺激可能会限制优化治疗的触点选择。皮质ECoG可以提供更好的信噪比,并且不影响接触点选择的自由度。此外,从运动神经网络中的不同部位进行记录有可能识别临床状态的不同生物标志物,但这是以额外的神经外科侵入性为代价的,应谨慎考虑。
电生理脑生物标志物库
目前,β作为PD中的生物标志物已被广泛接受,这主要是由从受试者间收集的短数据记录中得出的群体水平推论驱动的。尽管首次受试者内评估和长期随访证实了这些群体研究,但这并不一定意味着皮质下β波将普遍成为每名患者的最佳生物标志物。最佳代表相关和动态临床特征的最佳生物标志物可能因患者而异,尤其是在存在刺激的情况下。此外,研究还表明,几个频率范围的组合可进一步改善震颤检测。相比之下,对于原发性震颤,解码自主运动发作的振荡信号可能代表未来控制aDBS的策略。总体而言,当前大脑感知器械的普及有助于发现和定义与症状状态和波动相关的频率范围(图1)。在此,应特别关注临床外脑部信号的长期监测。应使用客观症状追踪、生态瞬时评估、药物摄入量记录和“快照”工具对临床外的生物标志物特征进行进一步描述,以收集描述临床状态的光谱特征。最终,应建立开放访问生物标志物库,其中收集和验证症状特异性反馈信号,以促进知情的aDBS编程。
增加了调节aDBS的参数空间
技术进步将为临床带来越来越多的可调感知和刺激参数,这些均需要优化。由DBS临床医生定义的传统DBS参数为:(1)刺激接触/位置;(2)刺激幅度;(3)刺激频率;以及(4)刺激脉冲宽度。值得注意的是,采用aDBS时,该参数空间进一步扩展,其变得更加复杂。在未来几年,预计临床医生和科学家将不得不参与和探索这一扩展的参数空间,并学习如何调节aDBS。
感知接触和蒙太奇
自适应控制系统需要可靠和信息丰富的反馈信号来支持适当的治疗适应。对于脑部感知信号,必须选择两个脑部信号记录触点来创建一个双极记录蒙太奇,以测量不同的电压变化,类似于脑电图蒙太奇。在aDBS过程中,当记录和刺激同时发生在同一个大脑区域时,通常选择与刺激相邻的感知触点。分段接触提供了更多选择来形成刺激场,并以更高的空间分辨率进行神经生理记录。然而,之前关于aDBS的研究尚未使用定向刺激和感知,因此仍需要探索这种蒙太奇的硬件解决方案。
关注频段
大多数新型神经刺激器植入物都专注于可在频域中量化的振荡LFP特征。对于PD,通常选择记录触点对中以单个β峰频率为中心的窄频段作为关注的频率范围。但是,任何给定患者的临床相关频率范围可能不同,因此需要查询个体化生物标志物。对于潜在反馈信号的未来选择,还需要考虑如何在各种生理状态(如体育活动或睡眠)下调节这些信号。
控制策略
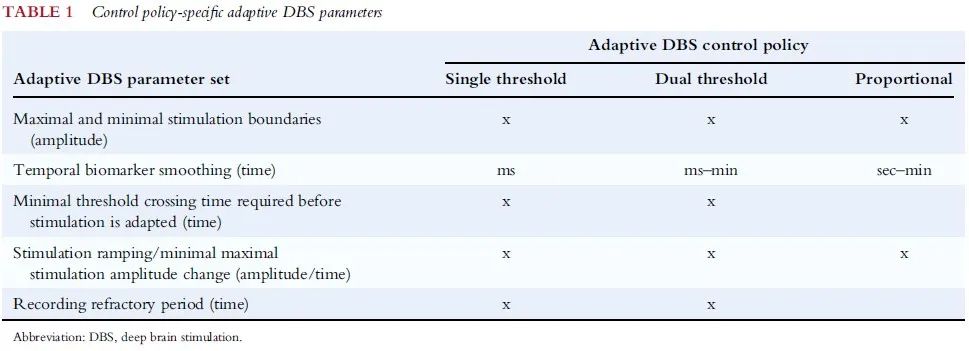
在确定可靠的生物标志物后,对临床医生最有影响力的概念性决策将是控制策略的选择。aDBS器械内部和不同器械之间有多种可能的控制策略,可以针对振荡特征的变化自动调节DBS参数。控制策略有:单阈值策略、双阈值控制策略、比例控制。通常,值得注意的是,这些不同的策略均可以与相同的生物标志物相互作用。总体而言,这为如何与临床和神经生理动力学进行最佳相互作用提出了多种不同的策略。目前,调节刺激幅度是aDBS的标准适应机制。在未来,自动化的自优化技术可以极大地支持参数选择过程。
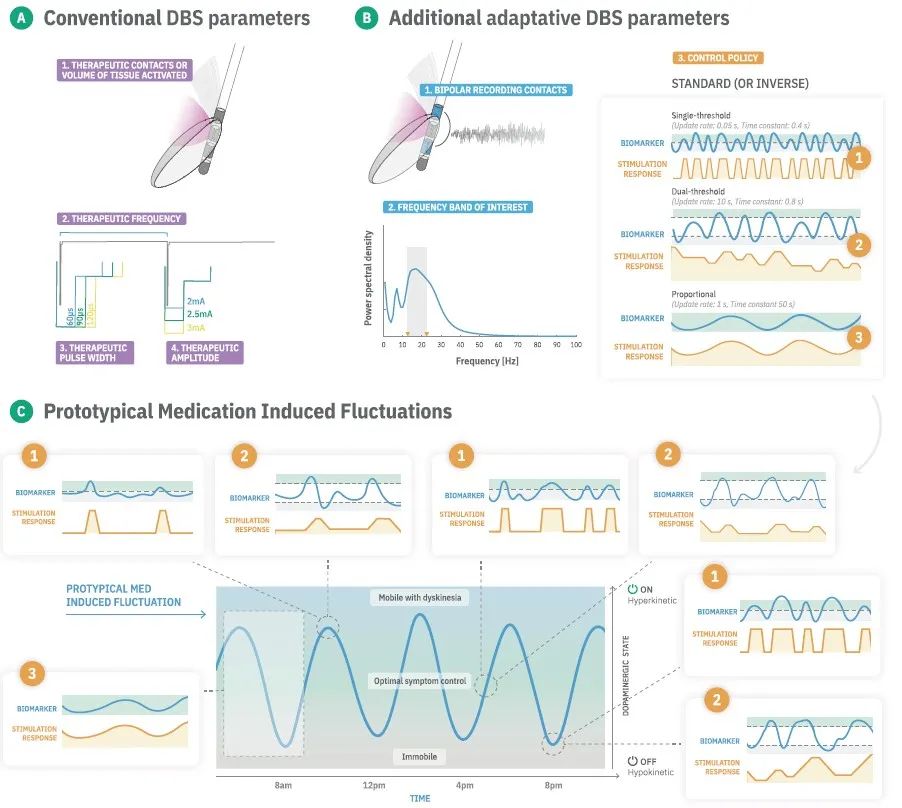
刺激幅度边界、时间平滑和刺激响应参数
除上述临床医生面临的更明显选择外,现在控制策略本身有多个与感知和aDBS相关的新隐藏参数。“刺激幅度边界”定义了aDBS可安全运行的幅度范围的下限和上限。生物标志物和刺激响应的时间特性提供了多个重要的参数决策。神经生理学生物标志物的时间分辨率尤其取决于采样频率、信号分析的时间设置(即快速傅立叶变换的窗口大小)和“平滑参数”。平滑参数支持修改特征信号的时间稳定性,并与控制策略的行为密切相关。与平滑的控制效果部分相似参数可以通过调整“最小阈值交叉时间”来实现,该时间定义了在调整刺激前生物标志物需要保持在高于/低于阈值多长时间。“刺激递增”对于确保安全的刺激适应和最小的副作用可能是非常重要的。
最后,定义每次脉冲后的记录不应期(即探测器消隐)可能是必要的,这可以避免刺激引起的伪影污染反馈信号。对于所有参数,需要在器械中内置安全机制,以确保患者不会受到过度(或不足)刺激。
刺激期间大脑活动记录的技术挑战
尽管市场上现已出现首款支持传感的aDBS器械,但在同一个目标上进行记录和刺激仍然是一项巨大的挑战。各种类型的伪影均会影响信号的可靠性,除了心电图伪影外,还可以观察到DBS电极电缆移动,从而导致脑部信号出现大的瞬变。这两种伪影均会污染宽频带频谱,可能会阻止基于阈值的控制策略有效地和选择性地对目标生物标志物作出反应,并导致刺激不受控制地增加(例如,β波驱动的aDBS)或减少(例如,最终驱动的aDBS)。对于如肌张力障碍、震颤和抽动秽语综合征等运动增多型的运动障碍疾病,已经证明了低频段特别容易受到心电图和运动伪影污染,结合这些疾病的运动过度性质,仍将是一项重大的技术挑战。此外,较高频段的宽带γ波活动可能再次由于伪影或在当前系统中有限的灵敏度而遭受重影,因为在这些频率中具有众所周知的低信噪比。最终,这些因素应该提醒临床医生和工程师,超出β波范围将需要神经生理学家和临床医生的谨慎关注。考虑到我们正在从慢性连续的DBS模式转换,不完善的控制系统的相对影响可能是可以容忍的并且可以谨慎地选择阈值上限,以避免“人为驱动的”过度刺激导致的运动障碍。除了ECG和运动伪影之外,高频刺激的直接影响(例如,通过次谐波信号感应或混叠相关伪影)通常更难以处理,并可能妨碍aDBS控制策略的安全使用。
因此,aDBS中用于感知或刺激的定向触点的完全整合可能需要额外的伪影抑制策略。未来,用于传感感知和头戴式脉冲发生器的DBS导线技术的优化将使关键改进成为可能,从而增加aDBS作为新标准治疗的技术可行性。此外,未来关于最佳aDBS设置设计的讨论需要包括传感感知和刺激部位的空间分离。因此,基于反馈信号的ECoG皮质传感能够无限制地选择皮质下刺激触点,从而赋予信号质量和刺激灵活性的优势。
自适应DBS的实际管理:从个体化优化到自动化临床工具
自适应DBS可能成为一种强大但复杂的精准医学工具,用于控制给定患者的不均匀加权症状分布。在未来几年,与传统的DBS相比,预计将需要更多的时间和精力来探索和理解aDBS的细微差别和临床效果。用于设置aDBS的迭代临床算法需要改进发展,临床医生、科学家和行业合作伙伴必须共同努力,以建立一个可持续和全面的用户界面。此外,生物标志物也可能受到个体患者昼夜节律和潜在的其他生物节律变化的影响,这一点经常被忽视。因此,将临床期间获得的信号与家庭监测相结合,可能有助于确定相关的昼夜节律生物标志物分布及其在白天和夜晚的时间动态。
我们预计多种生物标志物与机器学习的结合可能会显著扩展aDBS的临床效用。除了选择反馈生物标志物外,还需要考虑aDBS控制策略的参数化以及潜在的技术局限性(如心电图、刺激伪像)。
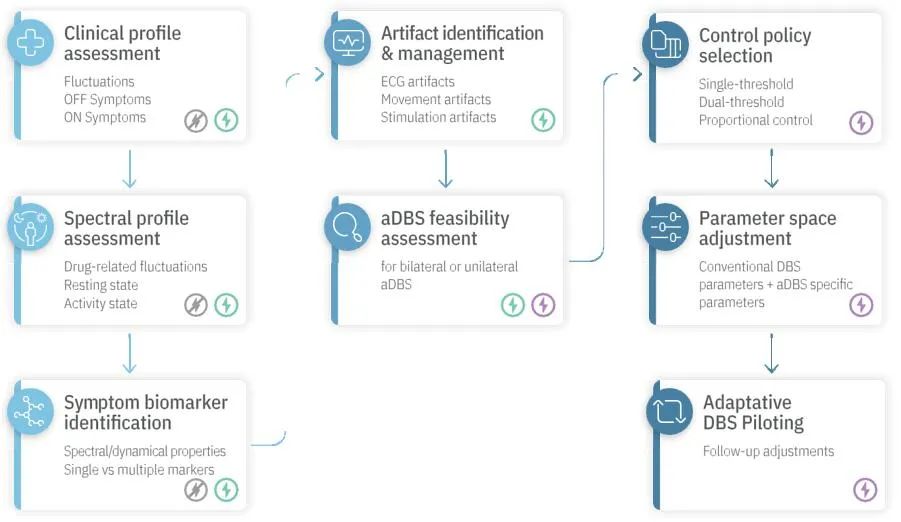
aDBS可行性评估应成为临床研究的一部分。此外,将有多个控制策略可用,可根据患者的主要症状和生物标志物特征进行选择。每种控制策略都有一组不同的刺激参数,需要根据神经生理学靶标生物标志物动力学进行调整。此外,控制策略和参数的选择必须根据潜在的限制性伪影进行评估和选择。最后,作为定期随访的一部分,长期记录和电生理读数以及客观的临床评估应有助于随着时间的推移而优化aDBS控制策略。
如何评价临床效果
自适应DBS可能成为针对个体神经生理表现和症状的临床精确医学治疗工具。为了实现这一目标,技术诀窍和技术改进将需要行业内的知识共享,这些知识来自于个体患者和病例系列的迭代调整程序以及更稀疏的群体水平研究。这需要在适当的试验设计中加以考虑,特别是如果临床差异是细微的、患者特异性的,并且难以在临床环境中观察到的差异。本质上,进行多项n-of-1研究和结果导向的框架来评估患者在这种情况下的临床反应可能非常关键。此外,使用可穿戴技术进行的客观症状评估、受控研究环境中的监测以及长期家庭记录可能对评估和调整这些下一代疗法很有价值。
闭环DBS:开始简单而周到
aDBS的当前转化状态需要(1)许多小型但有前景的临床初步研究;(2)首个商业发布的闭环DBS功能神经刺激器;和(3)首项正在进行的aDBS在PD中应用的可行性和安全性试验。
临床意义
展望未来,临床上可持续的aDBS系统的开发将带来新的挑战,其中许多是技术性的,包括与大脑活动的无伪影交互。未来,这些挑战中的一部分可以通过将额外的外部器械与DBS植入物无线配对来解决,以支持生理和行为跟踪,并提高为患者量身定制的控制策略的精确度。从长期慢性治疗来看,最好是采用一体化植入系统。
这篇总述能够引发行业业内的讨论,以解决根据异质性症状分布特征,校准适应性刺激所需的参数空间自由度不断增长的处理策略。鼓励相关研究人员强调开放科学实践,使代码和数据可用,并授权新的多中心研究联合会与诊所中的患者合作,系统地研究aDBS的各个方面,并建立可用于临床实践的稳健控制策略。
原文链接
Neumann WJ, Gilron R, Little S, Tinkhauser G. Adaptive Deep Brain Stimulation: From Experimental Evidence Toward Practical Implementation. Mov Disord. 2023 Jun;38(6):937-948. doi: 10.1002/mds.29415. Epub 2023 May 6. PMID: 37148553.


