从对照组交叉治疗看NSCLC免疫治疗的排兵布阵
时间:2023-05-19 09:48:21 热度:37.1℃ 作者:网络
引言 靶向治疗和免疫治疗是目前晚期NSCLC治疗的两大主要手段。对于EGFR突变阳性的晚期NSCLC患者,多项III期随机对照临床研究均证实,一线使用一代EGFR-TKI相较化疗,可以显著的改善PFS,但均未能延长患者OS[1]。究其原因,主要是由于一代EGFR-TKI一线使用和二线使用的疗效并无差异,多项III期研究中,化疗组在一线治疗进展后,均有很高比例的患者交叉接受了TKI治疗。同时厄洛替尼OPTIMAL研究提示,EGFR突变患者治疗全程中,接受过靶向治疗和化疗的获益>仅接受靶向治疗的获益>仅接受化疗的获益。因此对于EGFR突变患者,一代TKI先用或者后用,生存获益相当。直至三代EGFR-TKI的出现,一线使用相较一代TKI,显著的改善了患者的PFS和OS。 那么,众多免疫检查点抑制剂一线使用和二线使用,患者生存获益有区别吗?请见本文分解。
千方百计 为延长生存而不懈努力
免疫联合化疗一线治疗驱动基因阴性NSCLC的III期研究中,除KEYNOTE-189和407研究是以PFS和OS作为双终点,其他III期研究均是以PFS作为主要研究终点,OS则是重要的次要研究终点。同时,这些研究均允许对照组在进展后,交叉接受免疫治疗。因此,后线免疫交叉率也会影响对照组mOS结果,因为患者仍可从二线免疫治疗中获益。以KEYNOTE系列、CameL系列和RATIONALE系列III期研究为例,最终统计的对照组交叉率如图所示,总体三项研究对照组的交叉率相当。
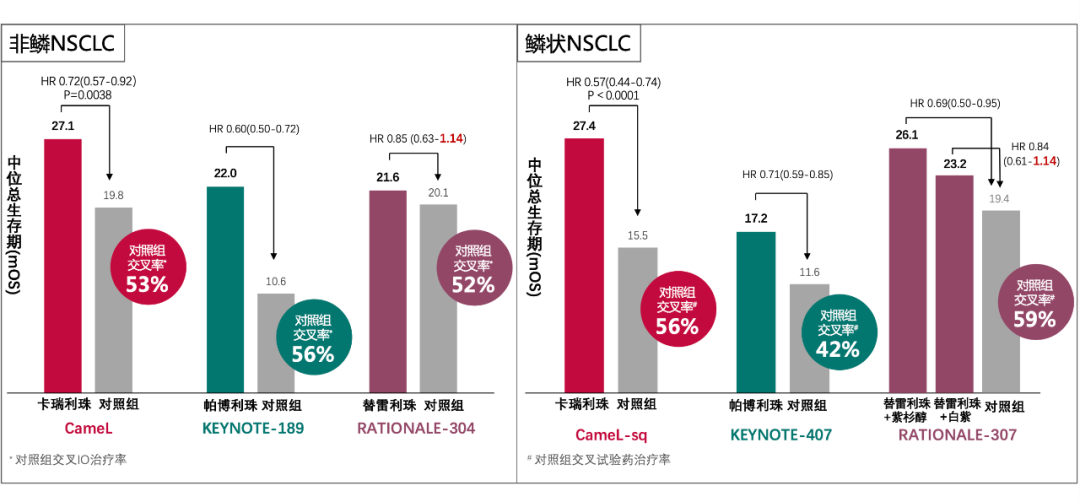
图1 NSCLC 免疫治疗III期研究mOS与交叉率数据
在对照组交叉率相当的情况下,一线使用卡瑞利珠单抗或帕博利珠单抗的获益更加明显。究其原因,主要是由于卡瑞利珠单抗和帕博利珠单抗联合化疗一线使用相较化疗,PFS2可以获得显著改善。在2020年WCLC大会上公布的CameL研究PFS2结果显示,卡瑞利珠单抗组PFS2为18.9个月(对照组12.5个月),结果表明一线使用卡瑞利珠单抗比二线使用获益更显著。KEYNOTE-189和407研究公布的PFS2结果也得出相同结论,即卡瑞利珠单抗和帕博利珠单抗应一线使用,患者生存获益更多。

图2 三项研究PFS2数据
CameL研究对照组交叉率高达53%,卡瑞利珠单抗组仍取得显著OS获益,HR值为0.72(0.57-0.92),显著降低死亡风险28%。CameL-sq研究对照组交叉率也高达56%,在如此高交叉率情况下,卡瑞利珠单抗组仍取得显著获益,HR值更低,为0.57(0.44-0.74),显著降低死亡风险43%,充分体现了一线应用强效型PD-1卡瑞利珠单抗的更高生存获益。
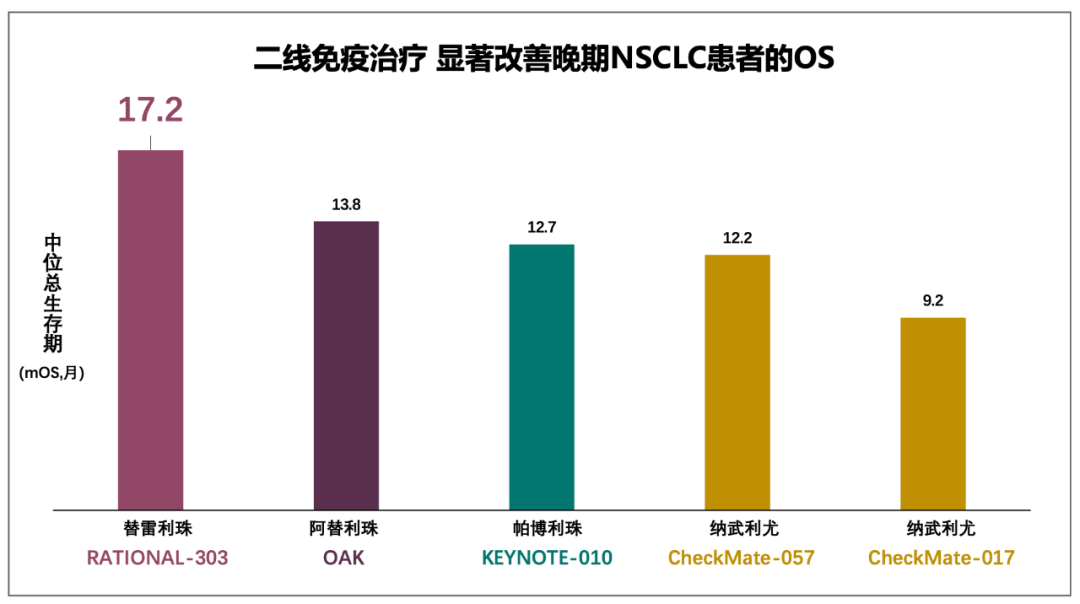
不同的是,在对照组交叉率相当的情况下,一线应用替雷利珠单抗mOS的获益有限(HR值上限超过1)。究其原因,可能是二线及后线应用替雷利珠单抗,患者获益更加显著。RATIONALE-303研究提示,NSCLC患者二线及以上采用替雷利珠单抗治疗,mOS达17.2个月,明显高于其他免疫检查点抑制剂二线III期研究1年左右的mOS。
RATIONALE-304研究中替雷利珠单抗联合化疗一线治疗mOS 21.6个月 vs 化疗20.1个月,对照组交叉IO治疗率52.3%(其中72.4%交叉接受了替雷利珠单抗治疗),可见一线使用替雷利珠单抗与二线及以上使用替雷利珠单抗,患者生存获益相当。替雷利珠也获批了二线治疗的适应症,且已纳入医保,为二线治疗带来更优选择。
特别值得注意的,CameL研究和RATIONALE-304研究的对照组交叉IO治疗率相当(53% vs 52%),两个研究对照组的mOS数值也是相近的(19.8个月vs 20.1个月),但两个研究试验组的mOS却有不小差异(CameL:27.1个月,RATIONALE-304:21.6个月)。一线应用卡瑞利珠单抗联合化疗,对照组无需对交叉治疗进行统计学矫正,试验组依然能够显著延长患者OS,充分展现了卡瑞利珠单抗一线使用的临床价值。同时4年生存随访数据显示,卡瑞利珠单抗一线使用,让超1/3的患者生存突破4年,给更多患者带来了临床治愈的希望。
但使龙城飞将在,不教胡马度阴山
合理排兵布阵,最大化获益
免疫治疗给晚期NSCLC患者带来了生存获益,有多种临床可及的药物选择,如何派兵布阵是关键。卡瑞利珠单抗一线治疗让晚期非鳞NSCLC患者的mOS超过27个月,4年OS率高达37.2%,让更多患者生存期突破4年。卡瑞利珠单抗和帕博利珠单抗的PFS2的结果也提示,一线使用卡瑞利珠单抗和帕博利珠单抗,才能最大化OS获益。而RATIONALE系列研究结果提示,二线及以上应用替雷利珠单抗可以显著的延长患者生存。
卡瑞利珠单抗联合化疗一线治疗非鳞癌和鳞癌均已纳入国家医保目录,进一步提高了患者的可及性。同时CameL和CameL-sq研究相互印证,奠定了卡瑞利珠单抗一线治疗的优选地位。相信随着免疫检查点抑制剂临床应用的普及,有更多中国晚期NSCLC将实现长生存获益,也期待卡瑞利珠单抗未来有更多长生存的数据公布。
以下是本文涉及研究的数据更新解读,以飨读者。
帕博利珠单抗一线治疗NSCLC公布5年生存数据
KEYNOTE-189和KEYNOTE-407研究分别是帕博利珠单抗联合化疗一线治疗非鳞NSCLC和鳞状NSCLC的III期研究[4]。两项研究在2022年ESMO会议上均公布了5年生存随访数据。KEYNOTE-189结果显示,帕博利珠单抗联合化疗一线治疗非鳞NSCLC的mOS为22.0个月(vs对照组10.6个月),HR值 0.60(0.50-0.72),帕博利珠单抗组的4年OS率为23.6%,5年OS率为19.4%。KEYNOTE-407结果显示,帕博利珠单抗联合化疗一线治疗鳞状NSCLC的mOS为17.2个月(vs对照组11.6个月),HR值 0.71(0.59-0.85),帕博利珠单抗组的4年OS率为21.9%,5年OS率为18.4%[2,3,10]。
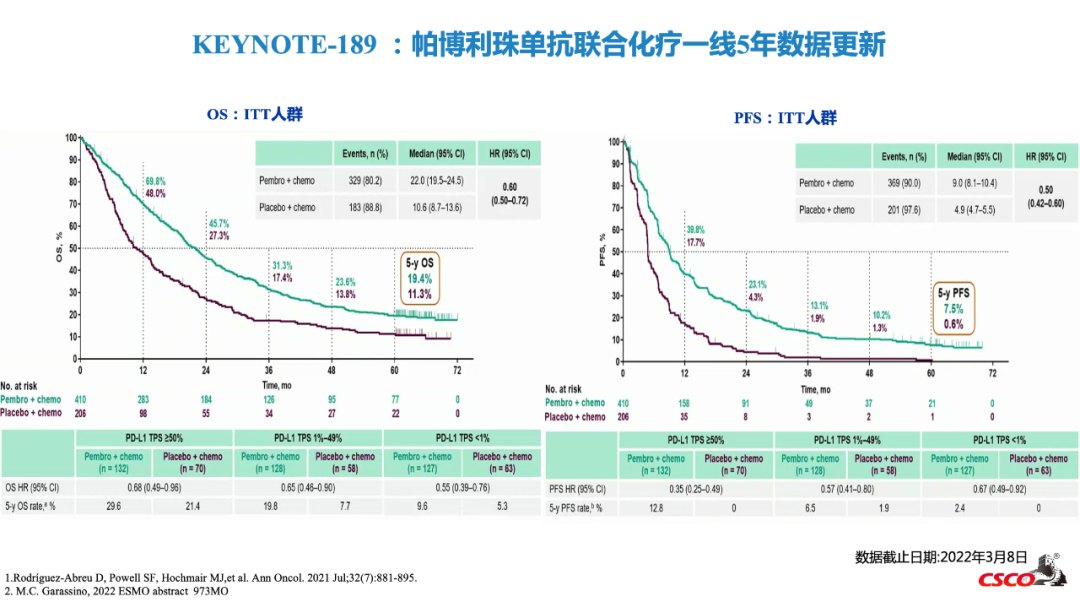
2023 CSCO指南更新要点:Keynote-189研究5年数据更新[6]
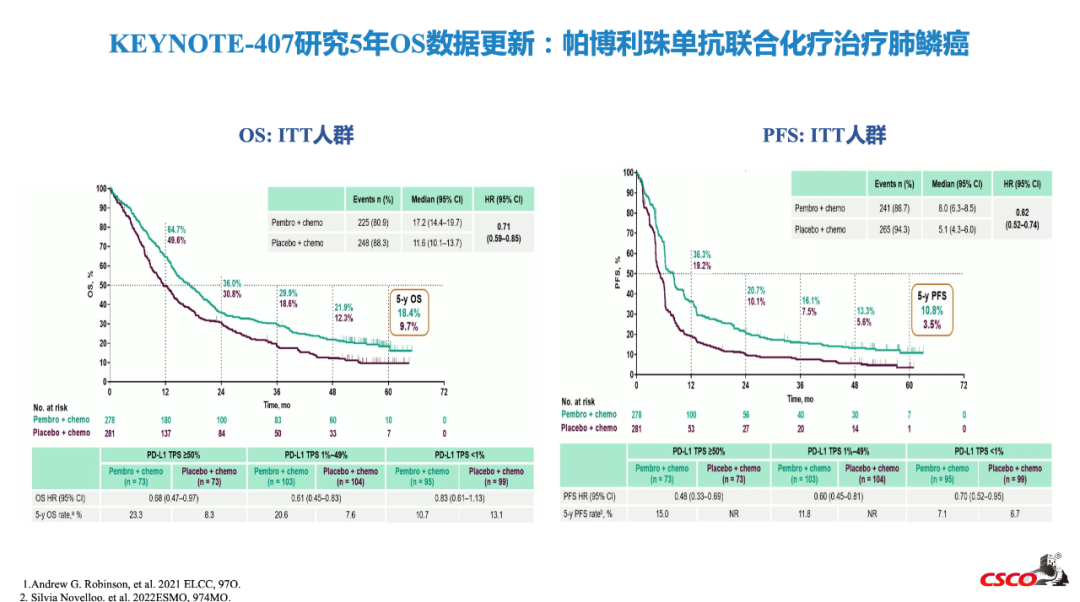
2023 CSCO指南更新要点:Keynote-407研究5年数据更新[6]
黄沙百战穿金甲 不破楼兰终不还
卡瑞利珠单抗一线治疗NSCLC中位总生存期突破2年
CameL和CameL-sq研究分别是卡瑞利珠单抗联合化疗一线治疗非鳞NSCLC和鳞状NSCLC的III期研究。2023年1月,CameL研究在JTO杂志上重磅公布了4年长期随访数据(数据截止时最短随访43.9个月),卡瑞利珠单抗联合化疗组中位总生存期(mOS)达27.1个月,与对照组(19.8个月)相比延长了7.3个月,显著延长了总生存期(HR=0.72, 0.57–0.92, P=0.0038)。卡瑞利珠单抗联合化疗组中位无进展总生存期(mPFS)达11.0个月,与对照组(6.5个月)相比,延长了近1倍[5]。
更为重要的,卡瑞利珠单抗联合化疗组4年的OS率高达37.2%(对比化疗组25.6%),这意味着卡瑞利珠单抗让超过1/3的患者生存期突破4年。同时值得强调的是,数据显示3年的OS率为39.3%,而4年的OS率为37.2%,一年的时间OS率仅下降2个百分点,这说明卡瑞利珠单抗的给患者带来的生存拖尾效应已经强劲展现[5]。在这样的数据下,有理由相信更多患者的生存期将突破5年,达到临床治愈。
同时,长期随访下,4年PFS率也高达15.6%(对照组0%),卡瑞利珠单抗让更多患者实现长期无病生存[5]。卡瑞利珠单抗也成为目前唯一公布NSCLC患者4年长生存数据的国产免疫检查点抑制剂。

2023 CSCO指南更新要点:CameL研究4年数据更新[6]
2022ELCC大会上,公布了CameL-sq研究3年随访数据。卡瑞利珠单抗联合化疗治疗鳞状NSCLC的mOS达27.4个月,与化疗组相比,mOS延长了接近1年(27.4个月对15.5个月),死亡风险显著降低43%(HR=0.57, 0.44-0.74, P<0.0001)。同时,卡瑞利珠单抗联合化疗组3年的OS率高达42.8%,体现了强效PD-1的长拖尾效应,让更多鳞癌患者获得长生存[12]。
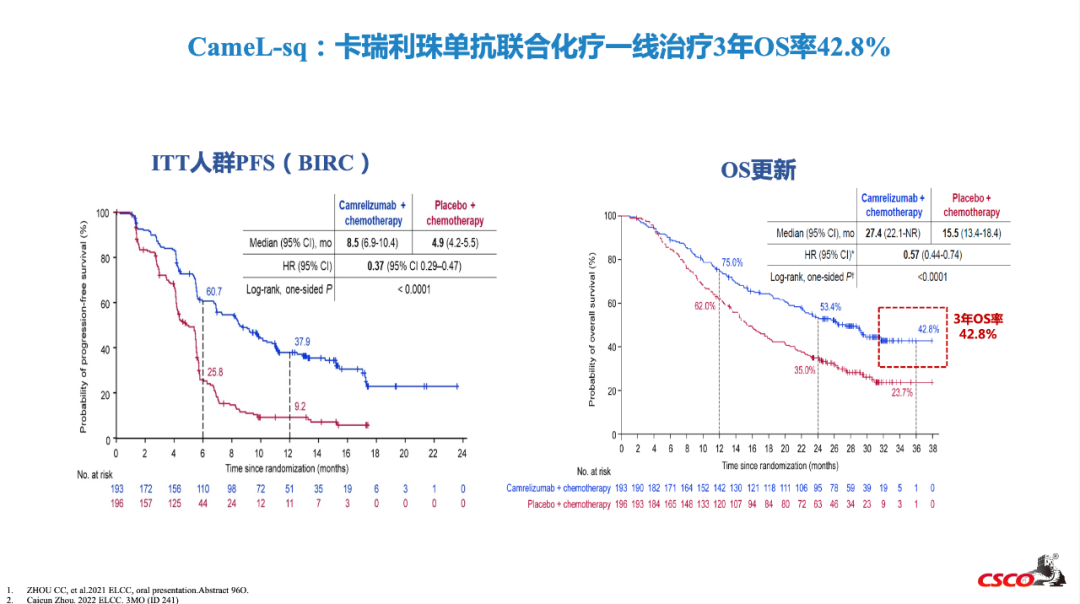
2023 CSCO指南更新要点:CameL-sq研究3年数据更新[6]
替雷利珠单抗一线治疗NSCLC mOS最终分析结果公布
RATIONALE-304和RATIONALE-307研究分别使是替雷利珠单抗联合化疗一线治疗非鳞NSCLC和鳞状NSCLC的III期研究 [7]。在2022年ESMO IO大会上,该两项研究均公布了更新的mOS结果。
RATIONALE-304更新结果显示,替雷利珠单抗联合化疗一线治疗非鳞癌mOS 为21.6个月(对照组20.1个月),相较对照组仅延长1.5个月,HR 0.85(CI: 0.63, 1.14),OS置信区间上线已超过1[8]。
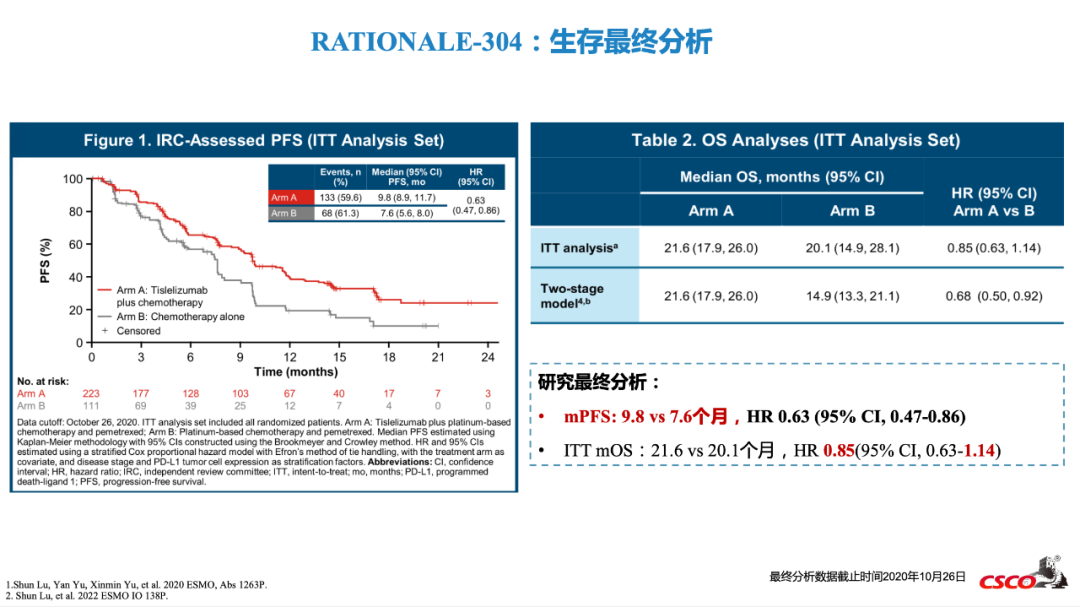
2023 CSCO指南更新要点:RATIONALE-304研究最终分析[6]
RATIONALE-307更新结果显示,替雷利珠单抗联合白紫/卡铂组的mOS为23.3个月(对照组为19.4个月),HR 0.84(CI: 0.61, 1.14),OS置信区间上线已超过1[14]。替雷利珠单抗联合紫杉醇/卡铂组mOS为26.1个月(对照组为19.4个月),HR 0.69(CI: 0.50-0.95)[15]。
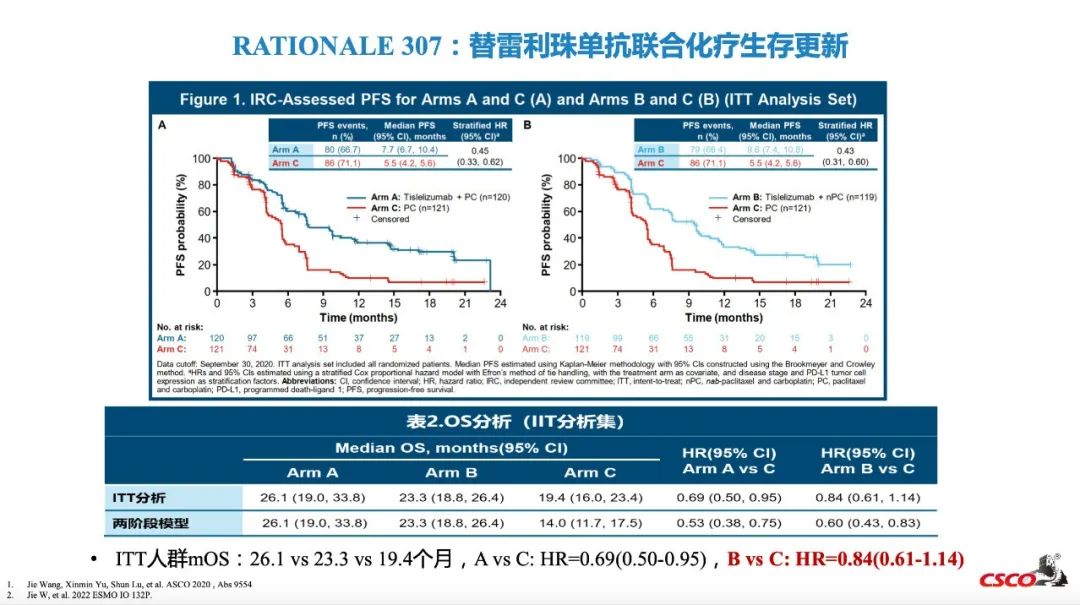
2023 CSCO指南更新要点:RATIONALE-307研究最终分析[6]
参考文献:
[1] 吉非替尼 IPASS, WJTOG3405, NEJ002;厄洛替尼 OPTIMAL, EURTAC, ENSURE;埃克替尼 CONVINCE
[2] Gadgeel S et al., J Clin Oncol 2020 May 10;38(14)
[3] Marina Garassino. 2022 ESMO. 973MO
[4] Zhou C et al. Lancet Respir Med 2021 Mar;9(3)
[5] Zhou C et al. J Thorac Oncol 2023 May;18(5)
[6] CSCO原发性NSCLC指南 2023版更新解析(不可手术局晚和晚期驱动基因阴性部分):https://mp.weixin.qq.com/s/VW-O7sIP_PD_uKTWDj07sA
[7] Shun Lu, et al. 2020 ESMO. 1263P
[8] Shun Lu, et al. 2022 ESMO IO. 138P
[9] Paz-Ares L, et al. J Thorac Oncol 2020 Oct;15(10)
[10] Silvia Novello. 2022 ESMO. 974MO
[11] Ren S, et al. J Thorac Oncol 2022 Apr;17(4)
[12] Zhou C, et al. 2021ELCC. Abstract 96O
[13] Jie Wang, et al. 2020 ASCO. Abstract 9554
[14] Wang J, et al. JAMA Oncol 2021 May 01;7(5)
[15] Jie Wang, et al. 2022 ESMO IO. 132P

