【BCJ】加拿大3821例NDMM ASCT后的真实世界结局
时间:2023-09-15 14:03:31 热度:37.1℃ 作者:网络
NDMM 一线ASCT的结局
作为初始治疗的一部分,自体干细胞移植 (ASCT) 仍然是适合移植新诊断多发性骨髓瘤 (NDMM) 患者的重要选择。加拿大学者使用骨髓瘤研究组 (CMRG) 国家数据库,分析了2007年-2021年间,3821例适合移植加拿大 MM 患者接受作为 ASCT一线治疗的详细信息和结局,包括串联移植,研究结果近日发表于《Blood Cancer Journal》。

研究结果
患者特征
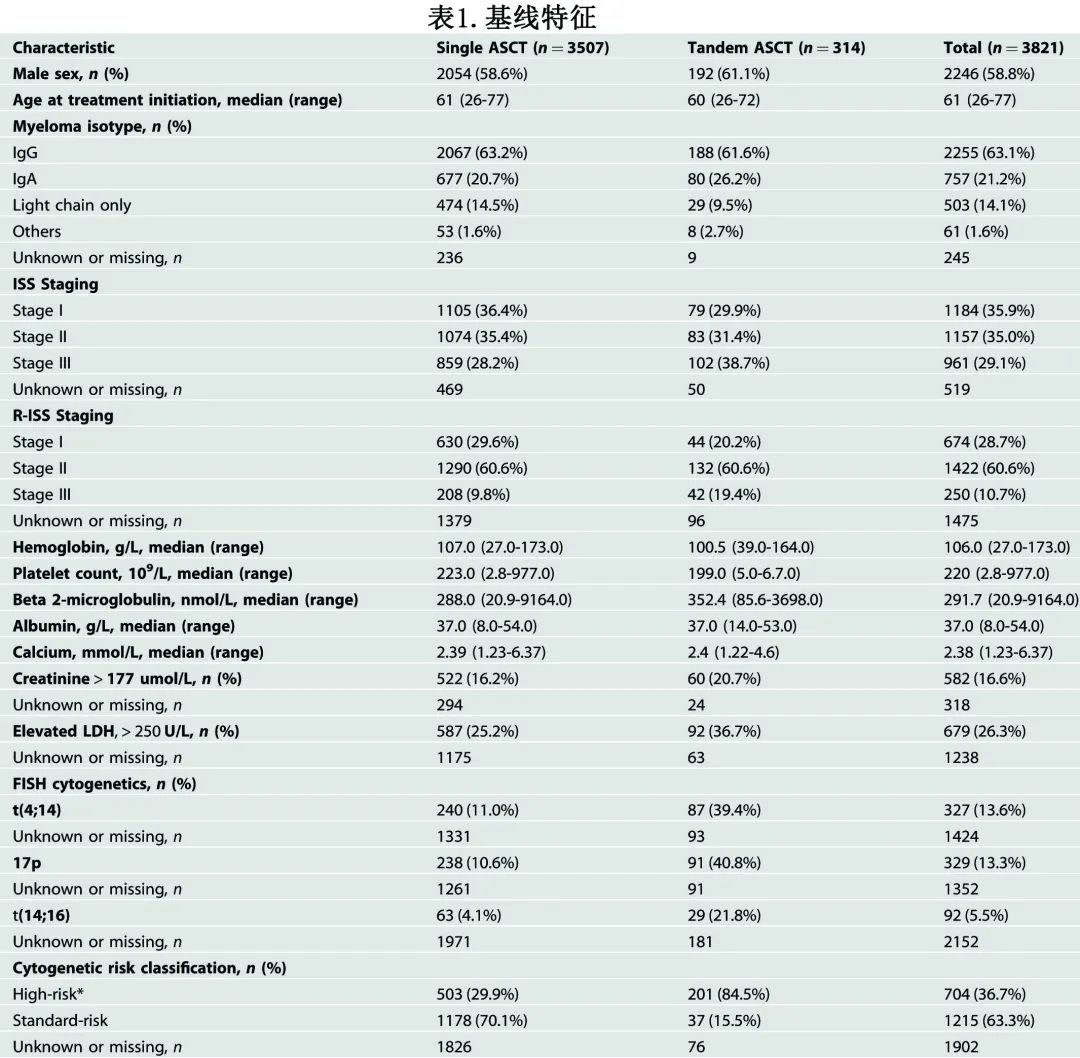
3821例患者的基线特征按单次或串联 ASCT 分层,见表1。总体而言,中位年龄为61岁,大多数为男性。16%的患者表现为明显的肾功能不全(血清肌酐>177 μmol/L)。从诱导治疗开始至 ASCT 的中位时间为5.6个月。大多数患者接受了单次ASCT(92%),而8%接受了串联ASCT。串联 ASCT 组除 LDH 升高、中位β2-微球蛋白值升高、ISS/R-ISS III期和高危细胞遗传学中更常见外,其他特征在单次和串联 ASCT 组平衡良好。整个人群中49.8%患者的细胞遗传学风险数据未知或缺失;对于细胞遗传学风险数据可用的患者,36.7%为高危 FISH 细胞遗传学,63.3%为标危。大多数接受串联 ASCT 的患者 (84%) 记录了高危细胞遗传学。
诱导治疗和ASCT
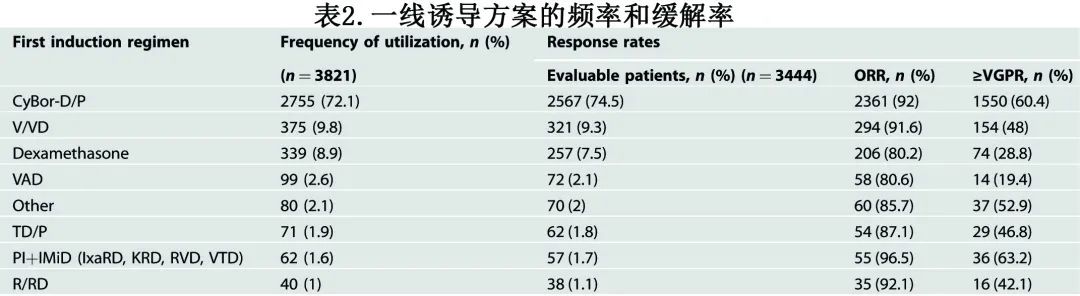
3821例患者中的大多数 (82%) 接受硼替佐米为基础的诱导方案,主要是CyBorD(环磷酰胺、硼替佐米和地塞米松),占72.1%(表2),仅1.6%的患者接受蛋白酶体抑制剂 (PI) 联合免疫调节剂 (IMiD)诱导治疗。对于最常用的诱导治疗方案(即CyBorD),ORR为92%,60.4%达到≥VGPR;整个队列的 ORR 为90.7%,≥VGPR率为55.5%。
由于首次诱导时缓解不佳或进展,根据医生的决定,10%的患者在进行 ASCT 前接受了第二次诱导方案(表3),其中仅4例需要第三次诱导 (4/376;1%)。从开始第二种诱导方案至 ASCT 的中位时间为4.2个月,该亚组中73.4%的患者接受了来那度胺为基础的治疗方案,二线诱导治疗的ORR为78.6%,≥VGPR率为38.4%。所有接受第二种诱导方案治疗的患者的 ORR 为72.9%,≥VGPR率为35.4%。

对于可评估患者,单次 ASCT 亚组(2984例患者)的 ORR 和≥VGPR率分别为96.4%和81.1%,串联 ASCT 亚组(291例患者)分别为98.3%和79.4%。
巩固治疗
仅205例 (5.3%) 接受巩固治疗,巩固治疗方案通常包括 PI 联合IMiD(72%)。具体巩固治疗方案包括:来那度胺+硼替佐米+/-类固醇 (55.6%)、来那度胺+/-类固醇 (21%)、来那度胺+伊沙佐米+/类固醇 (12.2%)、卡非佐米+来那度胺+类固醇 (4.4%)、硼替佐米+类固醇+/-环磷酰胺 (3.9%) 和其他方案 (2.9%)。总体而言,无论使用何种巩固治疗方案,ORR均为90.2%,205例患者中≥VGPR率为76.6%。巩固治疗的中位持续时间为63天。大多数接受巩固治疗的患者还接受了维持治疗 (90.7%)。
维持治疗
整个队列中2061例患者 (54%) 接受了维持治疗。个体治疗方案包括:来那度胺+/-类固醇(78.3%)、硼替佐米+/-类固醇(2.9%)、来那度胺+硼替佐米+/-类固醇(1.7%)、伊沙佐米+/-类固醇(1.6%)、来那度胺+伊沙佐米+/-类固醇(5.5%)和沙利度胺+/-类固醇(8.5%)。在接受来那度胺+/-类固醇维持治疗的1614例可评估患者中,最佳 ORR 为95.5%,≥VGPR率为89.7%。
根据细胞遗传学分类,大多数接受来那度胺和硼替佐米+/-类固醇(33/36例可评估患者,91.7%)或硼替佐米+/-类固醇(37/47,78.7%)联合维持治疗患者为高危,而在来那度胺+/-类固醇亚组中,仅28.5%为高危(278/976例可评估患者),而71.5%为标危(698/976)(其余患者的细胞遗传学风险数据未知)。值得注意的是,高危细胞遗传学亚组中278例患者 (62.8%) 接受了来那度胺为基础的维持治疗方案(来那度胺+/-类固醇)。
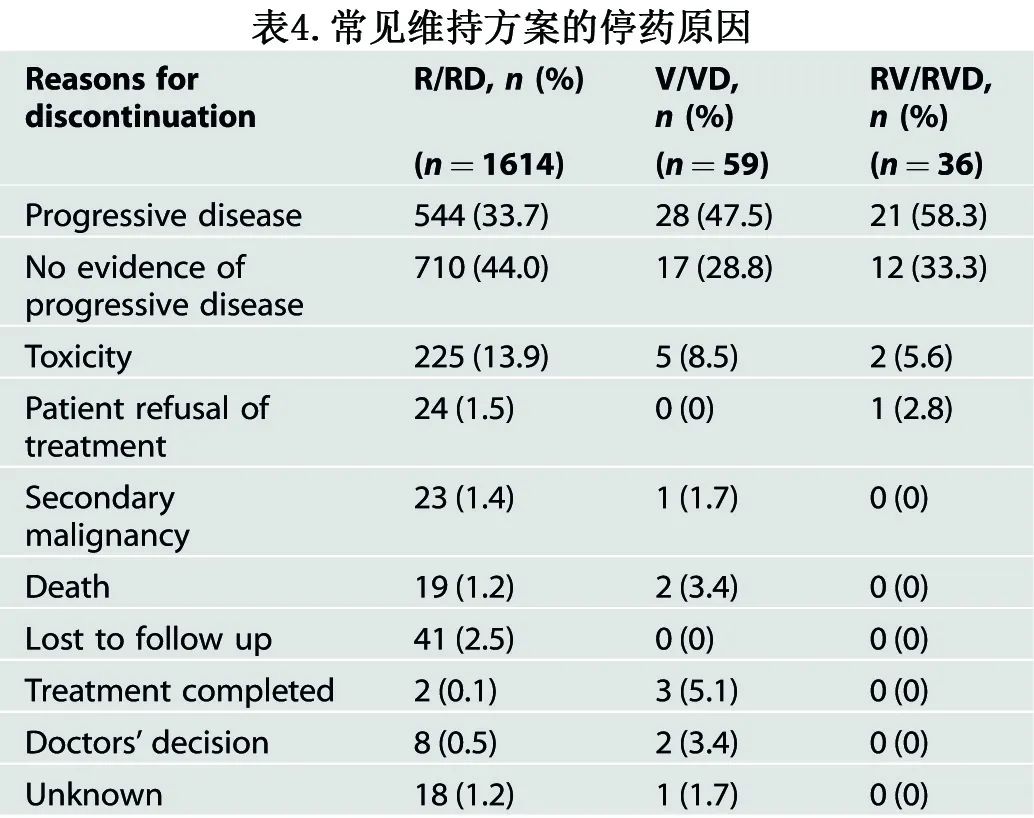
在接受所有维持治疗方案的2061例患者中,1173例患者 (56.9%) 在研究数据锁定时已停止治疗;这些患者维持治疗的中位持续时间为15.7个月。对于接受任何维持治疗的可评估患者(926例患者),中位治疗持续时间为17.6个月。对于停止来那度胺+/-类固醇维持治疗的859例患者 (41.7%),中位维持治疗持续时间为17.8个月。最常见维持治疗中止的原因总结见表4。疾病进展是中止维持治疗的最常见原因 (61.0%),这716例患者的中位维持时间为18.8个月;因毒性、继发性恶性肿瘤和死亡而停药的363例患者 (31.5%) 的中位维持持续时间为9.4个月。
临床结局
基于不同 ASCT 组分和细胞遗传学风险类别的结局见表5
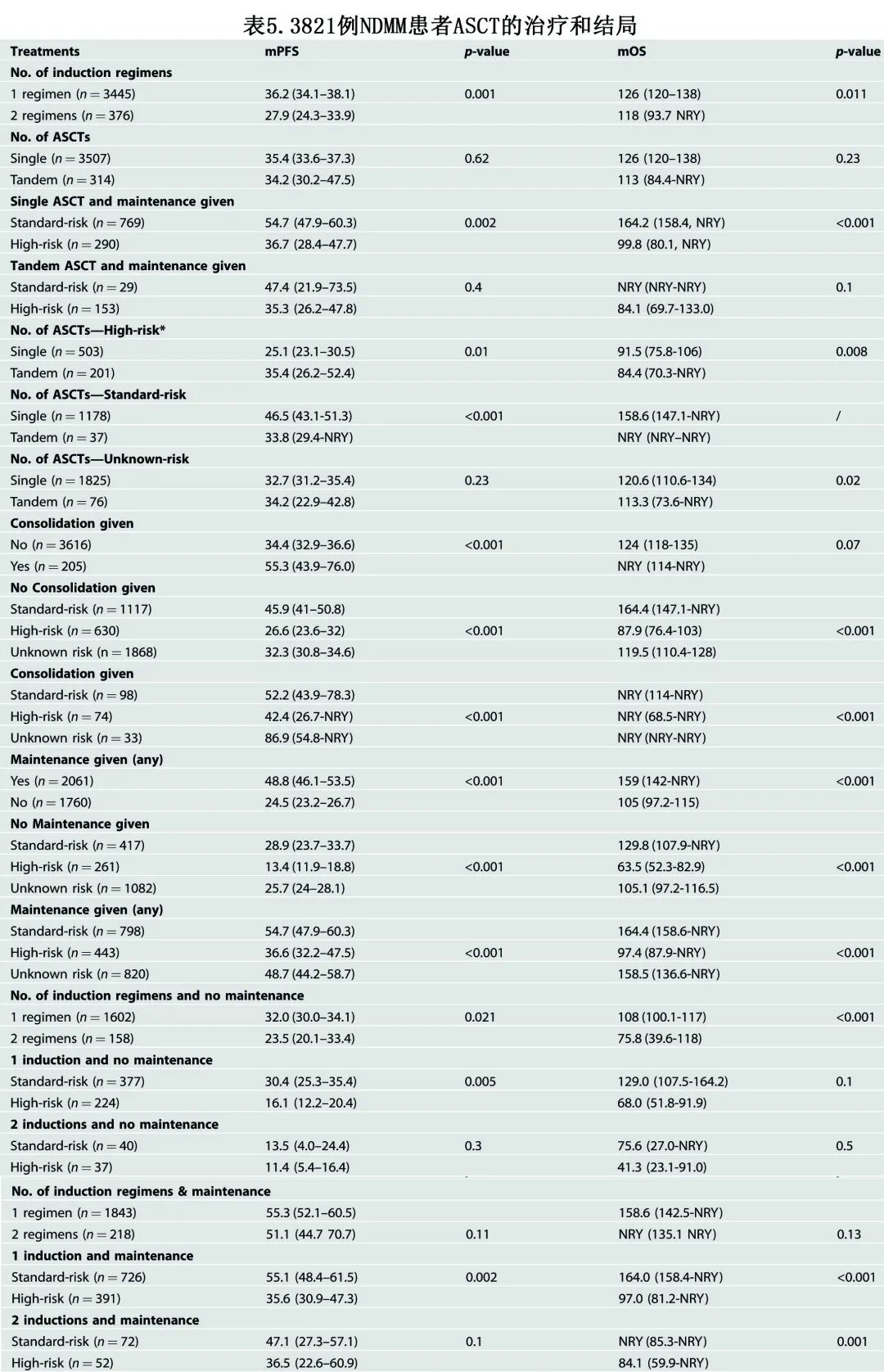
接受单次 ASCT 作为一线治疗的患者的中位 PFS 和 OS 分别为35.4个月和126个月。在高危 FISH 患者中,单次vs串联 ASCT 的中位 PFS 分别为25.1 vs 35.4个月 (p=0.01),中位 OS 分别为91.5 vs 84.4个月 (p=0.008);对于无高危 FISH 的患者,单次vs串联 ASCT 的中位 PFS 和 OS 分别为46.5 vs 33.8个月 (p<0.001) 和158.6 vs NYR(尚未达到)。对于接受单次 ASCT 和任何类型维持治疗的标危 MM 患者,中位 PFS 和中位 OS 分别为54.7个月和164.2个月;对于接受串联 ASCT 和任何类型维持治疗的高危 MM 患者,中位 PFS 和 OS 分别为35.3个月和84.1个月。对于接受任何类型维持治疗的高危患者,单次vs串联 ASCT 的中位 PFS 分别为36.7 vs 35.3个月 (p=0.80),中位 OS 分别为99.8 vs 84.1个月 (p=0.70)。
接受第二种诱导治疗方案的患者结局明显较差(中位PFS 27.9个月vs 36.2个月 [p=0.001];中位 OS 118 个月 vs 126 个月 [p=0.011]),然而当使用维持治疗时获得的结果相当,与给予的诱导治疗方案数量无关(中位PFS 55.3个月vs 51.1个月 [p=0.11];中位OS 158.6个月vs NYR [p=0.13])。对于接受任何类型维持治疗的患者,标危患者中一种 vs 两种诱导方案的中位 PFS 和 OS 分别为55.1 vs 47.1个月 (p=0.08) 和164个月vs NYR(p=0.90),高危患者分别为35.6 vs 36.5个月 (p=0.80) 和97.0 vs 84.1个月 (p=0.50)。
巩固治疗患者的中位 PFS 更长(55.3个月vs 34.4个月 [p=0.001]),但中位 OS 未显著延长 (p=0.065)。对于标危患者,未给予巩固治疗时的中位 PFS 为45.9个月,给予巩固治疗时的中位 PFS 为52.2个月 (p=0.01);中位 OS 分别为164.4个月和NRY (p=0.5)。对于高危人群,未给予巩固治疗时的中位 PFS 为26.6个月,给予巩固治疗时的中位 PFS 为42.4个月 (p=0.002);中位 OS 分别为87.9个月和NRY (p=0.6)。
对于维持(包括所有类型的维持)vs非维持队列,中位 PFS 和中位 OS 分别为48.8 vs 24.5个月 (p<0.001) 和 159 vs 105 个月 (p<0.001)(图1)。对于接受来那度胺、硼替佐米或两者(+/-类固醇)的患者,中位 PFS 分别为53.7个月vs 43.5个月vs 48.2个月,而中位 OS 分别为159个月 vs 115 个月vs NYR。在接受维持治疗的患者中,高危FISH 患者与非高危细胞遗传学患者的中位 PFS 分别为36.6个月和54.7个月,中位 OS 分别为97.4个月和164.4个月;高危 FISH 且未接受维持治疗的患者亚组效果不佳,中位 PFS 仅为13.4个月,中位 OS 为63.5个月。在所有风险亚组中,维持治疗均与更好的结局相关 (p<0.0001)。对于接受来那度胺为基础维持治疗的患者,因疾病进展而停药的患者的中位 PFS 为25个月,中位 OS 为94个月。
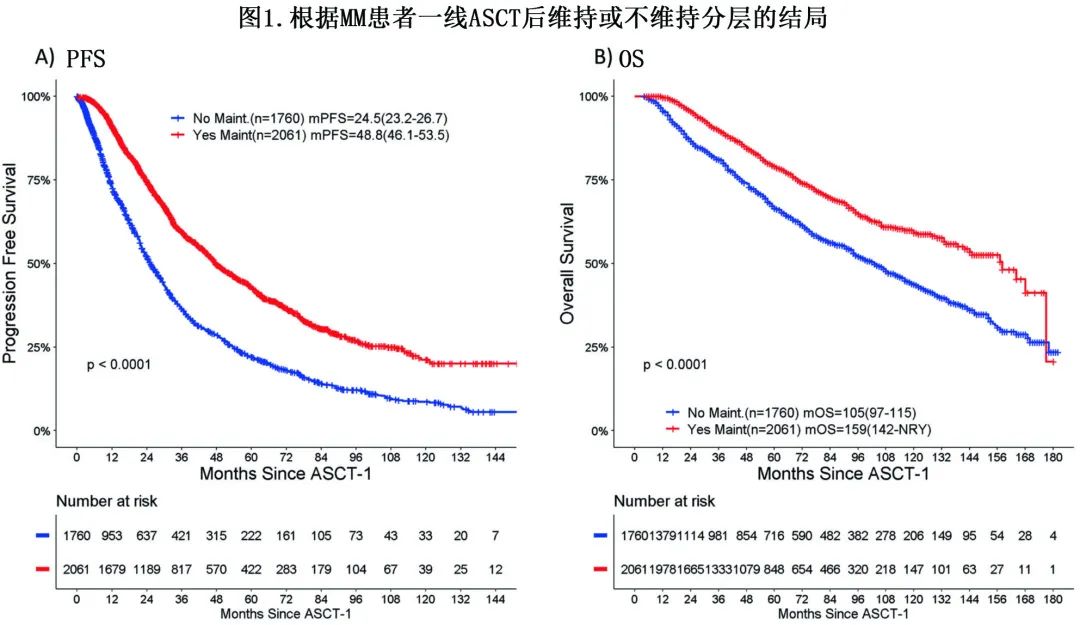
PFS和OS的单变量和多变量分析
表6总结了单变量和多变量分析的结果。在 PFS 的多变量分析中,与不利 PFS 显著相关 (p<0.001) 的疾病特征包括高β2-微球蛋白水平 (HR=1.23) 和高危细胞遗传学 (HR=1.56);≥2种诱导方案给药也与 PFS 较差相关 (HR=1.35),而维持治疗的使用与 PFS 显著延长相关 (HR=0.56;p<0.001)。OS 的多变量分析确定年龄增加 (HR=1.02)、LDH>250U/L (HR=1.51) 和高危细胞遗传学 (HR=1.91) 为不良因素,而接受任何类型维持治疗的患者与未接受维持治疗的患者相比,OS显著更好 (HR=0.58)。
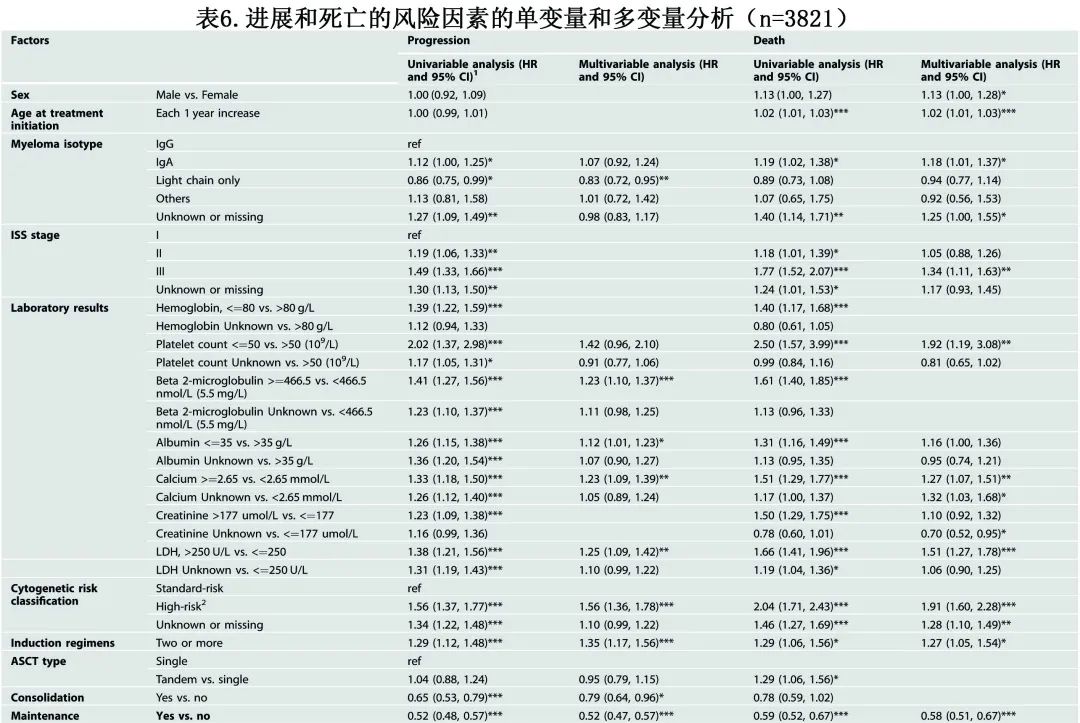
仅评估来那度胺+/-类固醇维持治疗vs无维持治疗作为预测因素,多变量分析对进展风险 (HR=0.48) 及死亡风险 (HR=0.53) 仍具有显著性,支持维持治疗可降低相关风险。分析其他维持治疗方案vs无维持治疗方案时也观察到相同趋势,进展风险的 HR=0.67,死亡风险的 HR=0.73,也有利于维持治疗。
总结
该加拿大CMRG 数据库的大型真实世界研究共纳入3821例一线接受ASCT的MM患者,72%接受 CyBorD 诱导治疗,2061例接受维持治疗,包括78.3%的来那度胺+/-类固醇维持治疗。接受单次 ASCT 的患者的中位 PFS 和 OS 分别为35.4个月和126个月。接受第二种诱导治疗方案的患者的结局显著较差,但当使用维持治疗时,结果相当,与给予的诱导治疗方案数量无关(中位PFS 55.3个月vs 51.1个月 [p=0.11];中位OS 158.6个月 vs 尚未达到 [p=0.13])。巩固治疗患者的中位 PFS 更长(55.3个月vs 34.4个月 [p=0.001]),但中位 OS 未显著延长 (p=0.065)。接受来那度胺为基础维持治疗的患者的中位 PFS 为53.7个月,OS为159个月。在多变量分析中,使用任何类型的维持治疗与不使用维持治疗相比,进展 (HR=0.52) 和死亡 (HR=0.58) 风险均降低。
该研究表明,硼替佐米和来那度胺整合到移植中,适合移植患者的一线治疗中位OS可≥10年,还强调了 ASCT 后维持治疗的作用,尤其是给予来那度胺直至疾病进展,包括有和无高危 MM 以及接受第二次诱导的亚组。此外在现代维持治疗时代,串联 ASCT 在高危患者中的作用仍需更好地界定。尽管最近使用 RVD 诱导的研究表明 PFS 和 OS 更长,RVD被认为是首选的诱导方案,但 CyBorD 诱导仍在许多国家和肾损害或血细胞计数较差的情况下使用。
参考文献
Julie Côté J,et al. Real-world results of autologous stem cell transplantation in newly diagnosed multiple myeloma: a report from the Canadian Myeloma Research Group database.Blood Cancer J . 2023 Sep 5;13(1):137. doi: 10.1038/s41408-023-00905-8.

