【衡道丨文献】弥漫性中线胶质瘤伴H3K27M突变型在成人与儿童患者中的分析研究
时间:2023-09-13 14:01:18 热度:37.1℃ 作者:网络
弥漫性中线胶质瘤,H3K27变异型属于儿童型弥漫性高级别胶质瘤,最常位于在脑桥、丘脑或脊髓中,偶见于小脑;好发于儿童(中位年龄: 5-11岁);影像特征:中线位置巨大占位,可强化,占位效应明显(梗阻性脑积水,脑室周围水肿);其组织学特点为瘤细胞通常具有高级别星形细胞瘤样形态,部分病例可呈现低级别形态,缺乏核分裂、微血管增生和坏死等高级别特征(约10%);免疫组化:肿瘤瘤细胞表达S100、Oligo-2和Vimentin,H3K27M核染色阳性及H3K27me3表达缺失,GFAP表达具有可变性;p53核表达阳性, 提示存在TP53突变(约50%);ATRX突变导致ATRX核表达阴性(约10-15%)。
研究介绍
样本介绍
作者回顾了2012-2020年在四川大学华西医院诊治的164例分子确诊的H3K27M突变弥漫性中线胶质瘤患者;病例的纳入标准为:(1)弥漫性胶质瘤(影像学和病理诊断);(2)肿瘤位于中线;(3)测序证实为H3K27M突变。
研究方法
免疫组化:GFAP、OLIG2、ATRX、H3K27M、P53、IDH1、Ki-67;分子研究:一代测序:IDH1/2、H3F3A、HIST1H3B、BRAF、TERT启动子区;甲基化测序:O6-甲基鸟嘌呤DNA甲基转移酶(MGMT)启动子甲基化状态。
临床病理及分子特征
儿童最常见的解剖位置是脑干,而成人是丘脑;成人H3K27M-mt DMGs的ATRX缺失的频率高于儿童;成人H3K27M-mt DMGs的H3.3突变的频率高于儿童;成人患者的总生存期好于儿童患者。
组织学特征
大多数表现为星形细胞瘤形态,9例含有少突胶质细胞瘤样特征;微血管增生、肿瘤性坏死和多核巨细胞多见;假菊形团、钙化、神经毡岛、Rosenthal纤维和原始神经成分少见。

图A,弥漫性浸润性胶质瘤,组织学分级2级。
图B,弥漫性浸润性胶质瘤,常规组织学分级3级(箭头显示核分裂)。
图C和D为常规组织学分级为4级的胶质瘤,伴有微血管增生和瘤巨细胞。
图E、上皮样细胞,胞浆嗜酸性。
图F,少突胶质细胞样形态。
图G、Rosentha纤维。
图H、假菊形团。
免疫表型
H3K27M:79/80例弥漫性阳性(60: 弥漫强阳;19:强弱混合,1:少数阳性);GFAP:147/157例弥漫性阳性,10例呈不同比例阳性;OLIG2: 136/151例弥漫性阳性,15例呈不同程度阳性;P53:94/132例弥漫强阳性;ATRX:35/137例表达缺失;Ki-67:2%~70%。
小结

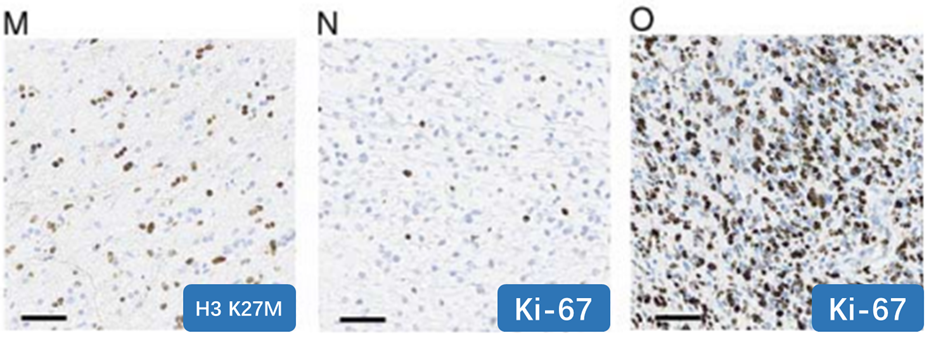
图I,肿瘤细胞ATRX表达缺失(内参照为阳性)。
图J,P53核强阳性。
图K,H3K27M的弥漫性强核阳性。
图L,H3K27M强弱混合阳性。
图M,H3K27M染色1例符合马赛克阳性。
图N,Ki-67指数低(<5%)。
图O,高Ki-67指数(>70%)。
分子特征
H3.3和H3.1:152/164和12/164例K27M突变。成人组H3.3K27M突变率明显高于儿童组;TERT启动子:4/75例突变;MGMT基因启动子:6/70例甲基化;未发现IDH1/2和BRAF突变。
预后分析
成人组的预后较好;肿瘤直径>3cm的患者预后明显差于肿瘤直径≤3cm的患者;脑干肿瘤患者的预后比其他位置肿瘤患者更差;ATRX表达缺失的患者预后明显好于正常患者;Ki-67指数>5%的患者预后较差。
讨论
弥漫性中线胶质瘤,H3 K27变异型
是一种浸润性中线神经胶质瘤伴有H3 p.K28me3 (K27me3) 缺失和下列三种之一的分子改变一种组蛋白H3亚型基因突变(H3 c.83A>T p.K28M,K27M) 或EZHIP异常过表达或EGFR突变(CNS WHO 4 级)。
流行病学
这一新命名的肿瘤实体,流行病学资料是缺乏的。其中弥漫性内生性桥脑胶质瘤(DIPG)的发病率约每年0.54例/100万人,在20岁以下的人群中每年2.32例/100万,无性别偏好。DIPG占所有小儿脑肿瘤的10-15% ,占所有儿童脑干肿瘤的75%。丘脑漫性中线胶质瘤(DMG)较为罕见,占小儿脑肿瘤的1-5%(占丘脑肿瘤的25%)。脊髓DMG约占儿童和成人脊髓星形细胞瘤的40%。EGFR突变DMG最常发生在儿童,患者中位年龄为7-8岁。在儿童中,H3.3 p.K28M (K27M)突变型DMG和具有EZHIP过表达的H3野生型DMG发病高峰年龄为7-8岁,而H3.1或H3.2 p.K28M (K27M)突变型DMG发病年龄更小(患者中位年龄:~5 岁)。
临床特征
儿童弥漫性中线胶质瘤 (DMG) 好发于脑干或脑桥(后者称为弥漫性内生型桥脑胶质瘤[DIPG])或者双侧丘脑,而青少年和成人主要出现在单侧丘脑或脊髓。其他中线部位,如松果体区、下丘脑和小脑少见。大量DIPG的尸检研究显示,40%的病例可累及软脑膜,或者扩散至丘脑、颈髓甚至额叶。大多数 DIPG 患者病史较短(< 2 个月),具有典型的三联征:颅神经麻痹 (82%)、长束征,如锥体束损伤 (51%) 和共济失调 (62%)。丘脑DMG的常见初始症状包括颅内高压和运动或感觉障碍。DMG的预后很差,2年生存率<10%。由于肿瘤发生位置特殊,手术选择有限。携带H3.1或H3.2 p.K28M (K27M)突变或伴有EZHIP过表达的DMG患者的总生存期(16 个月)略长于携带 H3.3 p.K28M (K27M)突变的DMG患者(11 个月)。与较长生存期有关的因素包括:年龄(<3或>10岁)、较长的症状潜伏期(>24周)和系统性治疗。
病理特征
大体特征:
肿瘤细胞弥漫性浸润脑实质引起脑组织水肿,导致解剖结构的肿大和变形,出血或坏死区导致组织软化和颜色改变。
镜下特征:
DMG弥漫性浸润脑实质,通常缺乏血管及神经侵犯。大多数细胞是小而单形的,但也可以是多形的,显示为星形细胞、毛细胞、少突胶质细胞、巨细胞、未分化或上皮样细胞形态。尽管有丝分裂很常见并且微血管增殖和/或坏死可能存在,但这些特征并不是诊断所必需的,它们也不是生存的独立预测因子。通常无Rosenthal 纤维和嗜酸性颗粒小体。在伴有EGFR突变的DMG中,通常存在核分裂象,但坏死或微血管增生很少见。无论是否存在微血管增生或坏死,DMG都被视为CNS WHO 4级。
免疫组化染色:
(1)阳性:所有瘤细胞表达S100、Oligo2、MAP2,GFAP表达具有可变性;大约50%的病例显示p53的核阳性,表明伴有的TP53突变。
(2)阴性:15% 的病例ATRX核缺失表达(突变)。
分子病理:
编码组蛋白H3第27位赖氨酸残基的甲基化位点突变H3F3A, HIST1H3B, HIST1H3C。(H3F3A--编码H3.3蛋白;HIST1H3B/3C--编码H3.1蛋白)
鉴别诊断
各种中线局限性胶质或胶质神经元肿瘤,包括毛细胞星形细胞瘤、室管膜下瘤和节细胞胶质瘤,已被发现具有相同的 H3 p.K28 (K27) 突变;尽管 H3 p.K28M (K27M) 突变可能使这些肿瘤的预后较差,但不应将其诊断为 H3 K27变异型的DMG。在后颅窝A组 (PFA) 室管膜瘤中,H3 p.K28 (K27) 突变极为罕见,但会发生 H3 p.K28me3 (K27me3) 缺失或 EZHIP过表达;这些肿瘤可以通过形态结合免疫组化染色结果与 DMG 区分开来。
参考文献及书籍:
1. WHO Classification of Tumors of the Central Nervous System.5th Edition
2. Am J Surg Pathol. 2022 Jun 1;46(6):863-871.


