J Hepatol:海军军医大学卫立辛/吴东/复旦大学焦石/同济大学周兆才发现肝细胞抗PD-1治疗产生耐药性的新机理
时间:2023-09-11 19:58:43 热度:37.1℃ 作者:网络
重塑肿瘤微环境是治疗晚期肝细胞癌(HCC)的关键策略。然而,人们对微环境中不同的细胞群如何介导肿瘤对免疫疗法(如抗PD-1)的耐药性仍然知之甚少。
2023年9月6日,海军军医大学卫立辛、吴东、复旦大学焦石、同济大学周兆才共同通讯在Journal of Hepatology在线发表题为“Immunosuppressive CD10+ALPL+neutrophils promote resistance to anti-PD-1 therapy in HCC by mediating irreversible exhaustion of T cells ”的研究论文,该研究表明免疫抑制性CD10+ALPL+中性粒细胞通过介导T细胞的不可逆耗竭来促进肝细胞抗PD-1治疗的耐药性。该研究发现CD10+ALPL+ NEUs与抗PD-1治疗的耐药相关。这些NEUs在细胞数量、频率和基因谱方面表现出强烈的免疫抑制活性,诱导T细胞明显的“不可逆”耗竭。
机制上,特异性CD10+ALPL+ NEUs 被肿瘤细胞诱导,即肿瘤分泌的NAMPT通过NTRK1对CD10+ALPL+ 17 NEUs进行重编程,维持其未成熟状态,抑制CD10+ALPL+ NEUs的成熟和活化。总的来说,该研究揭示了一个涉及CD10+ALPL+ NEUs的肿瘤免疫逃避持久抗PD-1治疗的基本机制,为免疫治疗靶点或抗PD-1协同治疗方案提供了进一步的见解。

肝细胞癌(HCC)是一种常见病,其病程发展受免疫系统调节。使用检查点抑制剂(如抗PD-1)进行免疫治疗在一部分HCC患者中显示出很强的抗肿瘤活性,并已成为晚期HCC的一线治疗标准。长期炎症刺激导致的肝癌肿瘤微环境的不断选择和进化,可能会诱发肿瘤对免疫治疗产生耐药性。事实上,大多数被研究的HCC患者在免疫检查点阻断后都表现出耐药性或复发。已有研究表明,先天免疫系统和适应性免疫系统之间的功能失调相互作用可通过抗原识别受损或产生免疫抑制肿瘤微环境来促进肿瘤逃避免疫系统。因此,微环境中不同细胞群之间的相互作用和竞争如何驱动和/或重塑肿瘤对免疫治疗的耐药性,机制上仍有待充分阐明。
肿瘤逃避免疫系统的一种潜在方式是T细胞,特别是CD8+ T细胞的耗竭。PD-1阻断可使耗竭的CD8+ T细胞重新活化,具有良好的治疗效果。最近在CD8+ T细胞中发现的耗竭相关基因可能为实现更有希望的抗PD-1/PD-L1治疗提供新的途径。在黑色素瘤患者中观察到耗尽T细胞的前体和终末亚群。与终末耗竭的T细胞相比,前体耗竭的CD8+ T细胞对抗PD-1表现出更好的应答。最近有报道称,中性粒细胞胞外陷阱可促进肿瘤微环境中的T细胞耗竭。中性粒细胞从骨髓转运到外周血,并随后浸润到炎性肿瘤微环境,导致了它们的时空异质性。因此,中性粒细胞可塑性的调控与它们所涉及的微环境是分不开的。机会性癌细胞通常利用中性粒细胞的显著可塑性来建立适合癌细胞存活的微环境。
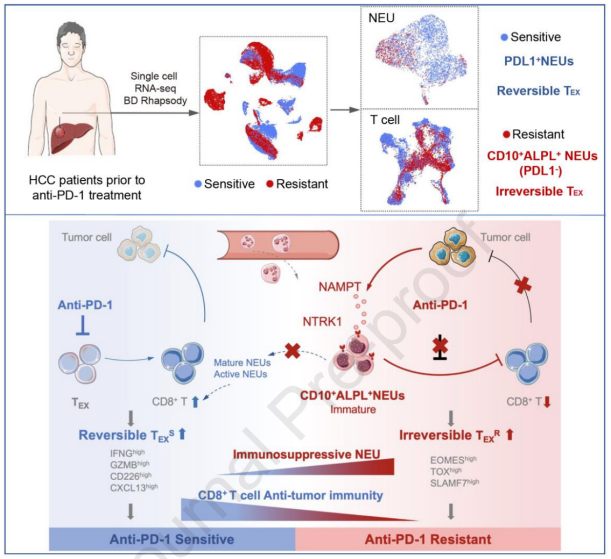
机理模式图(图源自Journal of Hepatology)
在之前的研究中,作者观察到中性粒细胞-淋巴细胞比率升高与肿瘤对抗PD-1治疗的耐药相关。尽管存在表达抑制性配体PDL1的中性粒细胞,但HCC已被发现对抗PD-1具有耐药性。中性粒细胞在体内平衡和感染期间被观察到在单细胞分辨率下表现出高度的异质性。因此,高度异质性中性粒细胞的分子特征及其对抗PD-1耐药的特异性贡献需要进一步研究。
该研究发现,CD10+ALPL+中性粒细胞 (NEUs)与HCC中肿瘤对抗PD-1治疗的耐药性密切相关。这些中性粒细胞表现出明显的免疫抑制特征,即在肿瘤微环境中驱动T细胞的不可逆耗竭。此外,作者发现肿瘤分泌的NAMPT通过NTRK1重编程CD10+ALPL+ NEUs,并揭示了NAMPT在维持CD10+ALPL+ NEUs的未成熟状态和抑制其分化中的作用。该研究为阐明免疫治疗耐药的关键细胞类型和分子机制提供了新的理论基础,并为中性粒细胞和T细胞之间的相互作用提供了进一步的见解,从而驱动免疫抑制肿瘤微环境成为免疫治疗的障碍。
原文链接:
https://www.journal-of-hepatology.eu/article/S0168-8278(23)05078-X/fulltext#%20


