Circ Res.:内皮细胞FIS1去SUMO化可预防缺氧性肺动脉高压
时间:2023-08-18 11:37:02 热度:37.1℃ 作者:网络
研究背景:
缺氧是肺动脉高压(PH)的主要原因和促进因素,这是一种具有不良预后和高死亡率的典型血管重塑疾病。然而,在PH期间,肺动脉系统如何应对缺氧应激的机制仍不清楚。内皮线粒体被认为是氧分压信号的信号器官。来自以前的临床研究和我们的研究结果表明,在缺氧相关的血管病理过程中,内皮线粒体的翻译后SUMOylation可能发挥了潜在的作用。
研究方法:
采用慢性缺氧小鼠模型和Sugen/缺氧大鼠模型作为PH动物模型。线粒体形态和亚细胞结构通过透射电子和免疫荧光显微镜确定。线粒体代谢通过线粒体耗氧速率和细胞外酸化率确定。通过免疫沉淀确定SUMOylation和蛋白质相互作用。
研究结果:
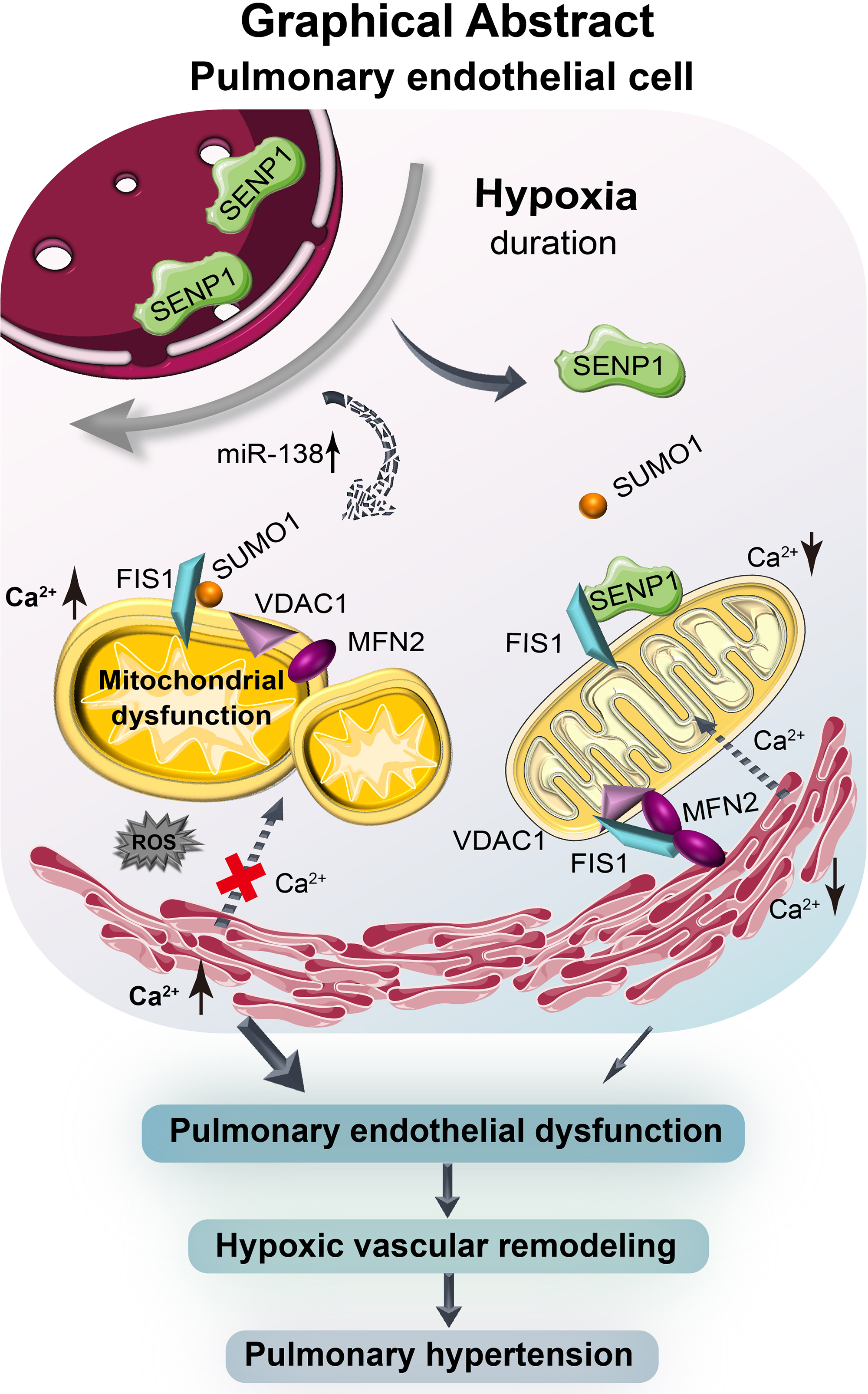
在临床缺氧相关PH标本中,发现了SENP1(sentrin-specific protease 1)介导的SUMOylation与肺内皮线粒体重塑的关联,并在低氧条件下的人肺动脉内皮细胞中得到验证。在临床标本、低氧大鼠和小鼠PH模型、人肺动脉内皮细胞以及人胚胎干细胞衍生内皮细胞中进一步分析揭示,短时缺氧诱导SENP1转位到内皮线粒体,调节线粒体分裂蛋白FIS1(线粒体分裂1)的去SUMO化,进而促进FIS1与融合蛋白MFN2(线粒体融合蛋白2)以及线粒体通道门控蛋白VDAC1(电压依赖性阳离子通道1)的组装,通过增强MFN2的寡聚化来增强其膜连接活性。
因此,FIS1的去SUMO化维持了线粒体完整性,以及线粒体相关膜上的内质网-线粒体钙通信,从而保持肺内皮细胞功能和血管稳态。相反,长时缺氧通过通过诱导miR-138减少线粒体中SENP1的可用性,从而破坏了FIS1的去SUMO化,进而导致肺内皮线粒体功能障碍和代谢重编程。功能上,将去SUMO化的FIS1引入小鼠肺内皮细胞中,改善了肺内皮细胞功能障碍和低氧PH的发展,而将SUMO连接的FIS1引入小鼠则加重了疾病细胞和组织表型。
研究结论:
通过维持内皮线粒体稳态,FIS1的去SUMO化适应性地保护了肺内皮细胞免受缺氧应激的影响,从而保护免受PH的损害。在肺内皮细胞中,FIS1的去SUMO化-SUMO化转变是缺氧性PH的内在病理机制。
参考文献:
Zhou X, Jiang Y, Wang Y, Fan L, Zhu Y, Chen Y, Wang Y, Zhu Y, Wang H, Pan Z, Li Z, Zhu X, Ren R, Ge Z, Lai D, Lai EY, Chen T, Wang K, Liang P, Qin L, Liu C, Qiu C, Simons M, Yu L. Endothelial FIS1 DeSUMOylation Protects Against Hypoxic Pulmonary Hypertension. Circ Res. 2023 Aug 17. doi: 10.1161/CIRCRESAHA.122.321200. Epub ahead of print. PMID: 37589160.


