Cardiovasc Res 孙建新/朱霓团队:揭示PRMT5调控血管平滑肌细胞表型转化和内膜增生的表观遗传学机制
时间:2023-08-17 19:36:32 热度:37.1℃ 作者:网络
血管平滑肌细胞(Vascular smooth muscle cell, VSMC)是血管壁的重要组成部分,其在生理状态下通常处于分化状态以维持血管正常功能。但在血管受到病理性刺激或损伤时,VSMC会被异常激活,其分化标志基因表达下调,VSMC呈去分化状态并且增殖、迁移能力增强,最终导致血管内膜异常增生。因此,表型转换是VSMC的重要病理生理特征,在众多血管疾病中起重要作用。近年研究表明,组蛋白修饰及染色质重构在VSMC表型转换中起关键作用。相关特定组蛋白的甲基化或乙酰化能够促进SRF-MYOCD复合物识别并结合特异性CArG元件,从而启动分化标志基因转录以维持分化表型。另一方面,PDGF能够促进H3/H4去乙酰化和H3K79去二甲基化,从而限制SRF-MYOCD复合物对CArG元件的结合,引起VSMC向去分化表型转换,相关血管疾病的病理过程启动。
蛋白质精氨酸甲基转移酶(Protein arginine methyltransferases, PRMTs)是维持细胞稳态的关键调节因子,其在多个生物学过程中起着重要作用。PRMT5是目前研究最广泛的II型PRMT,它能够催化包括组蛋白和非组蛋白在内蛋白的精氨酸残基对称二甲基化,在细胞增殖、炎症、肿瘤发生等多种疾病中起重要作用。目前,PRMT5的特异性抑制剂已进行相关肿瘤治疗的临床试验,具有广阔的临床应用前景。现有研究表明,PRMT5在心血管疾病的发病中也扮演重要角色,但其在血管重构中的作用尚未明了。
2023年7月24日,托马斯杰弗逊大学孙建新教授和海军军医大学长海医院朱霓副教授团队在Cardiovascular Research发表题为“Epigenetic regulation of vascular smooth muscle cell phenotypic switch and neointimal formation by PRMT5”的论文,揭示了PRMT5在表观遗传层面调控VSMC表型转化的作用及机制,为相关疾病的治疗提供了新的思路和方向。

首先,该研究通过定量PCR及Western Blot发现PDGF-BB刺激下的VSMC中PRMT5的表达明显增加,同时VSMC的分化标志物SMA和SM22的蛋白水平降低。为进一步证实PRMT5在血管重塑中的病理意义,作者检测了PRMT5在颈动脉结扎小鼠及人冠状动脉粥样硬化病变中的表达,结果发现PRMT5在小鼠颈动脉新生内膜区、人冠状动脉粥样硬化病变区域高表达。体外实验也进一步证实,PRMT5的过表达可促进VSMC向去分化表型转化,而敲低PRMT5的表达能够降低PDGF诱导的VSMC增殖和迁移并促进VSMC向分化表型转化。
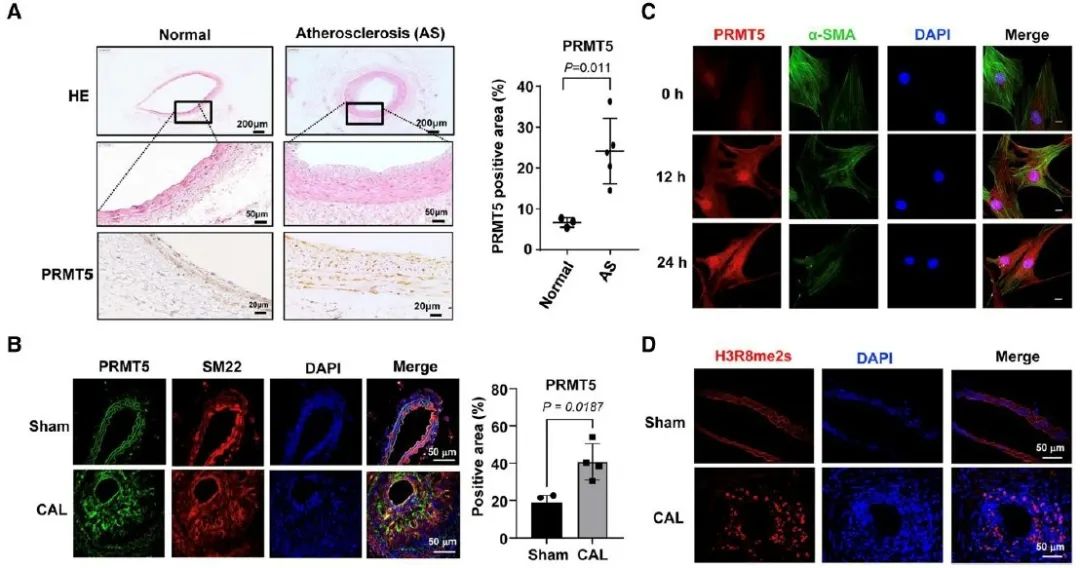
SRF在MYOCD的协同下形成复合体,通过与VSMC标志基因启动序列上的 CArG元件结合,从而启动VSMC分化标志基因的转录。进一步的机制研究发现,工具细胞中共转染MYOCD、SRF和P300能够显著增加含有SMA和SM22启动序列报告基因的活性,但过表达PRMT5显著降低报告基因的活性。同样,ChIP实验证实PRMT5能够显著抑制SRF在SMA和SM22转录启动区的富集。进一步研究发现,PRMT5过表达能够增加H3R8和H4R3的对称二甲基化,同时降低H3K9和H4的乙酰化。同时,免疫沉淀结果提示,尽管过表达PRMT5不能直接下调p300、MYOCD和SRF的表达量,但能够阻止SRF-MYOCD-P300复合体的富集和形成,从而抑制了SMA和SM22的转录。这些结果表明,PRMT5可能通过组蛋白的修饰从而调控VSMC的表型转化。
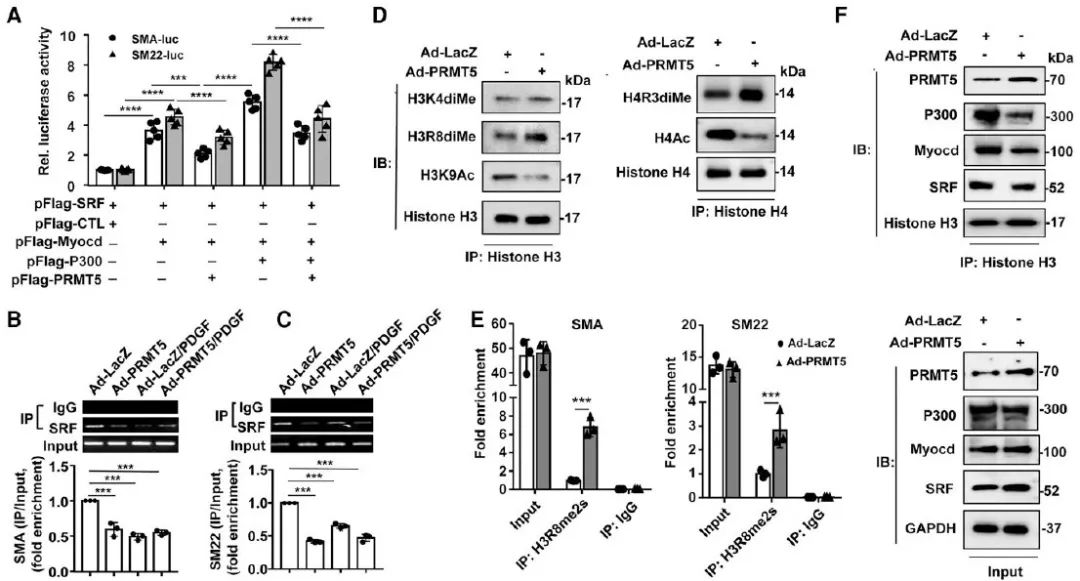
为进一步研究PRMT5在血管内膜增生中的作用和可能的临床转化意义,作者构建了他莫昔芬诱导的VSMC特异性PRMT5敲除小鼠和大鼠颈动脉球囊损伤两种动物模型。结果表明,PRMT5敲除小鼠颈动脉内膜增生水平明显降低。同样,采用口服特异性PRMT5抑制剂EPZ015666 (50 mg/kg, p.o., bid)给药的小鼠颈动脉内膜增生也被显著抑制。另一方面,慢病毒介导的PRMT5-shRNA在大鼠颈动脉球囊损伤模型中的表达同样能够显著抑制颈动脉内膜的增生并且使得内膜/中膜(I/M)比值降低。

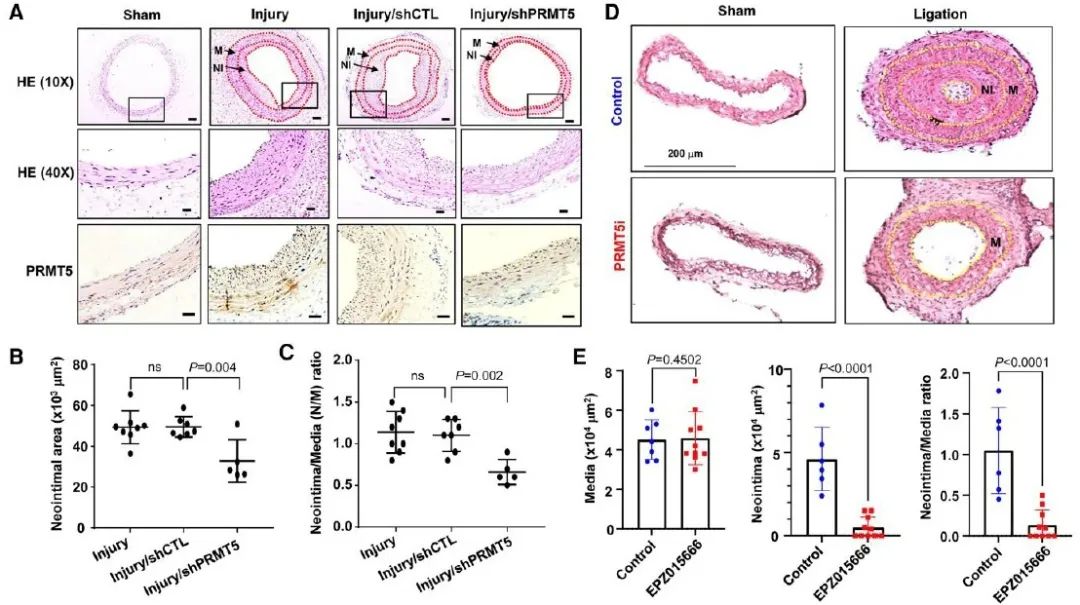
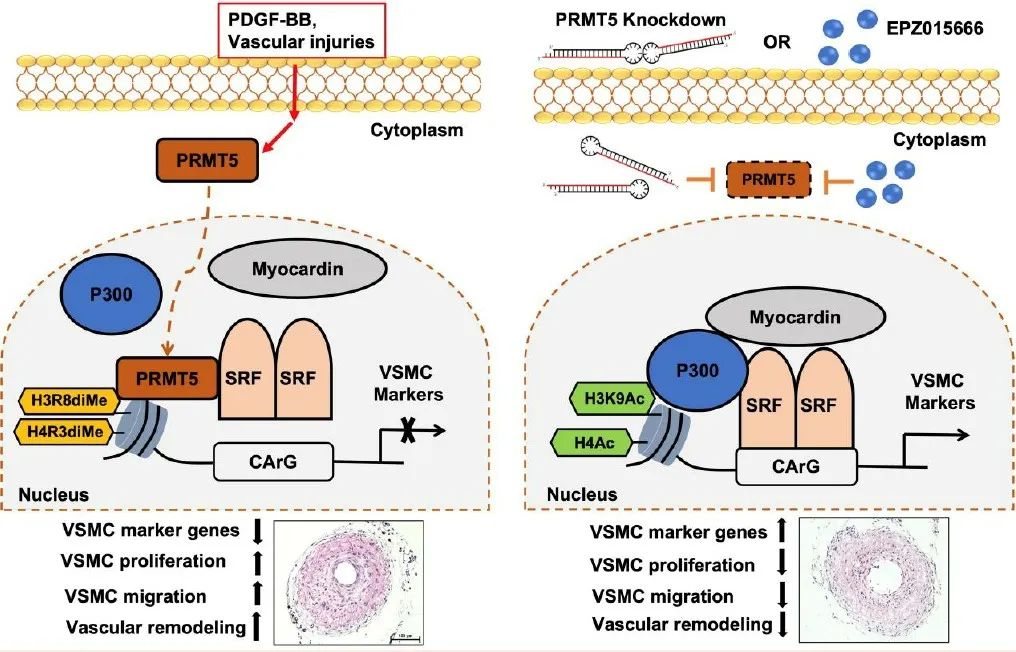
综上所述,PRMT5是重要的蛋白质精氨酸甲基转移酶,在人冠状动脉粥样硬化斑块和动物颈动脉损伤模型中表达上调。PRMT5通过促进组蛋白H3R8和H4R3的甲基化同时介导H3K9和H4的去乙酰化从而抑制SRF/MYOCD复合物与VSMC标志基因CArG元件的结合,导致VSMC向去分化表型转化。在基因层面抑制PRMT5的表达或者运用特异性抑制剂抑制PRMT5的活性能够显著减少动物模型血管内膜的增生,提示PRMT5可能成为一种抑制血管重构的新型治疗靶点。
原文链接:
https://doi.org/10.1093/cvr/cvad110


