会议速递 | ELCC 2023肺癌靶向治疗有哪些重磅研究?
时间:2023-03-31 14:31:44 热度:37.1℃ 作者:网络

ELCC 2023
2023年欧洲肺癌大会(ELCC)将于2023年3月29日至4月1日在丹麦哥本哈根举行,由欧洲肿瘤内科学会(ESMO)与国际肺癌研究协会(IASLC)联合举办。自2008年首次举办以来,ELCC已成为肺癌领域专业人士的首要会议。
作为肺癌领域受业界关注的重要学术会议之一,ELCC致力于促进科学发展、传播教育和提高全世界肺癌专家的临床实践。小编将 找药宝典(翳安医学部)公众号 整理发布的重磅靶向治疗摘要摘录如下,以供专业人士参考了解。

1O
奥希替尼对⽐吉非替尼序贯奥希替尼在EGFR突变NSCLC患者中的疗效

背景:APPLE 是一项3臂II期⾮对照试验,探索在晚期EGFR突变NSCLC患者中吉⾮替尼序贯奥希替尼或奥希替尼一线治疗的疗效。在这里,我们报告了与序贯⽅法相⽐,一线使用奥希替尼的探索性结果分析。
方法:患者被随机分配至:A组(根据实体瘤反应评估标准 1.1 (RECIST),奥希替尼直至疾病进展);B组(使用吉非替尼治疗,直到出现ctDNA T790M阳性突变,或者根据RECIST出现疾病进展);C 组(根据RECIST,使用吉非替尼直至疾病进展)。在B和C组进展后使用奥希替尼治疗。在该分析中,将B组和C组合并。主要终点:B组18个⽉时“使用奥希替尼”的⽆进展⽣存率。次要终点:总⽣存期 (OS)和脑PFS (BPFS)。主要分析在符合⽅案人群(PPP)中进⾏。在所有组中,每8周进⾏一次对⽐增强脑CT扫描。
结果:从2017年11月到2020年2月,156名患者被随机分组(A组53名,B/C组103名),其中136名患者被纳入PPP。⼤多数患者为⼥性(两组女性占比分别为56.6%和69.9%),EGFR Del19占比为66%和64%,基线脑转移占比分别19%和29.1%。在合并的B/C组中,70%的患者在PD时接受了奥希替尼。在A组中,使用奥希替尼的PFS为19.5个⽉。18个月PFS率在A组中为51.1%,在合并组B/C中为61%。A组的中位OS为NR,B/C合并组为42.8(95% CI:28.6-NR个⽉,18个⽉OS分别为84.4%和82.3%。在所有组中,观察到68例颅内进展事件。A组和B/C组脑部PD的中位时间分别为34.3个⽉(95%CI:26.9-NR)和22.3个⽉(95%CI:18.6-22.3),HR为0.54(90%CI: 0.34‒0.86),18个⽉BPFS分别为82.2%和63.5%。
结论:在晚期EGFR突变型NSCLC中,奥希替尼一线治疗可显著降低脑损伤风险进展,OS与序贯治疗⽅法相当。
2O
奥希替尼(OSI)联合或不联合局部巩固治疗(LCT)治疗转移性EGFR突变NSCLC的II期随机研究;不良事件分析

背景:⼤多数对奥希替尼有初步反应的EGFR突变NSCLC患者表现出持续的残留病灶,这可能会导致获得性耐药的出现。用LCT消除残留疾病可能会延迟耐药并改善临床结果。然⽽,奥希替尼与局部巩固治疗的安全性并未明确定义。在这里,我们报告了针对EGFR突变 NSCLC 患者的奥希替尼联合或不联合局部巩固治疗的多中⼼随机II期研究的安全性数据。
⽅法:在既往治疗后出现EGFR-TKI初治突变(L858R/外显子19缺失)或T790M耐药突变的转移性NSCLC患者,接受6-12周的奥希替尼诱导。根据 RECIST 1.1将没有进展的患者随机分配到奥希替尼组或奥希替尼联合局部治疗组,直到出现疾病进展。主要⽬标是无进展生存期,次要⽬标是安全性。使用CTCAE v4.0每8周对患者进⾏一次评估。
结果:从2018年到2022年,122名患者(中位年龄65岁,范围:30-88岁)被随机分配(63 名接受奥希替尼单药治疗;59名接受奥希替尼联合局部治疗)。在接受局部治疗的59名患者中,35名仅接受放疗,17名仅接受手术,7名同时接受放疗和手术。中位随访16个⽉时,无4/5级AE。奥希替尼或奥希替尼联合局部治疗之间的3级AE没有显著差异(16% vs 29%;p = 0.08)。奥希替尼组最常⻅的3级AE是低钠血症(4.8%)、转氨酶(4.8%)和肺炎(3.4%)。奥希替尼联合局部治疗组最常⻅的3级AE是低钠血症(6.8%)、腹泻(3.4%)、脓胸 (3.4%)和肺炎(1.7%)。在42名接受放疗的患者中,1名发生了可能与放疗相关的3级不良事件。在24名手术患者中,3名发生了有手术相关的3级AE。
结论:与单独使用奥希替尼相⽐,奥希替尼联合局部治疗在EGFR突变的转移性NSCLC患者中耐受性良好,严重不良时间没有明显增加。
3O
携带Ex20ins突变接受铂类EGFR治疗后的晚期NSCLC患者接受amivantamab治疗的长期疗效、安全性和反应预测因子

背景:Amivantamab是一种具有免疫细胞导向活性的EGFR和MET双特异性抗体,被批准用于治疗接受含铂化疗进展的EGFR Ex20ins晚期NSCLC患者。本报告展示了该人群的长期结果。
方法:在CHRYSALIS中招募了基于铂类化疗取得进展的EGFR Ex20ins的晚期NSCLC患者。包括在2020年6⽉8日之前接受批准的II期剂量1050 mg(1400 mg,≥80 kg)的患者。由研究者根据RECIST v1.1评估疗效。
结果:截至2022年9⽉,在纳入的114名患者中,中位随访时间为19.2个⽉,48名(42%)患者存活。研究者评估的ORR为37%(95% CI,28-46),中位反应持续时间为12.5个⽉(95% CI,6.9-19.3),中位PFS为 6.9 个⽉(95 % CI,5.6‒8.8),中位OS为23个⽉(95% CI,18.5‒29.5)。在亚组中观察到活性,包括老年人(年龄≥65岁和≥75岁的ORR分别为32%和33%)、接受过大量治疗的患者(>2线的ORR为53%,既往免疫治疗的ORR为42%,先前接受EGFR TKI治疗的ORR为52 %),或对先前铂类化疗敏感或耐药的患者(ORR分别为36%和31%)。没有检测到新的安全信号,⽪疹(所有等级,89%)和输液相关反应(67%)仍然是最常⻅的毒性。
有48名患者接受Amivantamab≥12(28天)周期。15名患者正在接受治疗,中位时间为2.6 年。将在会议上展示⽐较没有和有持续临床获益(≥12个周期的Amivantamab)的患者的分析,包括血浆ctDNA数据。
结论:在EGFR Ex20ins NSCLC的铂后患者中一致观察到Amivantamab强⼤的疗效,包括老年人、接受过多线治疗的患者或铂敏感或难治性患者。子群体获得长期利益;将进一步探讨其机制。
4O
CodeBreaK 200 Ⅲ期试验的报告结果:比较索托雷塞与多西他赛在KRAS G12C突变NSCLC中的疗效

背景:在 CodeBreaK 200 III 期试验中,与多西他赛相⽐,索托雷塞在先前接受过治疗的KRASG12C 突变NSCLC中显著改善了 PFS(主要终点)。先前描述的患者报告结果 (PRO) 在整体健康状况、身体机能、呼吸困难和咳嗽⽅面优于多西他赛 (ESMO2022,LBA10)。在这里,我们报告了症状的严重程度和对患者治疗后⽣活质量(QOL)的影响。
方法:在这项试验中,345名在接受含铂化疗和免疫检查点抑制剂治疗后出现疾病进展的患者按1:1的⽐例随机分配,接受索托雷塞(960mg⼝服 QD)或多西他赛(75mg/m2静脉注射 Q3W)。使用多种评估工具用于收集患者生存质量。
结果:与接受索托雷塞的患者相⽐,接受多西他赛的患者副作用更明显,并且伴随严重的症状(疼痛:OR=2.94,肌肉酸痛:OR=4.40,关节酸痛:OR=4.17,⼝腔或喉咙痛:OR=4.26),症状强烈地⼲扰了患者的日常活动。初始多西他赛治疗后5天,患者生活质量评分下降,⽽索托雷塞保持稳定(VAS评分相对于基线的变化:‒8.4与1.5)。VAS显示使用多西他赛后生活质量评分长期下降,⽽使用索托雷塞时VAS保持稳定(第12周时为‒5.8 vs 2.2)。
结论:接受索托雷塞治疗的患者⽐接受多西他赛治疗的患者报告的症状更轻,患者日常⽣活受到的影响更小。除了改善临床疗效结果外,与多西他赛相⽐,索托雷塞维持了QOL,这表明索托雷塞可能是接受过治疗的KRAS G12C突变晚期NSCLC患者更耐受的治疗选择。
7MO
索托雷塞治疗KRAS G12C突变的晚期NSCLC:来自全球扩大准入计划的OS数据

背景:Amgen 20190436(study-436)研究是索托雷塞 EAP下的一项全球⽅案,允许在既往治疗过的KRAS G12C突变 aNSCLC 患者 (pts) 中使用KRAS G12C抑制剂索托雷塞。先前在study-436中报告的真实世界中位PFS为6.7(95%CI,4.6‒8.3)个⽉。在这里,我们展示了study-436的中位OS数据。
方法:在6个国家(美国、ARG、BRA、 ISR、SAU、TWN)跨越 49 个中⼼。主要终点评估了每天一次⼝服 索托雷塞 960mg的安全性。中位OS是一个关键的次要终点,是根据从索托雷塞治疗开始到死亡的时间估算。
结果:共147名患者接受了索托雷塞治疗。37名(25%)患者的ECOG PS为2,48名(33%)患者有中枢神经系统转移病史。中位随访时间为13.6(95% CI,11.1-14.6)个⽉,中位OS为9.5(95% CI,8.6‑12.0)个⽉。在亚组中,ECOG PS为0或1 与ECOG PS为2患者的中位OS在数值上更长。
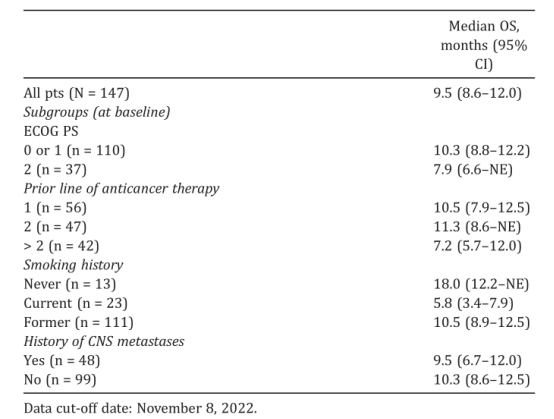
结论:在第一份关于接受索托雷塞治疗的EAP患者的⽣存报告中,中位OS与试验中观察到的相似。在基线时有或没有CNS转移病史的患者中,中位OS的差异很小。
14MO
taletrectinib在ROS1+ NSCLC患者(pts)中的最新疗效和安全性

背景:Taletrectinib是一种有效的中枢神经系统活性 ROS1 TKI,选择性优于TRKB。在TRUST-I之前的报告中,⽆论克唑替尼的预处理状态如何,taletrectinib在 ROS1+ NSCLC 患者(n = 109)中显示出有意义的临床疗效并且耐受性良好。我们报告了更新后的有效性和安全性数据,并进⾏了约1.5年的随访。
方法:TRUST-I是一项多中⼼、开放标签、单臂研究,有两个队列:ROS1 TKI初治和克唑替尼预处理。两个队列中的患者都接受了taletrectinib 600mg QD治疗。关键研究终点包括IRC确认的ORR(cORR)、DoR、疾病控制率 (DCR)、PFS和安全性。还对ORR、PFS和安全性(包括来自其他临床试验的患者)进行了汇总分析。
结果:在来自 TRUST-I的109名患者(2022年2⽉之前入组)中,TKI初治患者(n= 67)的中位随访时间为18.0个⽉,克唑替尼预处理患者(n=42)的中位随访时间为16.9个⽉。cORR在TKI初治患者中为92.5%,在克唑替尼预处理患者中为 52.6%。未达到中位DoR (mDoR)和mPFS。颅内ORR为91.6%;G2032R患者ORR 为 80.0%。在 I 期研究的汇总分析中:未接受TKI和克唑替尼预处理的患者的ORR分别为89.5%和50.0%;mPFS分别为33.2个⽉和9.8个⽉。在接受 600mg QD治疗的178名患者中,TEAE为92.7%;⼤多数(64.0%) 为1-2级。
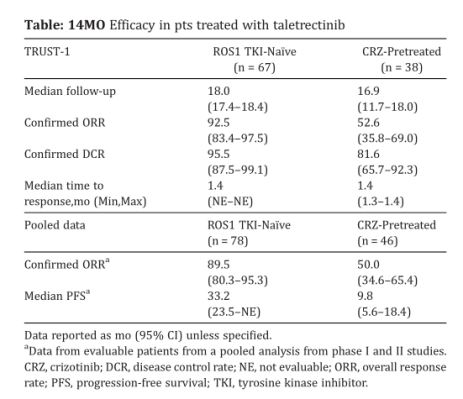
结论:通过额外的随访,taletrectinib继续证明有意义的疗效结果,包括高反应率、延长了PFS、强⼤的颅内活性、针对G2032R的活性以及可耐受的安全性和低神经系统AE发⽣率。

