那些针对罕见病的重磅药
时间:2023-03-26 21:07:36 热度:37.1℃ 作者:网络
根据定义,孤儿药旨在用于治疗、预防或诊断罕见疾病 (Rare Disease) 。对于FDA而言,“支持罕见病新疗法的开发和评估是重中之重”。根据EMA的数据,存在 5000 至 8000 种不同的罕见病。迄今为止,还没有孤儿病的独特而明确的定义。在美国,它被定义为影响不到 620例/百万人的疾病;欧洲为500例/百万人;在日本为400例/百万人;中国为100例/百万人。(图1)
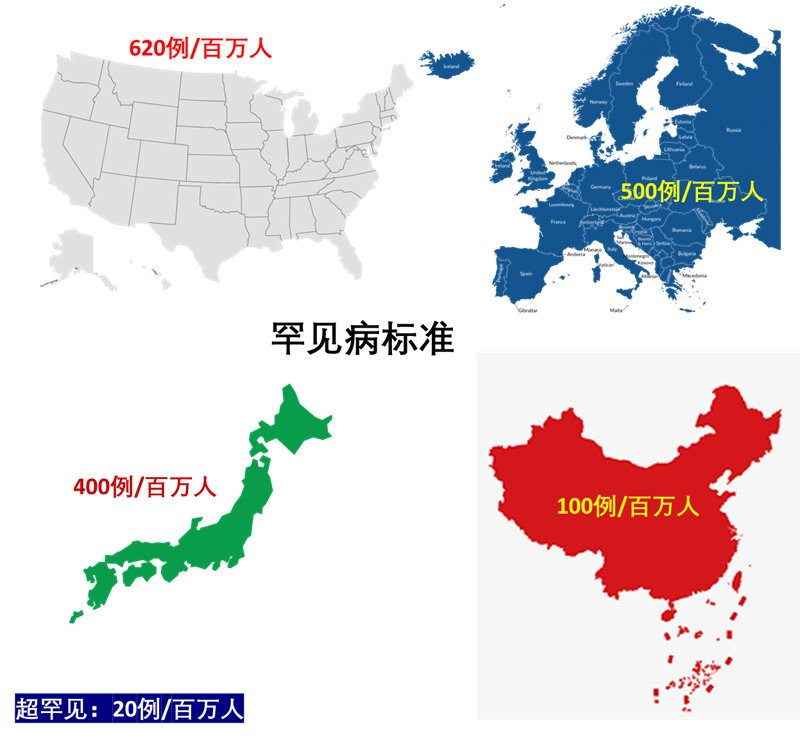
图1. 不同国家地区罕见病标准。(图片来源:医药领袖)
欧盟和美国已实施立法,以刺激为患有罕见疾病的患者开发药物。公司和其他药物开发商可以申请孤儿药指定。就美国而言,如果药物符合特定标准,FDA 将授予孤儿药指定。孤儿药指定的好处包括获得联邦研究资助的资格、7 年市场独占权的资助,以及对符合要求的临床试验给予高达 50% 的税收抵免(至 2018 年)。从 2018 年起,美国政府将税收抵免从 50% 降低到 25%。
罕见病新疗法的评估是FDA/EMA的优先事务之一。他们可以授予药物或生物产品孤儿药物称号,以预防、诊断或治疗罕见疾病。孤儿药的指定保证了在税收减免和批准后的市场独占期方面的某些优势。大多数罕见病具有遗传性,并且会危及生命。除了它们的遗传根源外,孤儿病还可能由蠕虫、原生动物和细菌感染甚至环境中毒引起。
孤儿药销售增长显著超过常规的医药种类,从 2005 年到 2011 年,孤儿药的销售额每年增长约 为10%。据估计,到 2026 年,前 10 名“重磅炸弹”孤儿药的价值将在 30 亿至130 亿美元之间。
预计2026 年,最畅销的小分子孤儿药包括ibrutinib依鲁替尼(Imbruvica:registered:),elexacaftor/tezacaftor/ivacaftor(Trikafta:registered:), olaparib(Lynparza:registered:), ruxolitinib(Jakafi:registered:) , venetoclax(Venclexta:registered:), acalabrutinib(Calquence:registered:)和 tafamidis(Vyndaqel:registered:)。7 这些孤儿药2026年在美国和世界其它区域的销售额预测见图2。需要注意的是,尽管孤儿药和重磅炸弹药物听上去是自相矛盾而无法共存的,但这篇文章中的所谓重磅炸弹孤儿药销售额,指的是药物针对的多种适应症中包含罕见病,但市场预测时将所有适应症都包含在内。
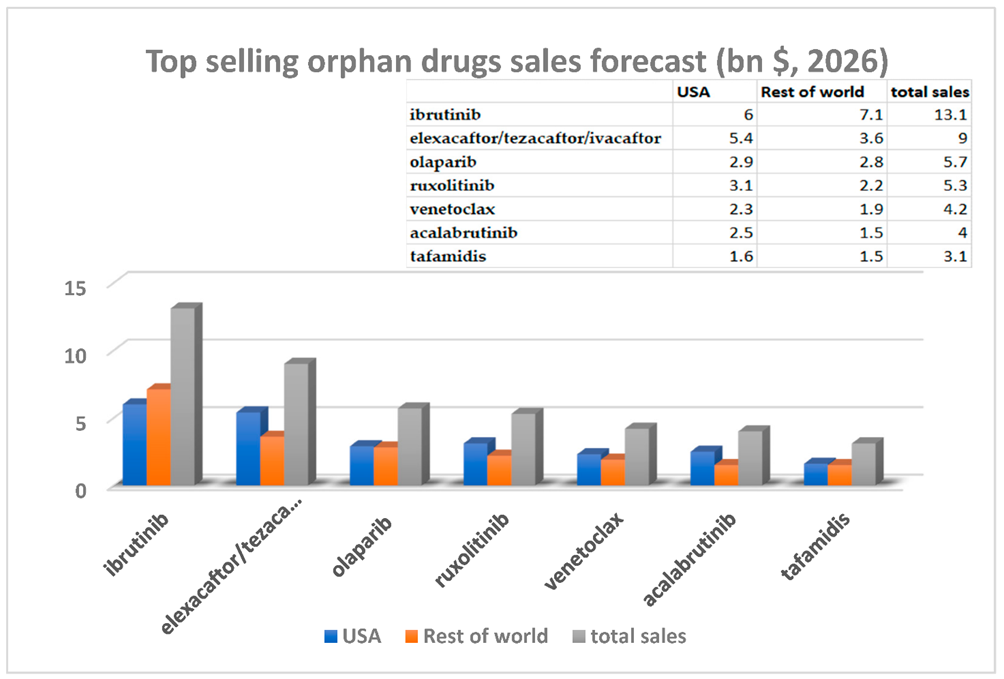
图2. 重磅孤儿药2026年预计销售额。(图片来源:International Journal of Molecular Sciences)
•Ibrutinib (Imbruvica:registered:)
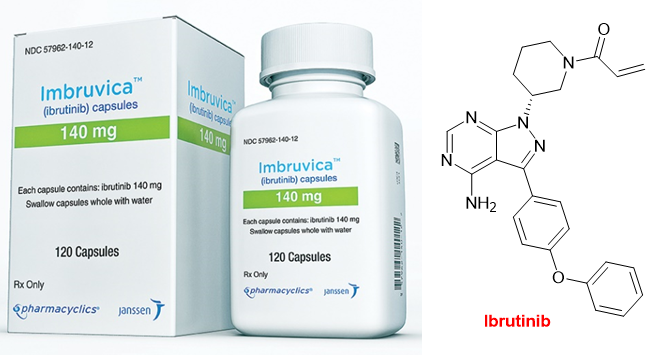
Ibrutinib是一种Burton 酪氨酸激酶(BTK)的小分子不可逆强效抑制剂。它是靶向共价药物 (其丙烯酰胺结构为其共价弹头,与靶标上的Cys481产生迈克尔加成反应),在 B 细胞恶性肿瘤中表现出高度活性。Ibrutinib 由 Pharmacyclics Inc. (现为 AbbVie 的一部分)开发,并于 2013 年 11 月获得 FDA 批准,用于治疗套细胞淋巴瘤。
2014 年 2 月,Ibrutinib被批准用于治疗慢性淋巴细胞白血病,它还适用于治疗华氏巨球蛋白血症患者。Ibrutinib 于 2017 年 8 月获准用于治疗慢性移植物抗宿主病 (cGVHD), 后来获准用于儿童,使其成为 FDA 批准的第一个用于治疗 1 岁及以上儿童在一种或更多系统疗法失败后的 cGVHD 治疗。
•Elexacaftor/Tezacaftor/Ivacaftor(Trikafta:registered:)
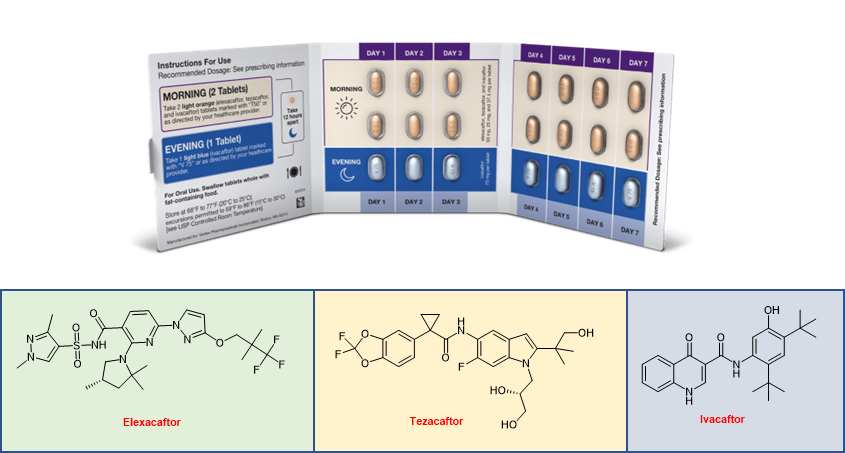
由 Vertex Pharmaceuticals 推出的 elexacaftor-tezacaftor-ivacaftor是一种新批准的三重组合囊性纤维化跨膜电导调节剂 (CFTR) 。 囊性纤维化 (CF) 是白种人中最常见的常染色体隐性遗传病,由 CFTR 离子通道生成缺陷引起。CFTR 是一个隧道状的氯离子通道,负责控制阴离子和水进出上皮细胞的运输。直接与 CFTR 相互作用的小分子调节剂可以帮助蛋白质折叠(被称为“校正剂”)或增加通道功能(被称为“增效剂”)。当单独使用时,elexacaftor 部分纠正了苯丙氨酸缺失 (Δ508) CFTR 中的域间组装缺陷,但当与 I 型校正剂(例如 tezacaftor)结合使用时,它可以实现完全纠正。
•Olaparib(Lynparza:registered:)
Olaparib是一种选择性强效聚(ADP-核糖)聚合酶 (PARP) 抑制剂。PARP 抑制剂代表了一类新型抗癌疗法。Olaparib通过抑制 PARP1 介导的损伤DNA的修复,可以提高放化疗的有效性。Olaparib用于治疗多种 BRCA 相关肿瘤,包括卵巢癌、乳腺癌、胰腺癌和前列腺癌。它于 2014 年 12 月首次获得 FDA 和欧盟的批准。在一项3期研究中,Olaparib被用于治疗转移性去势抵抗性前列腺癌 (mCRPC) 及其前体,转移性激素敏感性前列腺癌 (mHSPC), 它们是对初始治疗(如手术和激素治疗)无反应的晚期前列腺癌形式,已开始扩散到前列腺以外的组织。
•Ruxolitinib(Jakafi:registered:)

Ruxolitinib是一种口服给药Janus 激酶 (JAK) 1 和 2 抑制剂首创新药,Ruxolitinib 于 2011 年首次被 FDA 批准用于治疗成年骨髓纤维化患者。2014年被批准用于治疗真性红细胞增多症 (PV, polycythemia vera) , 这是一种罕见的缓慢进展的血液癌症,其特征表现为红细胞生成增加,但对其病理知之甚少。2019 年,FDA 批准Ruxolitinib用于类固醇难治性急性移植物抗宿主病 (SR-aGVHD) 。
值得注意的是,Ruxolitinib 曾被研究用于治疗伴有严重全身性过度炎症的 COVID-19 患者。在 II 期临床试验中,ruxolitinib改善了淋巴细胞减少症患者的恢复。然而III 期临床试验后来确定,ruxolitinib 不足以达到其主要终点,即减少经历了严重的并发症COVID-19患者的住院数量,因此该药物未被批准用于治疗 COVID-19。
•Venetoclax(Venclexta:registered:)
Venetoclax 是促存活蛋白 BCL-2 的口服选择性抑制剂,可恢复恶性细胞的凋亡能力。它是由艾伯维开发的。Venetoclax 在美国被批准用作慢性淋巴细胞白血病 (CLL) 或小淋巴细胞淋巴瘤 (SLL) 患者的单一疗法。 Venetoclax 治疗与 ibrutinib 相同的血癌亚型。它还与azacitidine,或decitabine,或低剂量阿糖胞苷联合用于治疗新诊断的急性髓性白血病 (AML),适用于 75 岁或以上的成年人,或患有无法使用强化诱导化疗的合并症的患者。
•Acalabrutinib(Calquence:registered:)
由 Acerta Pharma 开发的 acalabrutinib (Calquence:registered:) 是一种布鲁顿氏酪氨酸激酶(BTK)抑制剂,用于治疗各种血液和实体恶性肿瘤。2019 年 11 月,FDA 批准了 acalabrutinib用于成人慢性淋巴细胞白血病 (CLL) 或小淋巴细胞淋巴瘤 (SLL)。
Acalabrutinib是 BTK 的一种选择性不可逆抑制剂(acalabrutinib 与靶标上的 Cys481共价结合),具有改善的药理特性,包括有利的血浆暴露、快速口服吸收、短半衰期以及对其它酪氨酸激酶(例如表皮生长因子受体 (EGFR)、酪氨酸蛋白激酶 TEC 和 IL-2 诱导型酪氨酸激酶 (ITK))不具活性。
迄今为止,acalabrutinib 已用于研究治疗 B-All、骨髓纤维化、卵巢癌、多发性骨髓瘤和霍奇金淋巴瘤等的试验。FDA 授予acalabrutinib优先审查和突破性治疗指定。它还获得了孤儿药称号。目前,超过 35 项涉及 2500 多名患者的临床试验正在进行或已经完成,以进一步研究并扩大 acalabrutinib 的治疗用途。
•Tafamidis(Vyndaqel:registered:)

Tafamidis是一种小分子抑制剂,由斯克里普斯研究中心与辉瑞公司联合开发,用于治疗转甲状腺素蛋白家族性淀粉样多发性神经病 (TTR-FAP)。之后FDA又批准 tafamidis 用于治疗由转甲状腺素蛋白介导的淀粉样变性 (ATTR-CM,transthyretin-mediated amyloidosis) 引起的成人心脏病(心肌病,cardiomyopathy)。ATTR 是由身体器官和组织中称为淀粉样蛋白的特定蛋白质异常沉积引起的。
参考文献


