NCB:浙江大学许大千/吕志民发现生物钟促进从头核苷酸合成和肝脏肿瘤生长的潜在机理
时间:2023-01-22 21:01:13 热度:37.1℃ 作者:网络
生物钟受损与癌症的发展有关。然而,生物钟是否由致癌受体酪氨酸激酶调节仍不清楚。
2023年1月16日,浙江大学许大千及吕志民共同通讯在Nature Cell Biology在线发表题为“Nucleus-exported CLOCK acetylates PRPS to promote de novo nucleotide synthesis and liver tumour growth”的研究论文,该研究表明核输出CLOCK乙酰化PRPS能够促进从头核苷酸合成和肝脏肿瘤生长。该研究证明了受体酪氨酸激酶激活促进CK2介导的CLOCK S106磷酸化和随后的CLOCK-BMAL1二聚体的分解以及肝细胞癌(HCC)细胞中下游基因表达的抑制。此外,CLOCK S106磷酸化暴露其核输出信号与Exportin1结合进行核输出。
细胞质CLOCK乙酰化PRPS1/2 K29,阻断HSC70介导的溶酶体依赖性PRPS1/2降解。稳定的PRPS1/2促进从头核苷酸合成和HCC细胞增殖和肝肿瘤生长。此外,在人类HCC标本中,CLOCK S106磷酸化和PRPS1/2 K29乙酰化与HCC不良预后呈正相关。这些发现描述了致癌信号抑制典型CLOCK转录活性并同时赋予CLOCK辅助功能以促进核苷酸合成和肿瘤生长的关键机制。

昼夜节律通过内部自我维持的昼夜节律钟控制着许多生理和代谢功能,而昼夜节律钟是由相互关联的负反馈回路调节的。生物钟主要由转录因子昼夜节律运动输出周期kaput基因(clock)和脑和肌肉Arnt样蛋白1 (BMAL1,也称为ARNTL)调节。这些分子形成紧密交织的异二聚体,并与靶向启动子的E-box序列结合,以诱导许多钟控基因(CCGs)的转录,包括白天的周期(编码PER1/2/3)和隐花色素(编码CRY1/2)。反过来,PER和CRY组装成异源二聚体,在夜间抑制CLOCK/BMAL1的活性,从而形成负反馈循环。此外,CLOCK-BMAL1复合物调节孤儿核激素受体rev-erba α/β的表达,后者反过来抑制BMAL1,而维甲酸相关孤儿受体随后激活BMAL1,从而构成第二个反馈回路。
研究表明,肿瘤细胞中生物钟的功能受到了损害。对14种不同癌症类型的生物信息学分析显示,许多核心时钟基因和CCGs存在差异表达。实验时差反应和中央生物钟成分BMAL1和PER2的基因突变加剧了肺肿瘤的发生。此外,缺乏PER1和PER2、CRY1和CRY2或BMAL1拷贝的小鼠均表现出自发和辐射诱导的肿瘤发展增加。
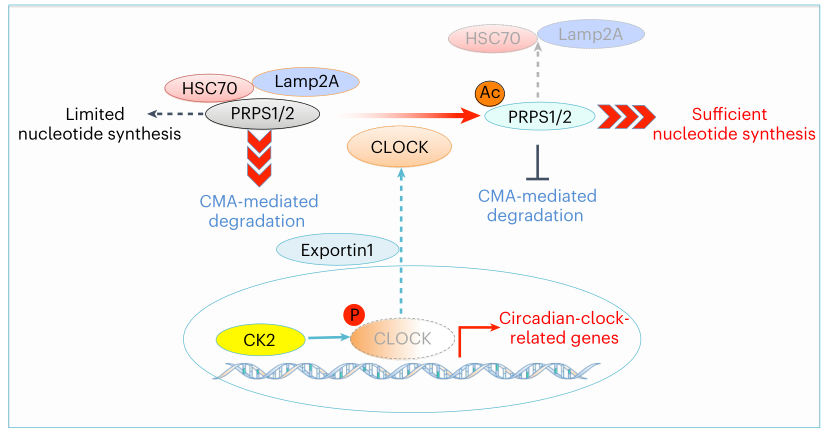
核输出CLOCK乙酰化PRPS以促进从头核苷酸合成和肿瘤生长的示意图(图源自Nature Cell Biology )
有趣的是,在某些情况下,昼夜节律基因可能会加重肿瘤的进展。例如,CLOCK和BMAL1的缺失会阻碍小鼠急性髓系白血病细胞的生长,并抑制胶质母细胞瘤干细胞的增殖和脑肿瘤的生长。这些发现表明,时钟基因在不同类型癌症中的作用是不同的,核心时钟缺陷对肿瘤形成的不同影响不仅是由于其转录功能的破坏,而且是由于基因表达无关功能的破坏。然而,CLOCK是否以表达和规范转录功能独立的方式直接调节癌细胞增殖以响应致癌信号尚不清楚。
该研究揭示了受体酪氨酸激酶的激活通过CK2依赖的CLOCK S106磷酸化破坏了CLOCK/BMAL1复合物及其转录活性。这种磷酸化导致Exportin1介导的CLOCK核输出,其在细胞质中的K29处乙酰化PRPS1/2,并稳定PRPS1/2的表达,以促进新生核苷酸合成和肝细胞癌(HCC)细胞增殖。这些发现强调了靶向CLOCK的细胞质其他功能用于人类HCC治疗的潜力。
原文链接:
https://www.nature.com/articles/s41556-022-01061-0

