【Am J Hematol】华氏巨球蛋白血症的诊断、风险分层和管理策略(2023更新)
时间:2023-01-18 15:01:41 热度:37.1℃ 作者:网络
华氏巨球蛋白血症
梅奥诊所Morie A Gertz教授每两年都会在《American Journal of Hematology》发表一篇关于华氏巨球蛋白血症诊断、风险分层和管理策略的综述,近日发表了2023年更新,现整理主要内容供各位老师参考。

疾病概述
世界卫生组织将华氏巨球蛋白血症 (WM) 定义为与单克隆免疫球蛋白M蛋白 (IgM)相关的淋巴浆细胞性淋巴瘤,其临床表现为肝肿大 (20%)、脾肿大 (15%) 和淋巴结肿大 (15%),最常见的症状是与正常红细胞性贫血相关的疲乏,诊断时血红蛋白中位值为10 g/dL。相当一部分符合 WM 标准的患者因暂无症状(冒烟型)不需要立即治疗。几乎所有患者均存在IgM MGUS前期,但克隆性 MGUS B 细胞已经含有恶性克隆的分子特征。<70岁患者的中位生存期超过10年,70-79岁患者约为7年,≥80岁患者约为4年。对于诊断时年龄超过65岁的患者,最常见的死亡原因为非肿瘤原因。14%的WM患者存在克隆性造血,这些患者更有可能从 IgM MGUS 或冒烟型WM进展为症状性疾病。
诊断时的中位年龄为71岁。年龄校正的发病率为0.42/10万人/年,年龄和性别校正的发病率为0.57/10万人/年,男女比为3.2:1。在过去50年中,没有证据表明 WM 的发病率发生变化。
WM 的生存期正在逐步改善。SEER数据库包含5784例 WM 患者,1991年至2000年和2001年至2010年的中位OS从6年改善至8年;2001年至2010年队列的死亡中,均WM相关和非WM相关原因的死亡均减少。诊断时的年龄对生存率的影响仍然最大,与<50岁患者相比,≥80岁WM患者的死亡风险比为6.99。
单克隆IgM蛋白为该疾病增加了一个独特的维度,因为它可导致高黏度综合征、周围神经病变、溶血性贫血和免疫复合物血管炎。现在10年生存率为66%。在一项基于人群的拉丁美洲 WM 和淋巴浆细胞淋巴瘤患者研究中,5年相对生存率为81%;且所有年龄组中均观察到生存改善,尽管年龄增加会伴随生存率降低。
IgM型单克隆蛋白相关周围神经病变的管理仍较困难,神经病变的机制是由于抗体与髓鞘相关糖蛋白直接结合而导致的脱髓鞘。IgM 相关周围神经病变的治疗可以与 WM 一样,54.5%的患者利妥昔单抗治疗后 IgM 相关神经病变总体改善,6例在利妥昔单抗首次治疗后无变化的患者在增加一个利妥昔单抗周期后改善,因此利妥昔单抗单药治疗在 IgM 介导的神经病变中具有作用。在一项双盲、安慰剂对照研究中,54例抗 MAG IgM 慢性脱髓鞘神经病患者随机接受安慰剂或利妥昔单抗治疗,研究中未达到主要结局,即12个月时ISS(INCAT感觉评分)较基线绝对改善,因利妥昔单抗组和安慰剂组之间未观察到 ISS 变化的显著差异。3例抗髓鞘相关糖蛋白免疫球蛋白 M 神经病变患者接受伊布替尼给药后均报告改善,表明伊布替尼可能有效。然而总的来说,IgM相关性神经病变的治疗仍不充分。
诊断
Jan Gösta Waldenström在 WM 的原始报道中描述了2例口鼻出血(高黏滞血症)、淋巴结病、贫血、血小板减少和血沉升高的患者。该疾病是一种具有单克隆五聚 IgM 蛋白的淋巴浆细胞淋巴瘤,骨髓和淋巴结在成熟的不同阶段浸润多形性 B 系细胞,骨髓模式主要是骨小梁间模式。相当一部分符合所有其他诊断标准的患者处于症状前期,可能不需要治疗。细胞表达泛 B 细胞标记物(例如CD19、CD20),并且 CD3 和 CD103 检测结果通常为阴性。MYD88 基因突变见于93%的患者,CXCR4 突变见于29%,53%的高粘血症患者存在 CXCR4 突变。总而言之,WM恶性肿瘤细胞中存在重要的体细胞变体。在未接受 BTK 抑制剂治疗的患者中MYD88无法预测生存期,突变型为10.2年、野生型为13.9年,但也有人报道MYD88突变型和野生型患者之间的生存差异,MYD88WT 和MYD88MUT的10 年生存率分别为73%和90%。环磷酰胺治疗患者的中位原因特异性生存期为166个月。
MYD88 可以通过PCR在 WM 患者外周血中检测到,30%的 WM 患者存在CXCR4 突变。在动物模型中,该突变可预测伊布替尼和依维莫司的耐药性。此外CXCR4突变与较短的无治疗生存期相关。
区分 WM 和边缘区淋巴瘤可能具有挑战性。MYD88 L265P 与WM 和 IgM型MGUS特异性相关,但也见于脾边缘区淋巴瘤 (4%)、IgM型淀粉样变性 (71%)、黏膜相关淋巴组织淋巴瘤 (7%) 和WM(67%-90%),因此MYD88 L265P 无法用于区分 WM 和IgM MGUS。在 IgM 型多发性骨髓瘤中未发现该突变,且突变表达与骨髓受累程度一致。此外化疗后缓解与突变表达下降相关。
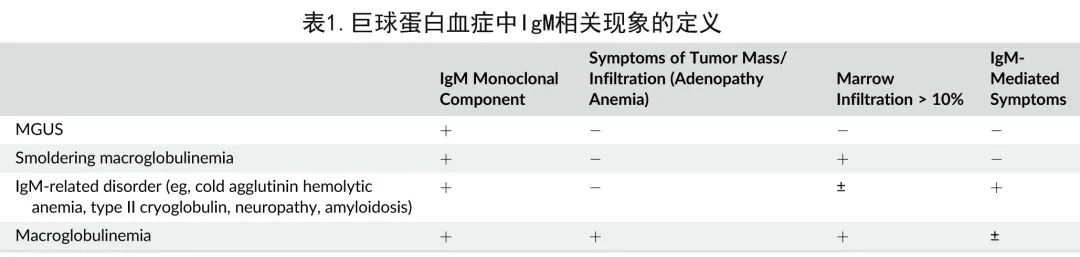
患者可能表现为 IgM 水平显著升高和骨髓浸润超过30%,但无症状者仍不需要治疗。但也有部分低单克隆 IgM 蛋白和最小的克隆性骨髓浸润患者,仍需要治疗与 IgM 蛋白相关的并发症,包括中/重度周围神经病变、淀粉样蛋白沉积、冷凝集素溶血性贫血和 II 型混合性冷球蛋白血症(它们都是 IgM 蛋白的抗体结合特异性和蛋白折叠的结果)。WM 的分类方案见表1。肿瘤包块或单克隆蛋白均可产生症状。WM采用当前疗法尚无法治愈。
IgM型多发性骨髓瘤是一种独特的疾病,仅占所有多发性骨髓瘤的1%,但必须与 WM 区分开来。MYD88 在 IgM 骨髓瘤中未发生突变。多发性骨髓瘤诊断的可用因素包括存在溶骨性病变(WM中罕见)和14号染色体易位(WM中未发生)。此外IgM型多发性骨髓瘤患者倾向于浆细胞分化,高表达CD138和细胞质免疫球蛋白,而WM表达CD20。
单克隆 IgM 蛋白在>50岁人群中的发生率为1/600。IgM型MGUS 患者多于 WM 患者,但所有 IgM型MGUS 患者均需要终生监测。IgM MGUS 患者存在两种不良风险因素,即血清游离轻链比值异常(κ/λ游离轻链比值)和高血清单克隆蛋白(M蛋白)(≥1.5g/分升),20年进展风险高达55%。在一项176例 IgM型MGUS 患者的研究中,单克隆蛋白峰值>1 g/dL和MYD88突变可成功预测进展为症状性巨球蛋白血症,两个变量的风险比均超过20,10年累积进展率为38%。MYD88野生型也是转化为大细胞淋巴瘤的独立预测因子,其总生存期较差。
IgM值>3000 mg/dL 的患者可无症状、血红蛋白值正常、血清粘度无临床意义的升高,此时观察仍然是适当的。梅奥诊所 WM 患者中症状性高粘血症仅13%。即使在 IgM >6000 mg/dL 的患者中,至初始治疗的中位时间也有6.9年。在冒烟型巨球蛋白血症患者中,疾病进展为症状性疾病的独立预测因子包括免疫球蛋白M >4500 mg/dL、骨髓浸润伴≥70%淋巴浆细胞淋巴瘤、β2微球蛋白≥4 mg/L和白蛋白< 3.5 g/dL。此外MYD 88野生型也是进展为症状性疾病的独立预测因子。BOX 1列出了疑似新WM患者的推荐诊断检查。其中影像学的作用较小,因为大多数患者的淋巴结肿大仅有中度,但也有证据表明 FDG PET 的结果是巨球蛋白血症患者的预后因素。

WM 缓解定义为 M 蛋白减少。轻微缓为是 M 峰减少至少25%,部分缓解定义为 M 蛋白减少≥50,非常好的部分缓解是 M 蛋白减少90%,完全缓解是血清中免疫固定阴性。但IgM 水平和骨髓缓解之间可能存在差异。受累血清游离轻链是肿瘤负荷的有用标志物,在完整 IgM 之前可作为缓解和进展的主要指标。免疫球蛋白游离轻链检测在骨髓瘤中非常有价值,但在 WM 中尚未得到确认。此外WM 患者无需连续监测。
风险分层
由于 WM 是一种独特的淋巴增生过程,具有独特的细胞表面和遗传特征,因此国际预后指数和滤泡性淋巴瘤国际预后指数不用于判断预后。表2为目前公认的 WM 国际分期系统。
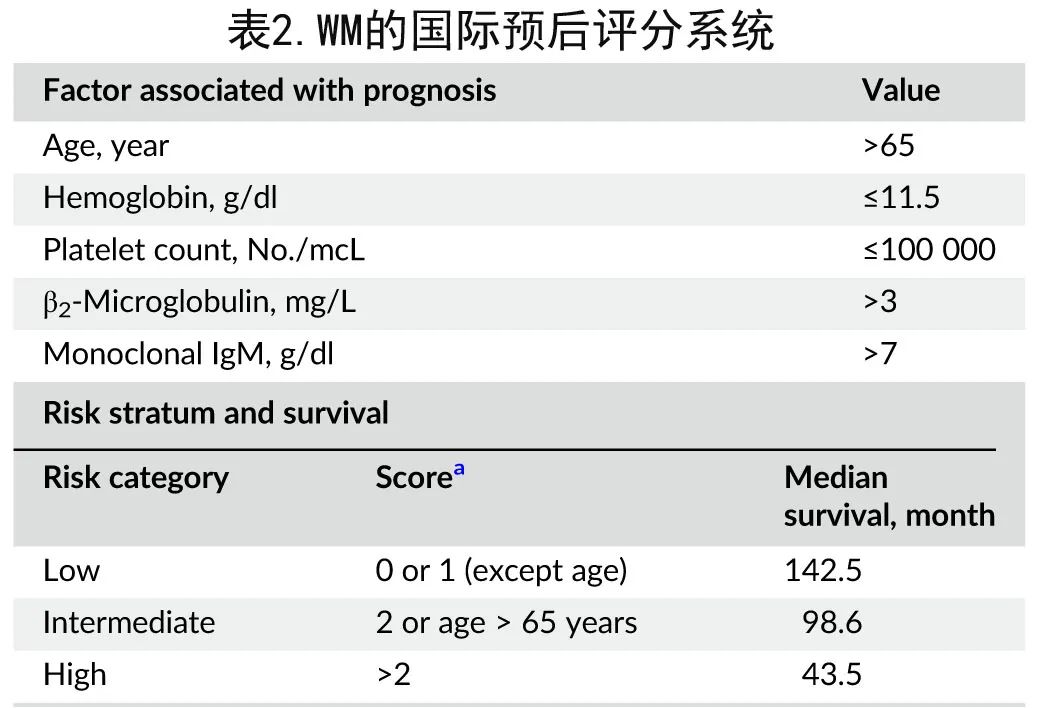
需要注意的是,表2中的5个因素的权重并不相等,其中年龄对预后影响最大,年龄>65岁的患者不应归入低危。虽然 IgM 蛋白水平在预后上很重要,但IgM >7000 mg/dL 才纳入分期系统。然而在利妥昔单抗单药治疗 WM 的最大研究中,IgM水平不会影响缓解率。此外华氏巨球蛋白血症国际预后评分系统中未纳入乳酸脱氢酶。在预后评分系统的修订中,年龄(≤65 vs 66-75 vs≥76岁)、β2-微球蛋白≥4 mg/L、血清白蛋白 < 3.5 g/dL、和LDH≥250 IU/L (ULN< 225) 将患者分为5个不同的预后组,并确定极低危以及极高危组,3年 WM 相关死亡率为0%、10%、14%、38%和48% (p< 0.001),10年生存率为84%、59%、37%、19%和9%(p < 0.001)。LDH 是WM早期死亡的预测因子,而年龄是结局最有力的预测因素,≤45岁患者的10年生存率为86%。
华氏巨球蛋白血症的国际预后评分系统仅用于需要治疗的患者,而非用于确定患者是否需要干预,且该决定仍需临床决策。连续测量β2微球蛋白在监测治疗中没有用处,但诊断时血红蛋白和β2微球蛋白均是进展为活动性巨球蛋白血症的独立预测因素。
由于大多数 WM 患者的病程为惰性,且通常为老年人,因此近一半的患者死于非WM相关的疾病。在238例 WM 患者中研究了年龄对 OS 的影响,发现诊断时年龄>65岁的患者生存率最差且归因于非 WM 相关的死亡数量较多。病因特异性生存率已成为重要的结局指标,这种统计技术可审查死于与恶性肿瘤无关的原因的患者,并解释这些患者面临的竞争死亡风险。在一项竞争风险生存分析中,23%的死亡与 WM 无关, > 75岁的患者中40%死于非WM原因。此外,WM 患者发生继发性恶性肿瘤的总体风险比预期高1.69倍 (p= 0.002),与一般人群相比,WM患者发生大细胞淋巴瘤、骨髓增生异常和脑癌的风险似乎更高,治疗相关髓系肿瘤的发生率为2.7%。
管理
高粘滞综合征
高黏滞综合征在 WM 患者的比例有所下降,因为 WM 的诊断趋向更早期。IgM 浓度<4000 mg/dL 的患者很少出现症状性高粘血症,因此IgM水平低于该阈值的患者不需要进行粘度测定。高粘滞血症的症状主要是由于剪切力使无支撑的静脉通道破裂,因此表现一般包括鼻出血、牙龈出血和视网膜出血所致的视力改变。中枢神经系统症状包括头晕、头晕目眩和全身疲劳,但属于非特异性的,必须通过血清粘度指标证实。参考血清粘度为1.8,取水的粘度为1;除非血清粘度超过4,否则不可能发生高粘滞综合征。存在高黏滞血症时,血浆置换属于暂时性措施,直至全身治疗成功降低肿瘤质量,从而降低血清 IgM 蛋白浓度。单次血浆置换通常足以缓解症状并允许启动全身治疗。
减少肿瘤质量的全身化疗
常用方案包括利妥昔单抗+环磷酰胺、利妥昔单抗+环磷酰胺+地塞米松(RCd)、蛋白酶体抑制剂、苯达莫司汀、BTK抑制剂等。
利妥昔单抗的使用有“flare”风险,即开始利妥昔单抗治疗可导致 IgM 水平一过性升高,产生血清粘度升高,而利妥昔单抗与细胞毒性化疗联合使用时这一现象则不太常见。也有研究将利妥昔单抗延迟至第2个周期以允许细胞毒性治疗降低 IgM 水平,并降低与引入利妥昔单抗相关的高黏度风险。利妥昔单抗维持治疗有争议。Ofatumumab也有研究证实疗效。
蛋白酶体抑制剂也是巨球蛋白血症管理的重要治疗选择,包括含硼替佐米、卡非佐米和伊沙佐米方案。
利妥昔单抗+苯达莫司汀由于其易用性和较低的非血液学不良事件发生率,是梅奥诊所治疗新诊断 WM 的首选诱导方案之一,它还具有时间限制性治疗的优势,通常少于6个月,无 IgM flare的风险。但对于存在中枢神经系统浸润(所谓的 Bing Neel 综合征)的患者则首选伊布替尼,因为伊布替尼可穿过血脑屏障。
利妥昔单抗+苯达莫司汀和伊布替尼都是治疗巨球蛋白血症的合理选择,治疗决定通常取决于患者对口服与肠外治疗或无限期与时间限制性治疗的倾向。
此外由于巨球蛋白血症细胞高表达 Bcl-2,维奈克拉也有一些研究报道。
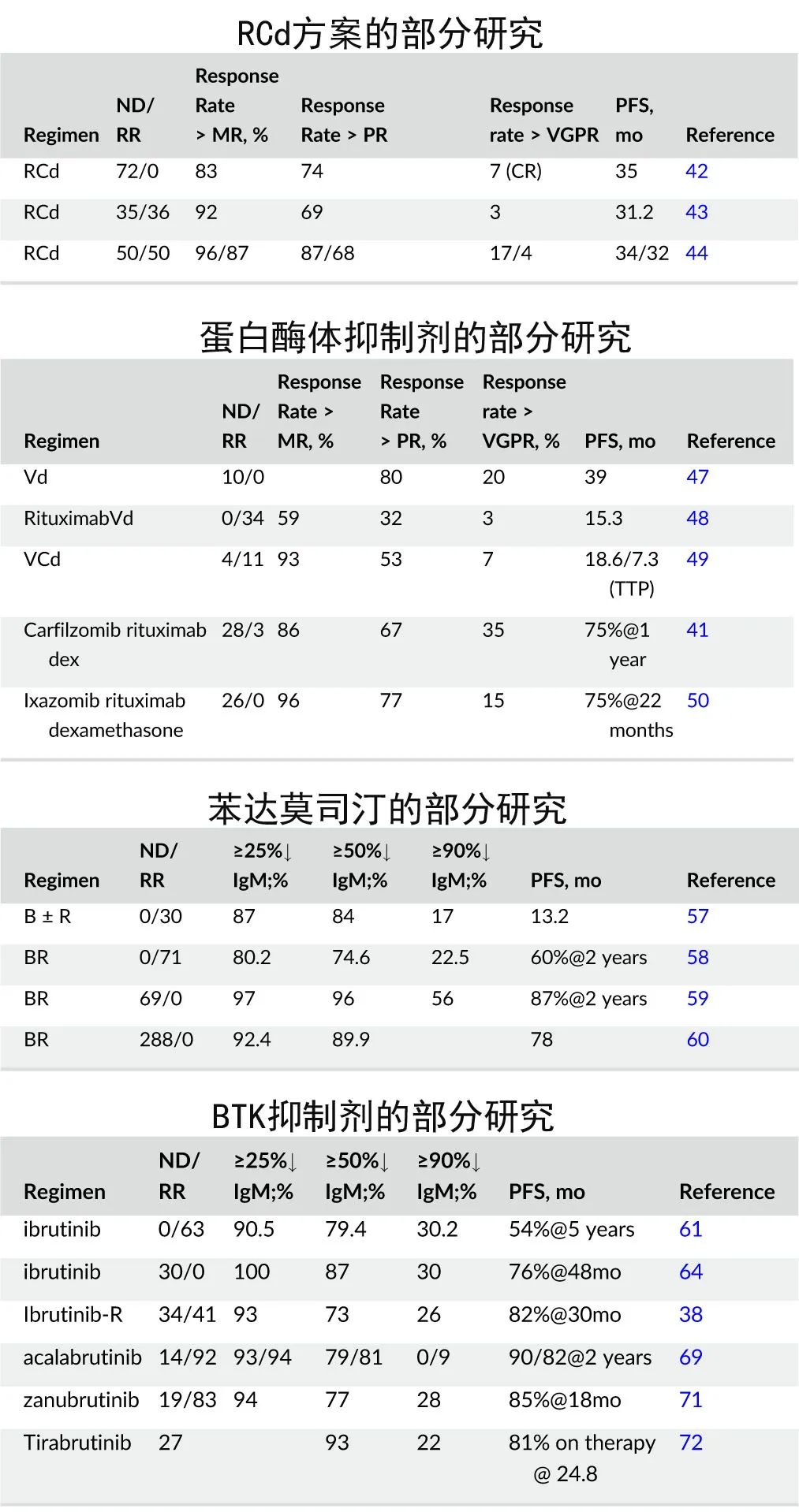
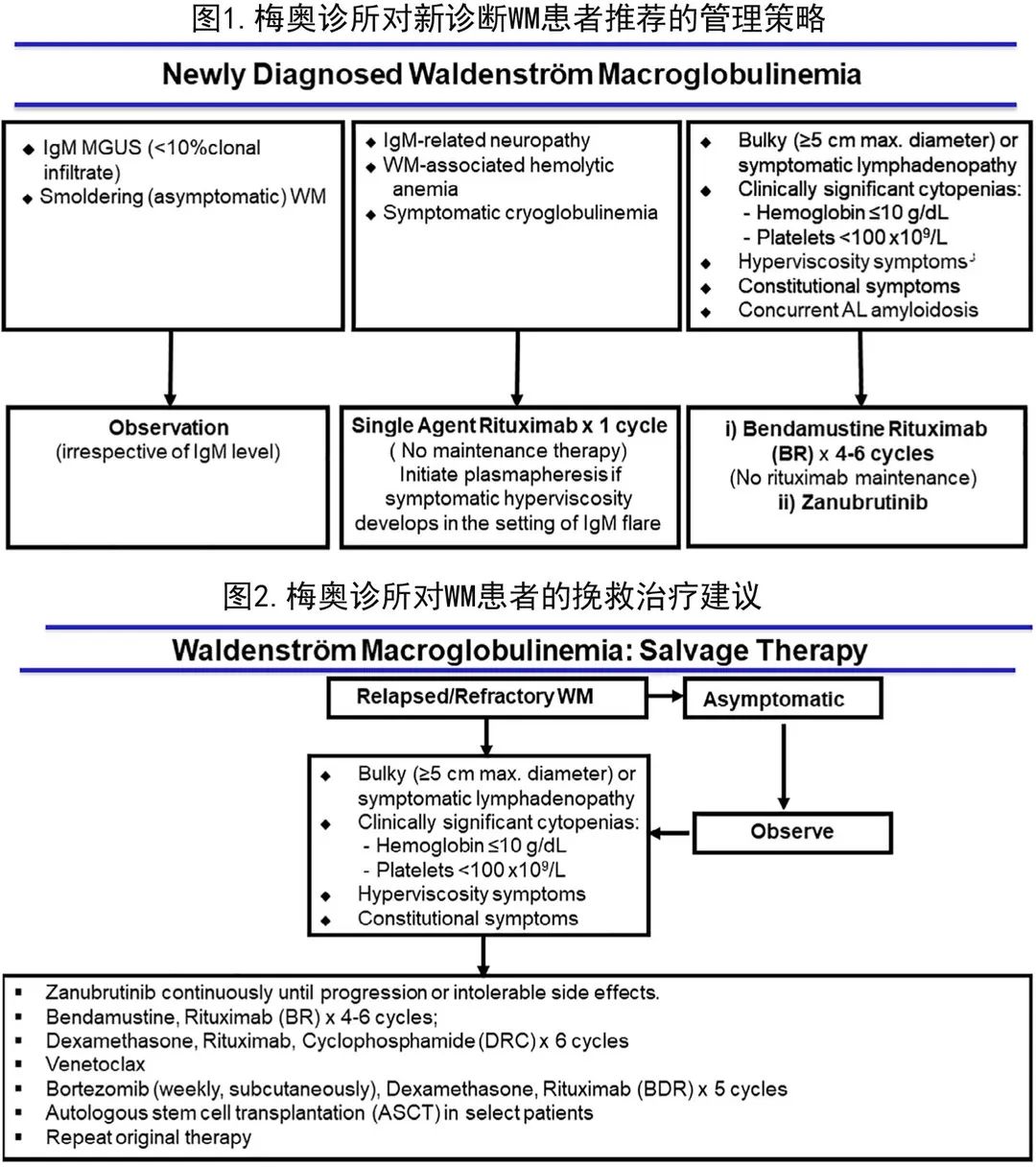
图1为梅奥诊所对新诊断WM患者推荐的管理策略,图2为复发性 WM 患者的治疗建议(基于梅奥诊所WM治疗和研究组制定的共识标准)。与其他低级别淋巴瘤不同,24个月内早期疾病进展不影响死亡率;无论接受何种治疗,至疾病进展时间对疾病进展后生存期均无影响。
总结
对于无症状WM可进行安全的观察和监测,但有症状的患者需要化疗。梅奥诊所首选利妥昔单抗+苯达莫司汀或泽布替尼。此外临床医生应重点关注的是,尽量减少治疗相关毒性和避免远期
参考文献
Morie A Gertz.Waldenström macroglobulinemia: 2023 update on diagnosis, risk stratification, and management.Am J Hematol . 2023 Jan 1. doi: 10.1002/ajh.26796.
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


