SHP1变构激活剂的最新研究进展
时间:2023-01-10 21:02:25 热度:37.1℃ 作者:网络
蛋白酪氨酸激酶(PTK)是过去20年抗肿瘤药物靶标中最为成功的靶标群,然而,与PTK共同参与调控蛋白酪氨酸磷酸化、去磷酸化动态平衡的蛋白酪氨酸磷酸酶(PTP),一直被认为是“不可成药”的靶点。
SHP1是PTP家族重要成员,主要在造血细胞中表达,被认为是淋巴瘤等恶性肿瘤的抑癌基因。SHP1表达量下降或者缺失,会导致肿瘤细胞的STAT3信号通路持续激活,是潜在的抗肿瘤靶点。弥漫性大B细胞淋巴瘤(DLBCL)的复发及耐药是肿瘤治疗的难点问题。在众多信号通路中,STAT3信号通路持续活化与DLBCL的复发及耐药关系密切。然而,STAT家族已知的成员共有7个,其中STAT1与STAT3高度同源且生物学功能相反,激活的STAT1行使抑癌蛋白功能。如何避免抑制STAT1是开发STAT3抑制剂不可回避的问题。鉴于SHP1主要在造血细胞中表达,开发特异性SHP1激活剂,激活SHP1、负向调控STAT3信号通路有可能成为治疗DLBCL的新策略。
相比于传统的致癌蛋白抑制剂研发取得的巨大成功,抑癌蛋白激活剂的研究工作进展缓慢,研究空间广阔,既充满挑战也充满机会。目前已知的SHP1激活剂,都是索拉非尼等酪氨酸激酶抑制剂(图1),在实体瘤细胞上表现出SHP1激活剂特征。由于调控STAT3信号通路上游的信号因子太多,现有的非特异性SHP1激活剂不能成为理想的工具化合物。研究SHP1激活剂治疗DLBCL的新策略,亟需高活性、高选择性SHP1激活剂作为工具化合物。
图1:细胞上表现出SHP1激活剂的特征的化合物
2022年12月14日,中国化学快报(Chinese Chemical Letters)在线发表了江南大学王文龙课题组与中科院上海药物所李佳课题组合作研发的SHP1变构激活剂的最新研究成果,文章标题为“Novel thieno[2,3-b]quinoline-procaine hybrid molecules: A new class of allosteric SHP-1 activators evolved from PTP1B inhibitors”。

图2:文章标题
该研究团队长期从事靶向PTP蛋白家族小分子调节剂的研发工作,通过对分子库进行SHP1激活活性筛选,发现具有PTP1B抑制活性的喹啉并噻吩类衍生物,经过结构修饰,代表性化合物3b显示了良好的SHP1激活活性(EC50 = 5.48 ± 0.28 μM),对DLBCL细胞表现了明显的抑制增殖活性(IC50 = 2.73 ± 0.02 μM),对BLK、BTK、ITK、JAK3、LCK、LYN以及TEC等PTK亚型均没有抑制活性(IC50大于50 μM)。

图3.化合物3b的发现
之后,作者对于该化合物的生化性质进行了研究,发现3b以浓度依赖的方式激活SHP-1,而不同的孵育时间对化合物3b的EC50没有影响,表明化合物3b以快速结合的方式与SHP-1结合。为了探讨化合物3b对SHP-1的激活机制,作者评价了SHP-1与底物DiFUMP的亲和力和催化效率。为了进一步验证3b在激活p-Tyr多肽存在下对生化去磷酸化的影响,作者使用了能变构激活SHP-2的2P-IRS-1多肽作为对比,发现2P-IRS-1在20 µmol/L时也能使SHP-1的磷酸酶活性增加约3.44倍,与3b表现出协同效应激活SHP-1。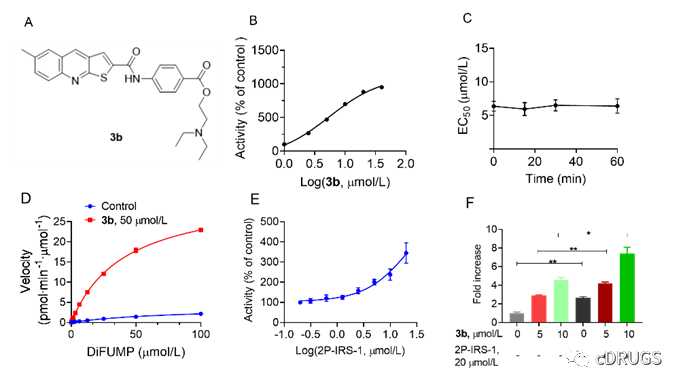
图4.化合物3b的生化性质研究
进一步,作者通过比较3b对SHP1不同截断体片段的激活活性差异,分析等温滴定热量法、小角X射线散射、分子对接和分子动力学模拟以及点突变等实验结果,认为化合物3b与 SHP-1的N端结合,从而变构激活SHP-1。
随后,作者为了评估化合物3b与细胞内SHP-1的结合能力,细胞热漂移分析(CETSA)显示,用化合物3b处理OCI-Ly10和SU-DHL-2 DLBCL细胞2小时,化合物3b处理的细胞在48oC时SHP-1带明显消失,而DMSO处理的细胞在50oC时SHP-1带明显消失。此外,3b可以剂量依赖的方式在SU-DHL-2细胞中破坏SHP-1的稳定性。这些结果为化合物3b在细胞水平靶向SHP-1提供了强有力的证据。
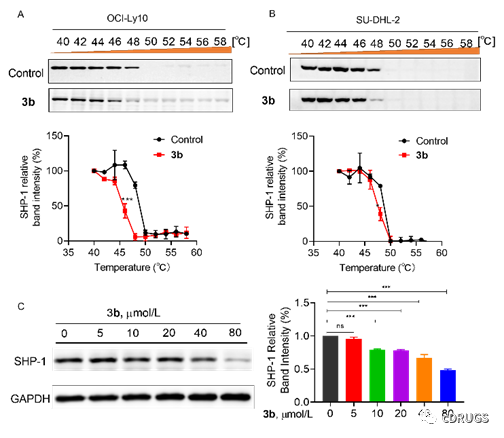
图5. 化合物3b的细胞热漂移示意图
最后,采用SU-DHL-2细胞移植瘤模型,评价化合物3b的体内抗DLBCL作用。将SU-DHL-2细胞接种于裸鼠皮下,建立裸鼠移植瘤模型。造模成功后,将小鼠随机分为两组。其中一组给予化合物3b,50 mg/kg腹腔注射,另一组给予与对照组相同体积的溶剂注射。治疗21天,结果显示,化合物3b显著抑制肿瘤生长,治疗21天后无明显的体重减轻。
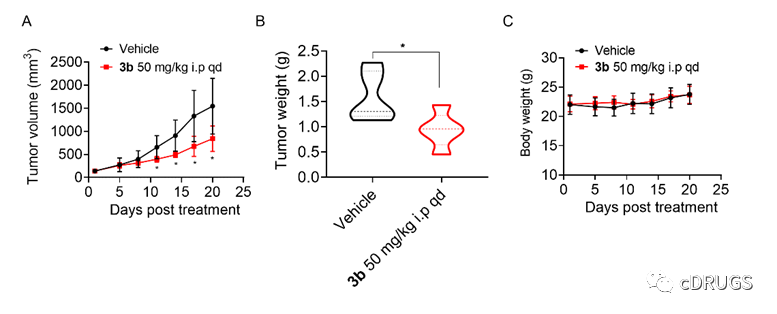
图6. 化合物3b的体内抗DLBCL作用
本研究通过结构修饰,将PTP1B抑制剂改造成SHP-1激活剂,首次为PTP家族各亚型抑制剂与激活剂的之间转换提供了成功的案例,首次研究SHP1激活剂负向调控STAT3信号通路的生物学机制;在细胞水平和动物水平,评价SHP1激活剂的抗DLBCL效果,为研究SHP1激活剂治疗DLBCL的新策略提供了一定数据支撑,为进一步开发和探索SHP-1激活剂提供了良好的起点和参考。


