中国科学院高飞/王红梅/内蒙古大学郭旭东揭示胎儿卵巢中Foxl2表达细胞的命运
时间:2023-01-05 18:01:37 热度:37.1℃ 作者:网络
性腺体细胞在性别决定过程中获得性别特异性命运。在XX性腺中,一个子集的体细胞在性别决定后表达Foxl2,被认为是颗粒细胞的祖细胞。然而,这些细胞是否在后期发育阶段也有助于的其他细胞类型尚不清楚。
2022年12月27日,中国科学院动物研究所高飞、王红梅、内蒙古大学郭旭东共同通讯在Cell Discovery(IF=38)在线发表题为“Dissecting the fate of Foxl2-expressing cells in fetal ovary using lineage tracing and single-cell transcriptomics”的研究论文,该研究使用谱系追踪和单细胞转录组学技术分析了表达Foxl2的细胞在胎儿卵巢中的命运。该研究发现Foxl2表达的细胞在发育后期产生了三种类型的细胞,包括颗粒细胞、腔隙细胞和间质细胞。
单细胞RNA测序显示Foxl2阳性细胞在P0分为两组。一组在P14时进一步分化为颗粒细胞和Theca-G(来源于颗粒的Theca-G间质细胞)。另一组被归为基质细胞谱系,其中一小部分进一步分化为3β-hsd 阳性的Theca-S(来源于基质的Theca间质细胞)。Cyp17a1在Theca-S中表达,而在Theca-G中不表达。本研究表明,性别确定后,XX性腺中表达Foxl2的细胞具有多能性,鞘间质细胞来源于不同的祖细胞。该研究的数据在单细胞分辨率下为更好地理解卵巢发育中的体细胞分化提供了重要资源。

在哺乳动物中,睾丸和卵巢都起源于生殖脊,其形成为中肾腹内侧表面上皮层的增厚。哺乳动物的性别在胎儿性腺中是由Y连接高迁移率族蛋白(HMG)结构域转录因子Sry基因的存在与否决定的。Sry通过诱导Sox9表达来指导XY性腺支持细胞分化。在缺乏Sry表达的XX性腺中,体细胞在RSPO1/WNT4-β-catenin (CTNNB1)信号通路的调控下表达FOXL2。这些细胞被认为是颗粒细胞的祖细胞,并在发育后期的卵泡中分化为颗粒细胞。
FoxL2编码forkhead转录因子2,该转录因子是有helix/forkhead 转录因子中的一员,在女性生殖中起着至关重要的作用。人类Foxl2基因突变与眼睑病、上睑下垂、内眦皮逆综合征(BPES)相关。与1型BPES相关的表型之一是女性卵巢早衰。Foxl2缺失导致雌性小鼠卵巢发育不良和不育。Foxl2突变的颗粒细胞不能发生鳞状到立方状的转变,从而导致进行性卵泡衰竭和不育。
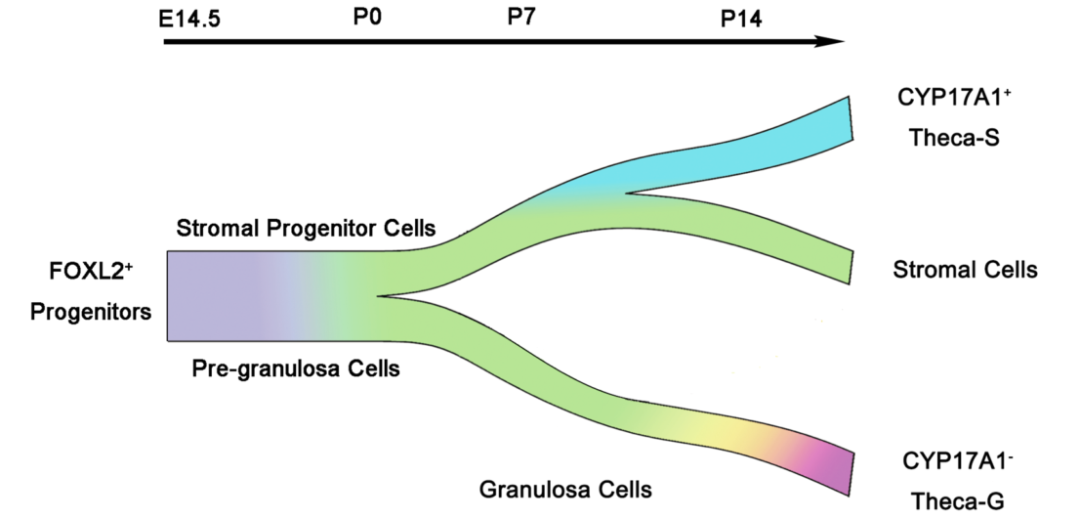
卵巢发育过程中FOXL2+细胞系重建的原理图(图源自Cell Discovery )
Leydig细胞和膜间质细胞分别是雄性和雌性性腺中的类固醇生成细胞。类固醇细胞产生的类固醇激素在生殖细胞和第二性征的发育中起着至关重要的作用。Leydig细胞在E12.5(交媾后12.5天)首次出现在睾丸中,而在出生后的卵巢中观察到膜间质细胞,伴随着初生卵泡的形成。Leydig细胞和膜间质细胞的起源在以前已被研究过。
据报道,卵巢中的腔隙性细胞有两个来源:卵巢原生的WT1阳性细胞和从中肾迁移来的GLI1阳性间充质细胞。女性性腺中的类固醇原性细胞来源于WT1阳性细胞。在FOXL2阳性细胞中,WT1的失活也会导致这些细胞转化为3β-hsd阳性的类固醇生成细胞。这些结果表明,胎性腺中的FOXL2阳性细胞具有发育为类固醇细胞的潜力。
在这项研究中证明了胎儿卵巢中表达Foxl2的体细胞产生颗粒细胞,膜间质细胞和基质细胞。Theca-S和Theca-G来源于不同的祖细胞。CYP17A1阴性的Theca-G细胞直接从颗粒细胞分化,而CYP17A1阳性的Theca-S来源于卵巢基质细胞,在P0处从颗粒谱系中分离出来。该研究还发现Theca-S和Theca-G之间的基因表达是不同的。该研究为更好地了解卵巢发育中的体细胞分化提供了重要资源。
原文链接:
https://www.nature.com/articles/s41421-022-00492-1


