Front aging neurosci-衰老特征对iPSC衍生以及重编程神经元的影响
时间:2022-12-28 21:00:16 热度:37.1℃ 作者:网络
许多中枢神经系统疾病与年龄相关,并非直接由基因突变引起。其中包括迟发性神经退行性疾病 (NDD),由于无法获得大量人脑标本,这对生物医学研究和药物开发构成了挑战。重编程技术的进步允许从诱导多能干细胞 (iPSC) 或直接从体细胞 (iN) 中获取神经元,从而生成更好的模型来理解新药的分子机制和设计。
然而,由于重新编程相关的细胞再生会重置供体细胞的老化标志,因此 iPSC 技术面临一些限制。直接神经元重编程,由此形成神经元通过从体细胞直接转化而无需经过多能中间阶段,可以生成维持供体衰老和表观遗传特征的源自患者的神经元。这方面可能有利于研究衰老在神经退行性变中的作用以及精细剖析潜在的病理机制。该篇综述比较了iPSC和iN模型的老化状态,并探讨这种差异如何影响 NDD体外模型的表型。

直接重编程和iPSC衍生神经元的衰老特征
首先是表观遗传和转录特征的变化。衰老变化包括整体异染色质减少、核小体丢失和重塑、组蛋白标记的变化、CpG岛高甲基化的整体 DNA 低甲基化以及染色质修饰因子的重新定位。甲基化改变已经过校准以准确预测细胞年龄,并允许对 iPSC 衍生的神经元和 iNS 进行准确的老化表征,阐明控制两种不同重编程策略的表观遗传机制及其对细胞的影响维持细胞年龄。

图1 iPSC衍生和直接转化神经元 (iN) 中的 DNA 甲基化
其次是线粒体功能的改变。线粒体是细胞主要能量发生器,也是细胞衰老和与年龄相关的 NDD 的主要目标。神经元线粒体通过调节能量代谢、细胞死亡、活性氧 (ROS) 产生、钙稳态和大分子生物合成,在突触传递和细胞存活中发挥重要作用。神经元几乎完全依赖于线粒体介导的葡萄糖氧化磷酸化来满足其能量需求。有研究发现,成纤维细胞衍生的iPSC和从 iPSC 重新衍生的成纤维细胞中线粒体质量和功能都有显着改善,细胞重编程到多能状态也被证明可以使线粒体相关细胞死亡机制恢复到胚胎阶段。这些细胞恢复线粒体功能和线粒体介导的细胞凋亡信号,这对于防止在存在染色体和基因组突变的情况下可能发生的致癌转化至关重要。
蛋白质稳态也非常重要。据报道,从 iPSC 分化而来的中型多刺神经元 (MSN) 不含典型亨廷顿蛋白 (HTT) 聚集体,而经典亨廷顿蛋白 (HTT) 聚集体是 HD 的特征,并且缺乏明显的细胞死亡表型。相反,直接转化为 MSN 的患者始终表现出突变 HTT (mHTT) 聚集体、mHTT 依赖性 DNA 损伤、线粒体功能障碍以及培养过程中随时间的自发退化。
衰老特征对脑疾病模型的影响
尽管许多NDD引起的突变已在很大程度上得到表征,但由于缺乏与人类神经元生理学正确相似的模型,进行药物筛选研究仍然非常困难。iPSC来源的神经元可塑性增加,可以更有效地诱导成熟表型。然而,iPSC 衍生的神经元表型更类似于胚胎阶段,表观遗传老化重置,因此对于建模与老化相关的疾病而言并不是最佳选择。
直接重新编程能够克服这个问题,但是转化效率相对较低。有的分化方案用于直接重编程 (PDR) 的多能性因子可以产生可扩展的神经元祖细胞 (iNPC),但是可能会改变表观遗传和转录衰老的特征。比如使用SOX2和C-MYC从血细胞直接重编程会导致诱导神经元干细胞 (iNSC) 早期阶段与年龄相关的DNA甲基化特征丢失。下表是使用iPSC 或直接重编程给神经退行性疾病建模的总结。
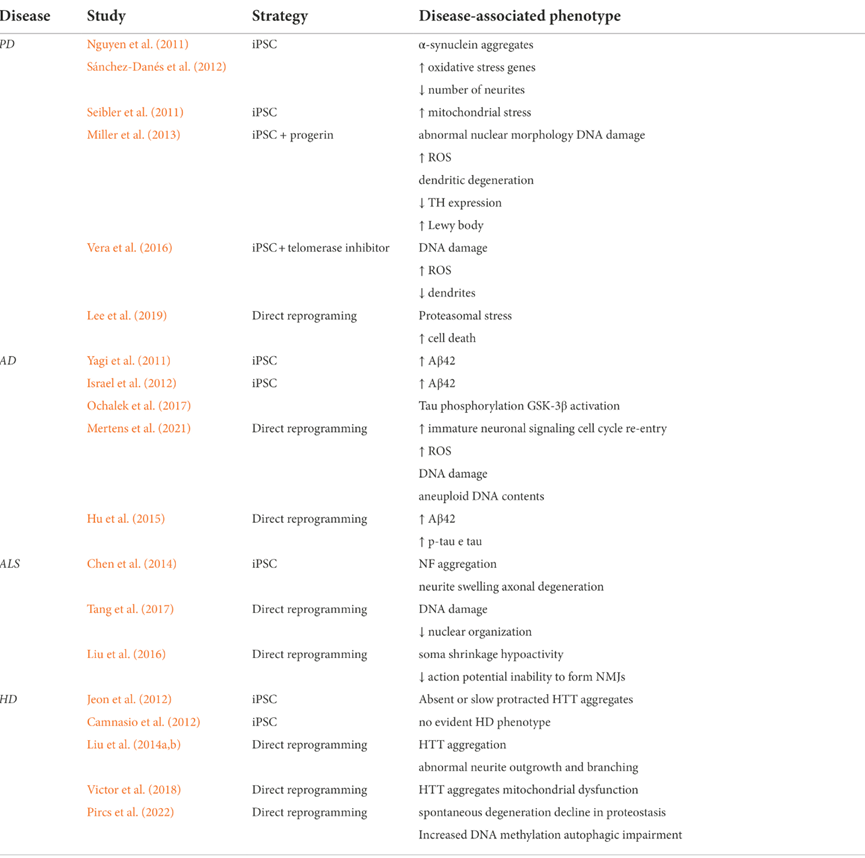
表1 iPSC 衍生和直接重编程衍生神经元中的疾病相关表型
未来前景
年龄与迟发性 NDD 发展具有相关性(图2)。由于难以获得可作为研究分子机制和测试药理治疗的平台的人类细胞来源,神经变性模型一直具有挑战性。在这种情况下,iPSC 分化和直接神经转换方法已成为获得可在体外重现人类疾病表型相对可靠的工具。
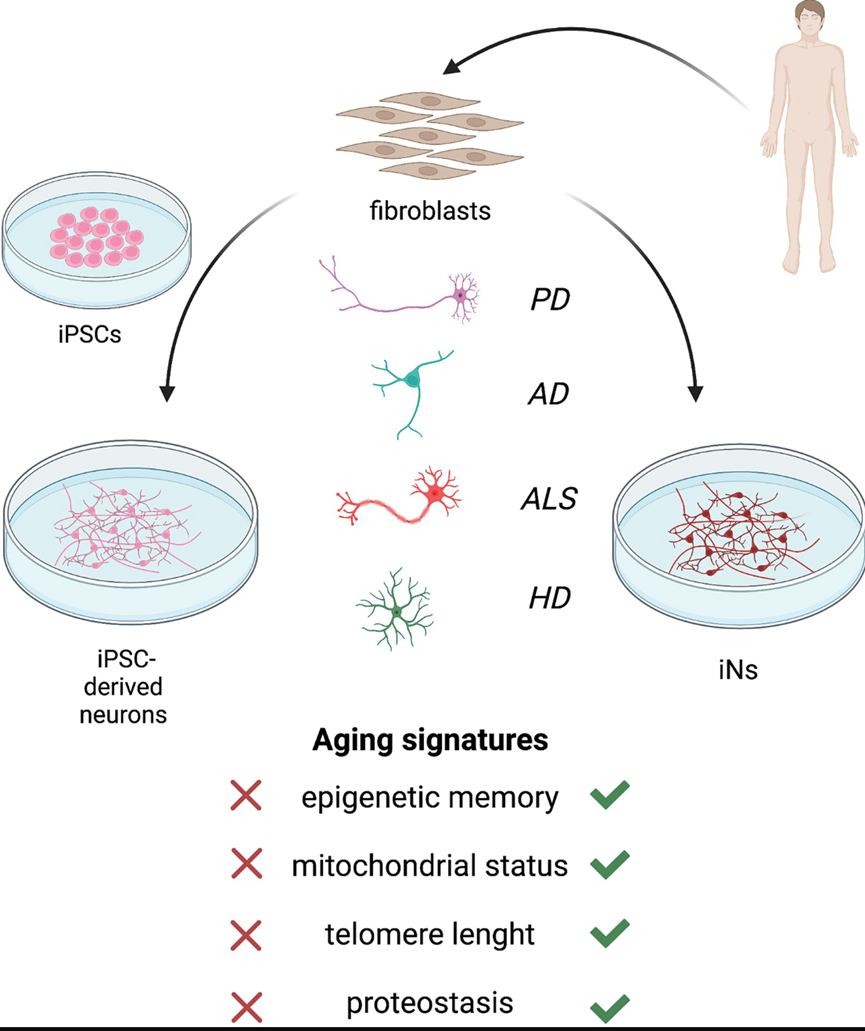
图2 年龄与迟发性 NDD 发展的相关性
使用 iNs 研究与年龄相关的疾病的一个主要障碍是再现性和效率差。开发研究 NDD 和寻找潜在药物的平台需要足够数量的可再生细胞,使用直接神经转换协议将工具转化为更大规模是一项挑战。
参考文献:
Aversano S, Caiazza C and Caiazzo M (2022) Induced pluripotent stem cell-derived and directly reprogrammed neurons to study neurodegenerative diseases: The impact of aging signatures. Front. Aging Neurosci. 14:1069482.doi: 10.3389/fnagi.2022.1069482
: , 。 视频 小程序 赞 ,轻点两下取消赞 在看 ,轻点两下取消在看


