Advanced Science | 南京大学王忠长/朱海亮等合作设计了一种新型纳米平台,实现恶性肿瘤的光动力/化疗协同治疗
时间:2022-12-27 11:59:51 热度:37.1℃ 作者:网络
缺氧条件下的光动力疗法(PDT)和化疗耐药性是抗肿瘤治疗的关键难题,同时也迫切需要靶向中枢神经系统肿瘤的纳米平台。
2022年12月22日,南京大学王忠长,朱海亮、南京医科大学邹美娟及郑州大学段勇涛共同通讯在Advanced Science 在线发表题为“Multifunctional Protein Hybrid Nanoplatform for Synergetic Photodynamic-Chemotherapy of Malignant Carcinoma by Homologous Targeting Combined with Oxygen Transport”的研究论文,该研究设计了一种新型多功能蛋白质杂交纳米平台(ODP-TH),由作为多类实体瘤识别因子的转铁蛋白(TFR)和供氧的血红蛋白组成。基于谷胱甘肽响应的二硫键交联,该蛋白质杂交框架封装了光敏剂原卟啉IX(PpIX)和化疗药阿霉素(Dox)。
从机制上讲,ODP-TH穿过血脑屏障(BBB),通过蛋白质同源性识别在缺氧肿瘤中特异性聚集。氧气和包封药物通过下调多重耐药基因1(MDR1)和缺氧诱导因子-1-α(HIF-1α)的丰度来促进治疗效果。结果表明,ODP-TH在肿瘤缺氧区域实现了氧转运和蛋白质同源性识别。与传统的光动力化疗相比,ODP-TH实现了更有效的肿瘤抑制作用。该研究不仅克服了靶向氧转运联合治疗中的缺氧相关抑制,而且实现了对乳腺癌、胶质瘤等多种肿瘤的有效治疗,为构建多功能靶向强化抗肿瘤纳米平台提供了新思路。

肿瘤微环境(TME)具有许多不同于正常生理条件的物理和化学特性,如低氧、低pH、高间质液和高血管通透性。上述特征中,缺氧环境与肿瘤生长、转移和不良预后密切相关。肿瘤内部血管增殖和异常发育不受控决定了其高代谢特征,高代谢耗尽了内部的氧气,进而使这些细胞产生耐氧效果,进一步增强肿瘤的恶性程度。光动力疗法(PDT)通过激光照射病变内部光敏剂产生细胞毒性单线态氧杀死肿瘤细胞,因其低毒性、无创和免疫激活的优点而被广泛研究。然而,缺氧TME限制了PDT期间细胞毒性单线态氧的产生。此外,PDT进一步耗尽了环境中存在的少量氧气,从而导致治疗的恶性循环。传统的化疗药物(如Dox)经常因其低靶向和高毒性而受到质疑,大剂量给药会造成不可逆转的损害,也有研究报道缺氧TME中的多重耐药基因1(MDR1)诱导P-葡萄糖蛋白的表达,导致肿瘤细胞对化疗药物不敏感。
鉴于缺氧环境阻碍了传统治疗的有效性,人们越来越关注改善肿瘤缺氧微环境的方法,如过氧化氢纳米载体、肿瘤中的类芬顿反应、二氧化锰纳米系统和高压氧治疗,通过外部或内部携氧来解决缺氧问题。血红蛋白(Hb)是一种包裹在红细胞中的蛋白质,广泛存在于脊椎动物中。一个Hb分子最多可携带四个氧分子,并在缺氧区域释放,可用于解决组织供氧问题。基于其氧运输能力和生物安全性,Hb在新型生物医学纳米平台开发中应用前景广阔。虽然Hb具有良好的氧气运输能力,但体内缺氧组织较多,如何将纳米颗粒精确转运到缺氧TME中成为新兴课题。
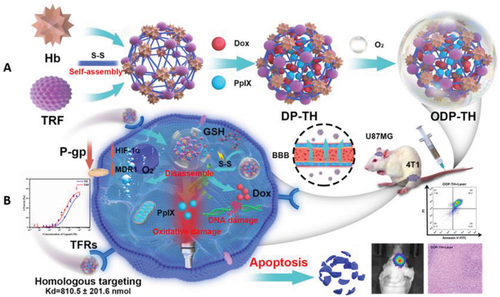
图1 ODP-TH合成和细胞内作用机制(摘自Advanced Science )
血脑屏障(BBB)是一种生理屏障,主要由胶质细胞和毛细血管组成,能够将脑组织与其他组织分隔开。很少有脂溶性药物可以通过自由扩散穿过BBB,因此手术是当前治疗颅内肿瘤(如神经胶质瘤)的主要方法。但大多数手术治疗都是基于功能保护的原则,无法实现肿瘤全切除。因此,术后辅助脑给药对于肿瘤治疗至关重要。目前,越来越多的纳米平台被用于脑靶向给药,其中以受体介导转运(RMT)为跨BBB机制的纳米平台具有较好的应用前景。
药物递送纳米平台开发中RMT的应用受到研究学者的广泛关注。TRF是一种铁载体蛋白,广泛存在于人类血液中。TRF可以识别并结合细胞膜表面的转铁蛋白受体(TFRs),通过血液循环完成细胞内的铁转运。与正常细胞膜相比,肿瘤和脑毛细血管内皮细胞膜含有显著更高量的TFRs,这为与TRF识别和结合提供了更大可能性。利用这一特点,基于TRF和TFRs同源识别的跨BBB靶向肿瘤药物递送纳米平台前景广阔。
受上述研究基础的启发且考虑到联合治疗的必要性,该研究创新性地开发了蛋白质杂交壳包裹的PDT联合化疗集成诊断和治疗纳米平台。TRF和血红蛋白设计用于特异性缺氧靶向和O2释放,并通过二硫键连接形成蛋白质杂交体。具体来说,通过将光敏剂PpIX和化疗药物Dox封装在杂化蛋白壳(ODP-TH)中形成多功能纳米平台(图1)。结果表明,由于其优异的同源蛋白识别能力,ODP-TH能够成功穿过BBB并被不同类型的癌细胞准确快速地吸收。此后,存在于纳米壳中的HbO2在低氧TME中自发并持续地解离O2,缓解了肿瘤中的顽固性低氧。
该设计策略不仅保证了PDT的氧供应,也抑制了MDR1和HIF-1α的表达。谷胱甘肽在TME中的过量表达破坏了ODP-TH中的二硫键,分解纳米颗粒结构并释放封装的药物。通过形态学、蛋白质组成分析和光谱学对ODP-TH蛋白质杂交纳米颗粒进行表征,以证实ODP-TH在体内和体外的抗肿瘤效果。进一步分析表明,体外递送氧气改善了TME的缺氧现象,为PDT和化疗奠定基础。此外,TRF标志物的同源靶向增强了PDT和化疗效果。值得注意的是,基于ODP-TH的药物在肿瘤中的长期滞留效应为低剂量高效治疗提供了可行途径。总之,该研究开发了一种针对低氧TME的新型多功能协同抗癌疗法。
参考消息:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202203742


