JHO:南方科技大学卢奕/张健发现前列腺癌细胞骨转移时会与骨髓细胞之间发生细胞融合,促进骨转移的进展
时间:2023-05-05 14:38:56 热度:37.1℃ 作者:网络
骨转移是前列腺癌(PCa)患者死亡的主要原因,目前尚无有效的治疗方法。弥散性肿瘤细胞在骨髓中经常获得新的特性,引起治疗抵抗和肿瘤复发。因此,了解骨髓中播散性前列腺癌细胞的状态对于开发新的治疗方法至关重要。
2023年5月3日,南方科技大学卢奕和张健团队合作在Journal of Hematology & Oncology在线发表了题为“Myeloid-like tumor hybrid cells in bone marrow promote progression of prostate cancer bone metastasis”的研究论文,该研究在PCa骨转移中发现了一个独特的癌细胞簇,它表达髓细胞标记物,并在与免疫调节和肿瘤进展相关的途径中显示出显著的变化。该研究发现弥散性肿瘤细胞与骨髓细胞之间的细胞融合可能是这些骨髓样肿瘤细胞的来源。多组学结果显示,与细胞粘附和增殖相关的途径,如局灶粘附、紧密连接、DNA复制和细胞周期在这些嵌合细胞中发生了最显著的变化。
体内实验表明,嵌合细胞具有显著增加的增殖率和转移潜力。单细胞RNA测序和CyTOF显示,在嵌合细胞诱导的肿瘤微环境中,肿瘤相关的中性粒细胞/单核细胞/巨噬细胞高度富集,具有较高的免疫抑制能力。此外,嵌合细胞表现出增强的EMT表型,具有更高的致瘤性,并且对多西紫杉醇和铁死亡具有抗性,但对放疗敏感。综上所述,该研究表明骨髓中的自发细胞融合可以产生髓样肿瘤嵌合细胞,促进骨转移的进展,这些独特的弥散性肿瘤细胞群可以为前列腺癌骨转移提供潜在的治疗靶点。

前列腺癌(PCa)是世界范围内男性中第二常见的恶性肿瘤。早期前列腺癌的治疗包括手术、化疗、放疗和去势治疗。虽然大多数PCa患者在早期诊断,治疗后预后良好,但仍有许多患者在诊断时已处于晚期。远处转移发生在大多数晚期前列腺癌病例中,是前列腺癌死亡的主要原因。骨是前列腺癌最常见的转移部位。骨转移可引起严重的骨痛、病理性骨折和高钙血症,严重降低前列腺癌患者的生活质量和总生存率。前列腺癌合并骨转移患者的中位生存期小于3年,平均5年生存率仅为3%。目前,化疗、雄激素剥夺治疗和免疫治疗是前列腺癌转移的主要治疗方法。然而,大多数患者最终会出现治疗抵抗,这是PCa治疗失败的主要原因。
骨转移的发展是一个多步骤的过程,包括肿瘤细胞在进入休眠状态之前进入骨髓循环,然后在骨髓中再激活和增殖,以及骨重建。不幸的是,超过一半的PCa患者在最初诊断时出现骨转移。由于骨髓中存在休眠的弥散性肿瘤细胞(DTC),可能需要10年以上的时间才能形成临床明显的转移性复发。导致DTC休眠的机制包括肿瘤细胞的自噬、干细胞壁龛的信号以及与细胞外基质或免疫细胞的相互作用。播散性肿瘤细胞在肿瘤进展中的作用近年来受到越来越多的关注,特别是因为它们可以保持休眠状态以逃避化疗和放疗。大量研究表明,DTC可以作为复发的预后标志物,并代表癌症治疗的潜在靶点。
与原发肿瘤细胞相比,骨髓中的DTC在骨转移的过程中获得了新的特征,往往经历了显著的进化。例如,骨髓中的大多数dtc表现出上皮间充质转化(epithelial mesenchymal transition, EMT)的特性,N-cadherin上调,E-cadherin下调,以及成骨细胞样/破骨细胞样表型,帮助它们在骨髓中存活。因此,了解弥散性前列腺癌细胞在骨髓微环境中的状态,对于开发新的骨转移治疗方法是迫切需要的。
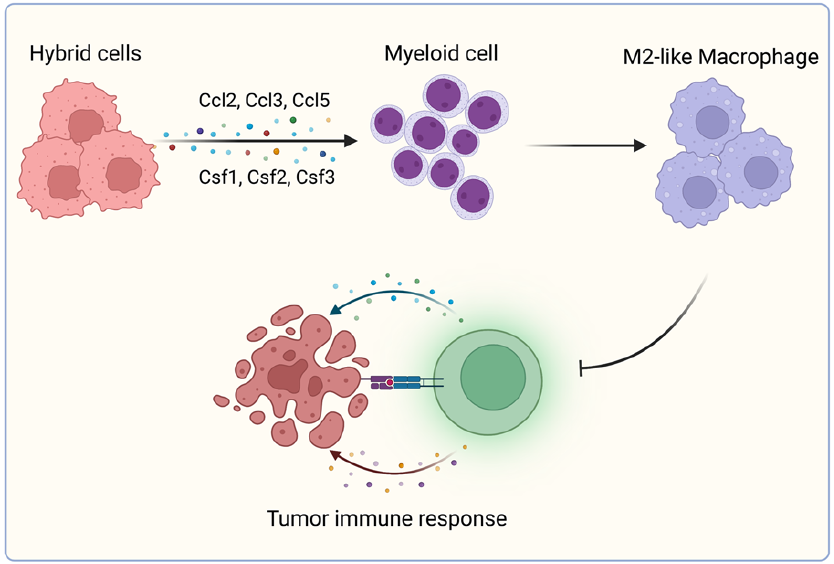
肿瘤相关巨噬细胞在嵌合细胞诱导的微环境中表现出更高的免疫抑制能力(图源自Journal of Hematology & Oncology )
该研究从PCa骨转移的单细胞RNA测序数据中分析了播散性肿瘤细胞的转录组。该研究通过尾动脉注射肿瘤细胞建立骨转移模型,并用流式细胞术对肿瘤嵌合细胞进行分选。该研究进行了多组学分析,包括转录组学、蛋白质组学和磷酸化蛋白质组学分析,以比较肿瘤嵌合细胞和亲本细胞的差异。通过体内实验分析嵌合细胞的肿瘤生长速度、转移和致瘤潜能、药物和辐射敏感性。通过单细胞RNA测序和CyTOF分析嵌合细胞对肿瘤微环境的影响。
该研究发现弥散性肿瘤细胞与骨髓细胞之间的细胞融合可以产生具有完全不同转录组、蛋白质组、磷酸化蛋白质组和代谢组的骨髓样肿瘤嵌合细胞。嵌合细胞通过在体内招募和诱导具有免疫抑制性的N2 - TAMs和M2 - TAMs,可以诱导出更具免疫抑制性的微环境。肿瘤嵌合细胞在EMT通路上也表现出显著的上调,在体内具有更高的致瘤和转移能力。体内动物实验表明,这些骨髓样嵌合肿瘤细胞具有较高的致瘤性和转移潜力,可诱导免疫抑制更强的微环境。除此之外,嵌合细胞在体外和体内对多西紫杉醇和铁死亡诱导剂都有耐药性。基于这些结果,嵌合细胞可以促进体内PCa的进展,因此代表了PCa治疗的潜在靶点。
原文链接:
https://jhoonline.biomedcentral.com/articles/10.1186/s13045-023-01442-4


