Cancer Res | 南方医科大学董忠谊团队发现PARP抑制诱导LKB1突变型肺癌的合成致死率和适应性免疫
时间:2022-12-25 14:59:52 热度:37.1℃ 作者:网络
在LKB1突变的非小细胞肺癌(NSCLC)中,突变负担升高和“寒冷”的肿瘤微环境(TME)之前存在矛盾。目前对这一矛盾特征的分子基础和治疗策略相关研究较为缺乏。
2022年12月13日,南方医科大学董忠谊团队在Cancer Research 上在线发表题为“PARP inhibition induces synthetic lethality and adaptive immunity in LKB1-mutant lung cancer”的研究论文,该研究通过绘制Kras和Kras/Lkb1驱动的肺肿瘤基因工程小鼠模型的单细胞转录组图谱,检测到Kras/Lkb1驱动的肿瘤中肿瘤内源性IFNγ信号通路受损,这解释了惰性免疫环境。机制分析表明,突变LKB1导致DNA损伤修复过程缺失,PARP1异常激活。过度激活的PARP1通过与STAT1的多聚(ADP -核糖化)物理相互作用和增强,削弱了IFN - γ通路,损害了其磷酸化和激活。
在LKB1突变介导的DNA修复缺陷的基础上,PARP1驱动程序的废除引发了NSCLC的合成致死性,同时也恢复了磷酸化的STAT1,以支持免疫“热”TME。因此,PARP1抑制恢复了中断的IFN-γ信号,从而在多个Lkb1缺陷的小鼠肿瘤模型中建立了适应性免疫反应,并与PD-1阻断发挥协同作用。总之,该研究揭示了DNA修复过程和适应性免疫反应之间未被探索的相互作用,为双重抑制PARP1和PD-1治疗LKB1突变NSCLC提供了重要信息。

肝激酶B1 (LKB1),也被称为丝氨酸/苏氨酸激酶11 (STK11),最初被确定为一种肿瘤抑制因子,其失活突变定义了一种独特的非小细胞肺癌(NSCLC)亚型,预后不良,且常规治疗效果不佳。即使在免疫治疗实践的时代,LKB1功能丧失突变患者从单一程序性死亡(配体)-1 [PD-(L)1]剂中获得的总体应答率仍然不到10%。
对LKB1缺陷如何机械地导致免疫治疗的主要耐药性这一核心问题的理解仍然是最大的临床挑战之一。尽管初步证据表明LKB1缺乏会损害先天免疫,但这种免疫抑制作用是否完全归因于“非特异性”免疫系统还存在争论。
然而,在已知的免疫治疗预测因子中,LKB1突变NSCLC中存在着相互矛盾的特征。LKB1通过维持同源重组(HR)功能来保持基因组的完整性,因此LKB1缺失患者的肿瘤突变负担(TMB)升高。LKB1功能缺失同时形成了惰性肿瘤微环境(TME),其特征是PD-L1表达减少和淋巴细胞浸润减少,从而对抗PD -(L)1药物产生耐药性。
针对这些矛盾的特征,设想可以从两个维度重新激活LKB1突变肺癌的抗肿瘤活性免疫系统,将“冷”TME变为“热”TME ,并在HR缺陷的基础上诱导进一步的DNA损伤。因此,重新激活适应性免疫的策略,同时触发合成致死效应,可能是一种最佳的治疗模式。
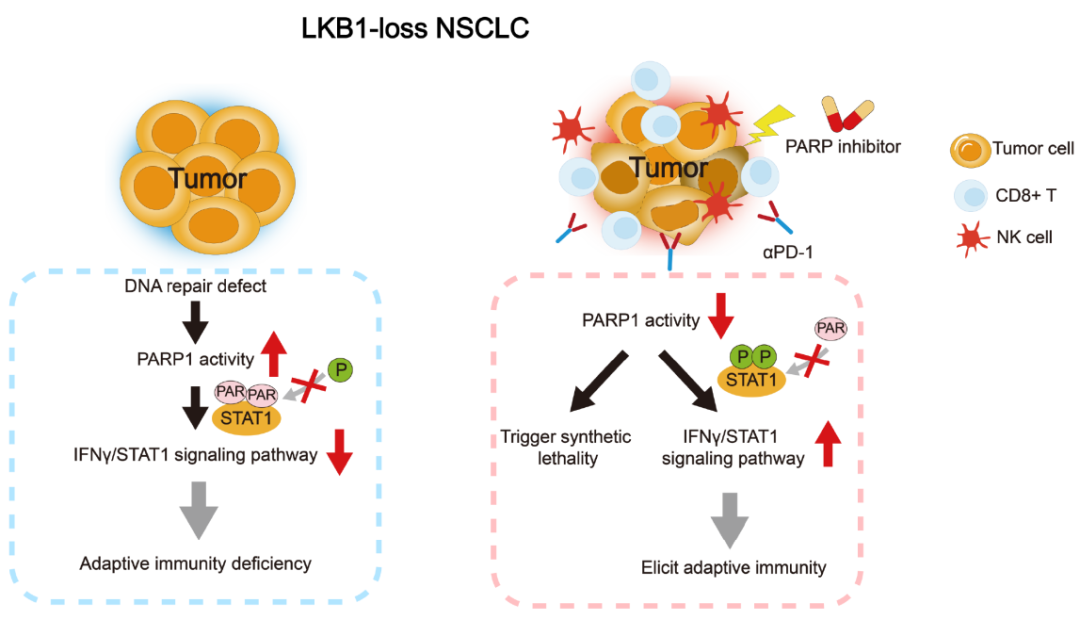
PARP1介导的STAT1多聚是抑制IFNγ信号通路介导的适应性免疫应答的关键步骤(图源自Cancer Research )
鉴于此,本研究采用单细胞RNA测序(scRNA-seq)在基因工程小鼠模型中描绘了Kras/Lkb1与Kras驱动的肺肿瘤的转录组图谱,旨在阐明调节适应性免疫抵抗的机制。此外,研究人员确定了潜在的靶点,并相应地提出了一种新的治疗策略,能够通过诱导合成致死效应和重新激活适应性免疫来激发对LKB1突变肿瘤的抗肿瘤活性。
参考信息:
https://doi.org/10.1158/0008-5472.CAN-22-1740


