PNAS: 挑战经典理论,AD早期炎症或因它而起
时间:2022-12-18 21:00:04 热度:37.1℃ 作者:网络
在经典理论中,AD中的神经炎症是由胞外Aβ斑块沉积和神经细胞死亡诱导小胶质细胞的激活和聚集后产生的。然而,炎症趋化因子和促炎因子上调等现象在缺乏这些病理学特征的转基因小鼠模型中被发现,使作者对最早期的AD相关的免疫反应过程的起因产生疑问。近日,加拿大蒙特利尔麦吉尔大学的A. Claudio Cuello团队发现可溶性的淀粉样蛋白寡聚体在阿尔茨海默病(AD)的早期可引起神经炎症。
 在AD发病初期Aβ斑块形成前,大脑的海马脚以及CA1等部位的神经元内部均出现了胞内可溶性低聚性Aβ蛋白(iAβ)。作者认为,与斑块无关的炎症反应就源于这种iAβ胞内聚集神经元,这些神经元产生的细胞因子与小胶质细胞的活化相关。作者构建了表达人Aβ前体蛋白(APP)突变体的转基因大鼠模型,用激光捕获显微切割(LCM)技术提取iAβ胞内聚集神经元,经实验证实了这种内含iAβ的神经元在海马脚、CA1等处的存在,并证明了它诱导的神经炎症过程是先于Aβ斑块沉淀和Tau蛋白聚集发生的,从而揭示了神经元内Aβ积累这一重要AD病理学现象。
在AD发病初期Aβ斑块形成前,大脑的海马脚以及CA1等部位的神经元内部均出现了胞内可溶性低聚性Aβ蛋白(iAβ)。作者认为,与斑块无关的炎症反应就源于这种iAβ胞内聚集神经元,这些神经元产生的细胞因子与小胶质细胞的活化相关。作者构建了表达人Aβ前体蛋白(APP)突变体的转基因大鼠模型,用激光捕获显微切割(LCM)技术提取iAβ胞内聚集神经元,经实验证实了这种内含iAβ的神经元在海马脚、CA1等处的存在,并证明了它诱导的神经炎症过程是先于Aβ斑块沉淀和Tau蛋白聚集发生的,从而揭示了神经元内Aβ积累这一重要AD病理学现象。
LCM是一种从组织中精确地分离单一细胞的技术,可以在不破坏组织结构,保存要捕获的细胞和其周围组织形态完整的前提下,直接从冰冻或石蜡包埋组织切片中获取目标细胞。
作者首先发现在5月龄APP转基因(Tg)大鼠中,iAβ在海马脚及CA1神经元内聚集,证明了AD早期iAβ胞内聚集神经元的存在。进一步利用LCM技术获取组织样品,在Tg大鼠iAβ胞内聚集神经元内检测到炎症因子CCL2,CCL3,CIL-6的mRNA水平上调;CD70,IL-12α下调。通过免疫荧光实验也证实了Tg大鼠海马脚神经元CCL2和CCL3的表达显著增加,以及CA1神经元CCL2的表达增加(图1)。
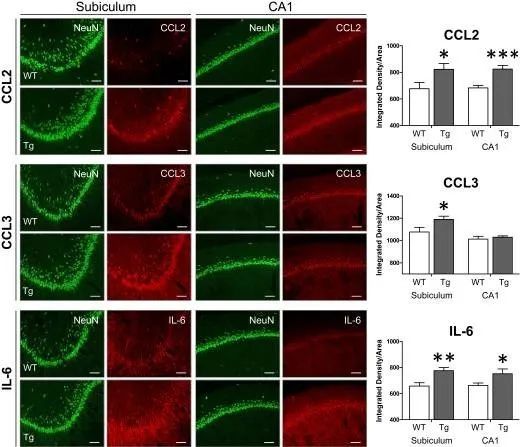
图1. 在斑块前期Tg大鼠的海马神经元中趋化因子和促炎因子被上调
而后,作者在聚集iAβ的神经元周围发现小胶质细胞的活化和富集,并测量了相关免疫活性因子与小胶质细胞的数量的激活程度呈线性相关,说明iAβ神经元在早期通过上调免疫活性分子募集小胶质细胞。利用RNA分子杂交和双重免疫印迹技术显示CCL2,CCL3,IL-6等细胞因子的mRNA在iAβ聚集神经元和小胶质细胞、星形胶质细胞中的含量,发现iAβ聚集神经元内这些细胞因子明显较高,证明早期AD中的神经炎症反应是由iAβ介导的,而不是活化的胶质细胞(图2)。
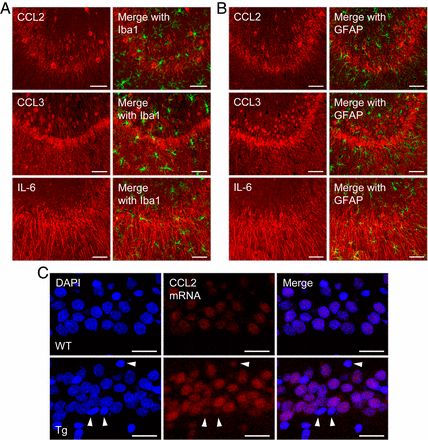
图2 炎性因子在斑块前Tg大鼠中iAβ聚集的神经元中(并非邻近的胶质细胞)被上调
在2月龄大鼠神经元内的iAβ明显低于5月龄大鼠,同时2月龄大鼠在海马脚可见IL-6水平升高,而在CA1处无明显差异,神经元周围激活小胶质细胞数目无明显变化,说明了AD早期炎症也是随着时间不断累积的。
在对AD患者的尸检中发现,未出现痴呆症状的(或临床前期)AD患者脑内含大量iAβ聚集神经元,CCL2主要在海马脚、CA1等神经元中出现;而在出现痴呆症状的AD患者脑中该现象则被Aβ斑块所替代,CCL2则在胶质细胞以及胞外被大量检测到。这基本符合神经炎症的产生来源由早期的iAβ沉积细胞,随AD病情发展,逐渐转变为胶质细胞的猜想。
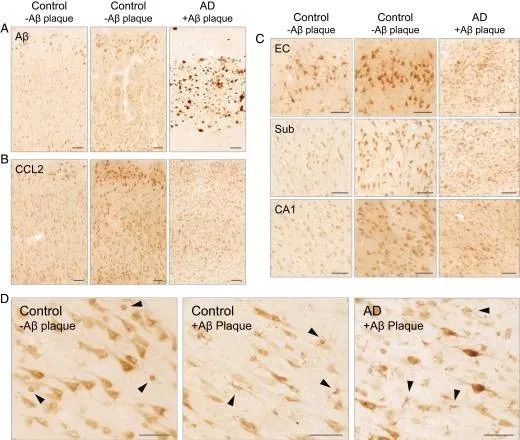
图3. 在没有细胞外淀粉样斑块和tau蛋白病理的情况下,iAβ聚集的神经元是人脑中CCL2的主要来源
本课题揭示了AD早期的病理反应过程,即海马脚、CA1等处的神经元内iAβ聚集,同时伴有炎症因子表达、小胶质细胞激活和聚集等免疫反应。这些早期反应最终转变为小胶质细胞介导神经炎症、Aβ斑块、神经元死亡和突触丢失等AD后期的病理学表现。为进一步了解AD的起因和发展历程、以及早期的预防工作起到指导作用。
根据本文的结论,作者还进一步提出许多值得研究的问题。如早期AD向后期转变的过程是怎样的、如何避免小胶质细胞被iAβ聚集细胞过度激活引发后续损伤、如何避免胞内Aβ出现等。对这些问题的研究或许能为AD的预防和早期治疗提供新的路线和手段。


