ASH 2022:BCMA CAR-T细胞治疗对复发/难治性多发性骨髓瘤 (RRMM) 的ORR高达100%
时间:2022-12-14 06:00:04 热度:37.1℃ 作者:网络
针对嵌合抗原受体 (CAR) T 细胞疗法的 B 细胞成熟抗原 (BCMA) 在复发和/或难治性多发性骨髓瘤 (RRMM) 受试者中显示出令人信服的临床活性和可控的安全性。 CART-ddBCMA 是一种自体抗 BCMA CAR T 细胞疗法,具有针对 BCMA 的独特合成结合域,而不是典型的 scFv 方法、4-1BB 共刺激基序和 CD3-zeta 激活域。 结合域是一种小的稳定蛋白,称为 D 域,包含 73 个氨基酸。 CART-ddBCMA 正在一项首次人体临床研究中进行研究。
这项 1 期、多中心、开放标签、剂量递增试验招募了 RRMM 受试者,这些受试者之前接受过 ≥ 3 种方案,包括蛋白酶体抑制剂、免疫调节剂和 CD38 抗体,或者是三重耐药的。 在第 -5 至 -3 天每天进行淋巴清除(氟达拉滨(30 毫克/平方米/天)和环磷酰胺(300 毫克/平方米/天)),然后在第 0 天以单次输注方式给予 CART-ddBCMA。剂量递增 在 100 (DL1) 和 300 (DL2) x 106 (+/- 20%) CAR+T 细胞下进行,并在 DL1 继续登记,以进一步评估安全性、有效性以及药代动力学和动力学。 主要终点是不良事件 (AE) 的发生率,包括剂量限制性毒性 (DLT)。 其他结果指标包括根据 IMWG MM 统一反应标准评估的临床反应的质量和持续时间、微小残留病 (MRD) 的评估、无进展和总生存期以及血液中 CAR+ 细胞的量化。 MRD阴性结果通过二代测序(Adaptive clonoSEQ)获得。
结果显示,在 2022 年 5 月 3 日进行的最后一次数据截止时,37 名患者(患者,中位年龄 66 岁(范围:44-76 岁))入组,33 名接受了 CART-ddBCMA,31 名可评估初始安全性和临床反应。 CART-ddBCMA 输注后的中位随访时间为 12.1 个月。 27 名受试者接受了 DL1(6 名接受剂量递增,21 名接受剂量扩展,25 名可评估),6 名接受 DL2(全部可评估)。 CAR+ 细胞占总 CD3+ T 细胞的中位数为 72% (48-87%); 中值 VCN 为 2.2 拷贝/细胞 (1.1-3.5); 中位细胞活力为 99% (91-100%),中位细胞生产产量为 11.59 亿个细胞 (470-1626)。 受试者先前接受过 5 (3-16) 线治疗的中位数。 24 例 (77%) 为“三重难治”,21 例 (68%) 为“五重难治”; 12 名患者 (39%) 具有高肿瘤负荷,骨髓浆细胞≥ 50%; 12 名 (39%) 患者 (50%) 在基线时患有髓外疾病。 CRS 见于 28/31 (90%) 患者,但只有 1 名受试者(在 DL2 中)有 3 级 (G) CRS,所有其他病例均为 G≤2。 ICANS 见于 7 名受试者(5 名,G≤2;2 名,G3),每个 DL 有 1 名 G3 病例。 通过标准管理,所有病例都得到解决,没有后遗症。 没有非肿瘤细胞介导的毒性病例,没有延迟的神经毒性事件(即发生在第 28 天之后),也没有帕金森样症状。
根据 IMWG 标准(ORR,100%),所有 31 名可评估受试者均表现出临床反应,其中 22 例 sCR/CR(≥CR 率,71%)、7 例 VGPR(≥VGPR 率,94%)和 2 例 PR。 随着时间的推移,反应加深,并且随着更长时间的随访(最晚至第 12 个月)观察到向 CR/sCR 的转化。
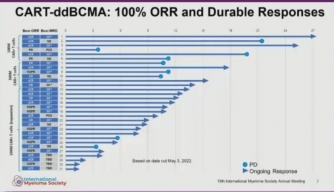
在迄今为止可评估 MRD 测试的患者中 (n = 22),19 名 (86%) 在 10-5 或更低时为 MRD 阴性。 中位反应持续时间、PFS 和 OS 在数据截断时不可评估,因为 31 名可评估受试者中有 22 名 (71%) 有持续反应。 在随访≥12个月的患者(n=16)中,其中包括8例(50%)EMD患者,ORR为100%,≥CR率为81%(13/16),≥VGPR率为88% (14/16)。 CART-ddBCMA 产品特性与所有批次的规格一致,没有制造故障。
结果表明,包括 CRS 和 ICANS 在内的不良事件是可控的,并且在整个队列中没有观察到非肿瘤组织靶向毒性、迟发性神经毒性或帕金森病样事件。 持续的疗效结果令人鼓舞,ORR 为 100%,其中 29 例 (94%) 表现出≥VGPR 的深度临床反应,22 例 (71%) 达到 CR/sCR。 在会议期间,将提供更新的数据。
与此同时,吉利德科学旗下Kite公司宣布与Arcellx公司达成研发合作协议,将共同开发和商业化Arcellx公司的临床后期在研疗法CART-ddBCMA,用于治疗复发或难治性多发性骨髓瘤患者。
根据合作协议,Arcellx将获得2.25亿美元前期付款和1亿美元股权投资,以及其它潜在里程碑付款。双方将共同承担CART-ddBCMA的开发费用。
“与Arcellx的合作让Kite能够进入具有高度未竟需求的新领域,将潜在‘best-in-class’细胞疗法带给很多患者。”Kite公司首席执行官Christi Shaw女士说。
参考资料:
Phase 1 Study of CART-Ddbcma for the Treatment of Subjects with Relapsed and /or Refractory Multiple Myeloma. Blood (2022) 140 (Supplement 1): 7439–7440.
Arcellx Announces Continued Robust Long-Term Responses From Its CART-DdBCMA Phase 1 Expansion Trial In Patients With Relapsed Or Refractory Multiple Myeloma And Additional Pipeline Progress. Retrieved December 9, 2022, from https://ir.arcellx.com/news/news-details/2022/Arcellx-Announces-Continued-Robust-Long-Term-Responses-from-its-CART-ddBCMA-Phase-1-Expansion-Trial-in-Patients-with-Relapsed-or-Refractory-Multiple-Myeloma-and-Additional-Pipeline-Progress/default.aspx


