复旦大学在Developmental Cell报道表观因子RING1A在心脏发育中的重要作用
时间:2022-12-06 11:58:51 热度:37.1℃ 作者:网络
先天性心脏病是新生儿最常见的出生缺陷,发病率高达0.4%~1%,也是婴幼儿死亡的主要原因之一。心脏发育受到很多基因的逐级精密调控,这些基因的突变与先天性心脏病的发生密切相关。
转录因子MESP1在发育早期瞬时表达,调控心脏前体细胞(cardiac progenitor)等的产生,但其激活早期心脏发育基因的机制仍待研究。已有报道在先天性心脏病病人中,发现了MESP1多个位点的单等位基因突变(single-allele mutation),表观遗传因子PRC1(Polycomb repressive complex 1)复合体、黏连蛋白(cohesin)复合体的多个组分也报道存在先天性心脏病致病突变,而这些组分在心脏发育中的具体作用机制还不清楚。
2022年11月21日,复旦大学基础医学院孙宁实验室和复旦大学生物医学研究院(IBS)蓝斐实验室在Developmental Cell(《发育细胞》)在线发表论文Essential role of MESP1-RING1A complex in cardiac differentiation,发现转录因子MESP1结合表观因子RING1A在心脏发育中共同发挥重要作用。
本研究首次发现MESP1可与PRC1核心蛋白RING1A相互作用,协同结合并激活人类心脏早期发育相关基因表达,如中胚层形成相关基因WNT5A、NCAM1、LEF1、ZEB2、MEIS1、MEIS2、PDGFRA、GATA6,与心脏谱系基因MYOCD和MEF2C;并发现RING1A在人类心肌细胞体外分化和小鼠心脏发育过程中发挥重要作用:RING1A缺失会导致人类心肌体外分化效率、收缩蛋白表达、钙处理能力等的下降;Ring1A敲除小鼠此前只报道过中轴骨发育异常,本研究发现Ring1A敲除小鼠出现与MESP1突变病人类似的先天性心脏病表型,如主动脉骑跨、室间隔缺损、肺动脉狭窄、致密化心室壁变薄等。
PRC1复合体的经典作用是抑制基因表达;近年来也有报道在皮肤、神经发育等过程中,PRC1可参与基因表达的激活。本研究发现MESP1-RING1A可与cohesin复合体、p300结合,通过调控A/B区室(compartment A/B)转换、增强子-启动子的染色质相互作用(chromatin interaction)、组蛋白乙酰化,激活心脏发育相关基因的表达。
本研究同时发现,MESP1致病突变会影响MESP1与RING1A、cohesin组分的结合,影响心脏发育基因的表达及心肌的正常分化。
总之,这些研究不仅证明了MESP1-RING1A在心脏发育中的重要性,同时也为MESP1,PRC1 和 cohesin组分突变导致先天性心脏病的机制提供了可能的解释。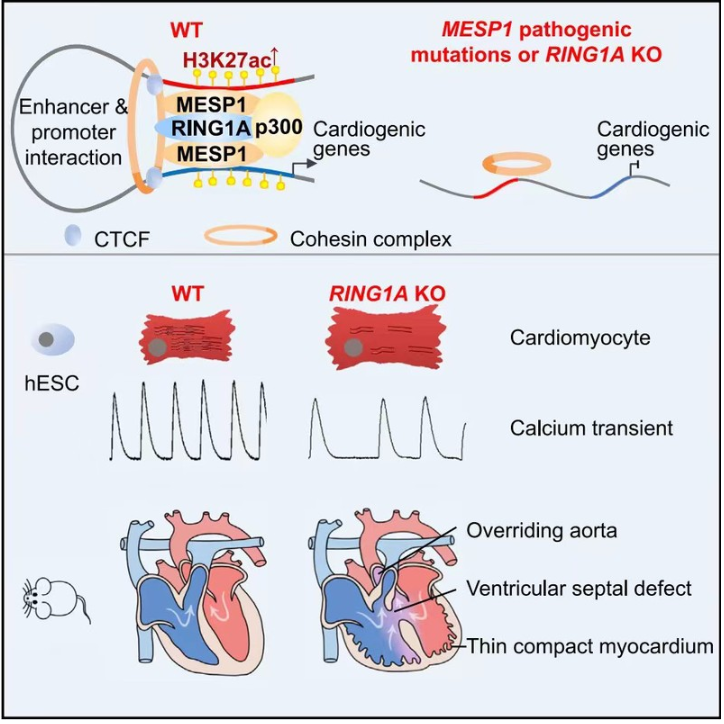
转录因子MESP1与表观遗传因子RING1A协同调控早期心脏发育


