Nature子刊:厦门大学韩家淮/刘文贤发现浆细胞分化的调控新机制
时间:2022-11-30 18:00:25 热度:37.1℃ 作者:网络
浆细胞(PC)是体液反应中的抗体分泌细胞和末端效应子。PC直接与响应T细胞非依赖性(TI)抗原的活化B细胞分化,或与T细胞依赖性(TD)抗原诱导的体液反应中的生发中心B(GCB)细胞分化,这两种途径基本上都由转录因子BLIMP1调节。p38丝裂原激活蛋白激酶亚型已经与B细胞发育有关,但p38α在B细胞分化中的确切作用仍然在很大程度上是未知的。
2022年11月28日,厦门大学韩家淮及刘文贤共同通讯在Nature Communications 发表题为“A p38α-BLIMP1 signalling pathway is essential for plasma cell differentiation”的研究论文,该研究表明在B细胞特异性缺失p38α的小鼠中,PC分化和抗体反应严重受损,而B细胞发育和GCB细胞反应则保持不变。通过使用Blimp1报告小鼠模型,发现p38α-缺乏导致BLIMP1表达降低。
p38α驱动的BLIMP1上调是TI和TDPC差异化所必需的。通过结合CRISPR/Cas9筛选和其他方法,将TCF3,TCF4和IRF4鉴定为p38α的下游效应子,以通过Blimp1转录控制PC分化。因此,这项研究确定了支撑BLIMP1上游PC分化的重要信号通路,并指出p38α在p38亚型中具有高度专业化和非冗余的作用。

体液免疫应答以高亲和力抗体产生为特征,保护生物体免受病原体侵害,在疫苗接种中起着不可或缺的作用。PC是体液免疫应答中的末端效应细胞,其分化和功能受到转录因子网络的严格调节。在这些转录因子中,BLIMP1作为主调节因子起作用。Blimp1的缺失完全阻断了B细胞淋巴瘤细胞系中PC的分化和异位Blimp1表达诱导的免疫球蛋白(Ig)分泌PC的分化。
BLIMP1表达在PC分化过程中上调,BLIMP1主要作为转录抑制因子,通过抑制对成熟B细胞身份至关重要的基因的表达和促进对PC细胞身份至关重要的基因的表达来控制PC分化和稳态。几种转录因子,包括NF-κB,STAT3,IRF4,AP-1和E2A,直接结合Blimp1位点,并在B细胞被BCR,模式识别受体(PRR)和T细胞信号激活后促进Blimp1转录。此外,据报道,几种激酶如PI3K,Jaks和ERK1/2可以调节这些转录因子在此过程中的活性。
作为抗体生产工厂,每个成熟的PC每秒分泌数千个抗体分子,其特征是扩展的内质网(ER)。重要的是,ER扩增和诱导未折叠蛋白反应(UPR)是PC分化过程中稳健免疫球蛋白合成所必需的,因为UPR上调伴侣表达并扩展ER网络以促进免疫球蛋白的正常折叠和分泌。
众所周知,人类受试者最常见的原发性免疫缺陷是原发性抗体缺陷(PAD),浆细胞分化缺陷是PADs或弥漫性大B细胞淋巴瘤(DLBLC)的主要原因之一。相反,浆细胞生成失调往往会导致自身抗体的产生和积累,这是自身免疫性疾病的重要原因,如系统性红斑狼疮(SLE)。几种抑制浆细胞分化的药物已被用于治疗临床上的这些自身免疫性疾病。
p38代表高度保守的丝裂原活化蛋白激酶(MAPK)基团。p38α参与包括免疫细胞在内的各种类型细胞的分化。通过体外系统,我们发现B细胞的生成以及淋巴和髓系细胞命运的决定依赖于MEF2C-EBF1转录因子,而P38抑制剂可以阻止这一过程。此外,MEF2C对BCR刺激的B细胞增殖和TD免疫应答至关重要,P38抑制剂可以抑制BCR刺激的MEF2C在这一过程中的活性。此外,CD40诱导的B细胞基因表达需要P38α的激活。因此,需要更多的系统遗传学研究来明确P38α和P38α- MEF2C轴在B细胞发育、GCB生成、PC分化和抗体反应中的作用。
在这项研究中,采用遗传学方法表明p38α激活是PC分化所必需的,但对于B细胞发育,活化,增殖和GCB细胞生成是可有可无的。研究进一步表明,TCF3,TCF4和IRF4在p38α下游起作用以促进Blimp1转录,并揭示IRF4通过磷酸化直接被p38α激活。由于失调的PC分化通常会导致自身免疫性疾病,p38α可能是治疗这些疾病的治疗靶点。
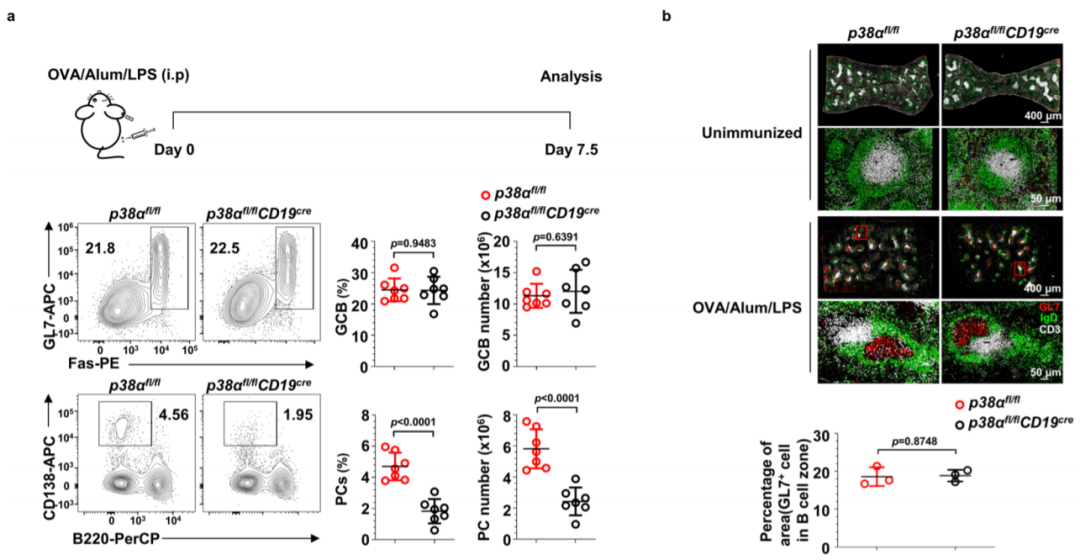
p38α在浆细胞生成和抗体反应中是必需的(图源自Nature Communications )
因此,在B细胞中特异性靶向p38α可能是治疗这些自身免疫性疾病以避免p38抑制剂的临床毒性的治疗策略。
参考消息:
https://doi.org/10.1038/s41467-022-34969-0


