ACS Nano:卞修武院士发现MOF基铁死亡诱导剂增强三阴性乳腺癌放疗
时间:2023-07-16 15:14:51 热度:37.1℃ 作者:网络
放射治疗(RT)是局部控制三阴性乳腺癌症(TNBC)进展的重要临床治疗方法之一,但放疗耐受的存在限制治疗效果。鉴于此,陆军军医大学西南医院、金凤实验室卞修武院士、仰毅教授和田甘教授团队以双重放射增敏方式设计了一种肿瘤微环境(TME)响应的MOF基纳米药物,其可有效递送亚铁离子(Fe2+)并抑制谷胱甘肽(GSH)的合成从而协同诱导铁死亡,结合高原子序数纳米材料的放疗增敏效应,协同促进TNBC的放射治疗效果。该研究以题为“A MOF-based Potent Ferroptosis Inducer for Enhanced Radiotherapy of Triple Negative Breast Cancer”发表在《ACS Nano》上。

该纳米药物合成过程如图1所示。首先通过一步法将L-丁硫氨酸-亚砜亚胺(BSO)包封于ZIF-8内,并在其表面原位生长金纳米粒子(Au NPs),接着进行铁基金属多酚(MPN)网络结构涂层,通过修饰透明质酸(HA)获得最终纳米药物BZAMH(图1A)。BSO可抑制γ-谷氨酰半胱氨酸合成酶(γ-GCS)以减少胞内内源性GSH的生物合成,从而使得GPX4失活。MPN释放的Fe2+可通过芬顿效应产生羟基自由基(•OH)。GPX4的失活和局部生成•OH共同诱导强效铁死亡。修饰后的Au NPs可改善入射X射线的能量沉积,实现增敏。各组分协同促进铁死亡并增强RT以有效治疗TNBC,同时抑制TNBC肺转移(图1B)。
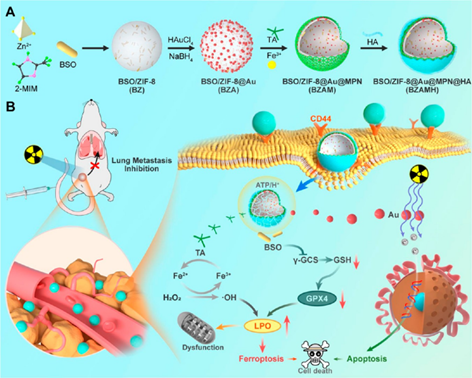
图1. MOFs基铁死亡纳米诱导剂的合成路线及作用机理图
【BZAMH 的物理化学性质表征】
所制备的BZAMH呈现空心球状结构,水合粒径约为200 nm。当生长了MPN壳层之后,由于TA的刻蚀与还原作用,BZAMH转化为非晶态空心结构,并且表面的铁离子以Fe2+居多,为后续的芬顿反应提供了有利条件。

图2. BZAMH的物理化学性质表征
【BZAMH可有效诱导铁死亡】
BZAMH消耗细胞GSH和放大氧化应激诱导铁死亡。实验以小鼠三阴性乳腺癌细胞4T1为模型细胞,证明了BZAMH可被细胞有效内吞,并能成功消耗细胞内的GSH,下调GPX4表达,造成脂质过氧化物(LPO)的累积,从而诱导明显的铁死亡效应。
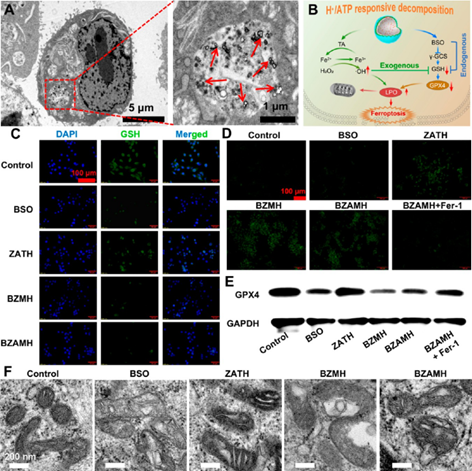
图3. BZAMH可有效诱导铁死亡
【铁死亡可与Au NPs协同增强RT】
铁死亡可增强RT,并与Au介导的放射增敏作用协同。实验证明了铁死亡和Au NPs都可以明显促进RT对肿瘤细胞的抑制作用,BZAMH NPs可以结合两者的协同作用,造成更明显的DNA损伤,表现出最强的细胞生长和克隆形成抑制作用,放射增敏系数达到1.32.
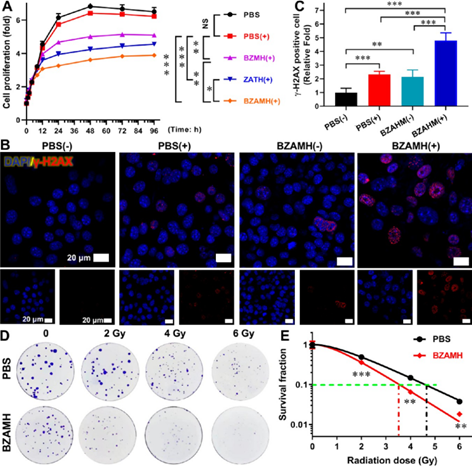
图4. 铁死亡可与Au NPs协同增强RT
【体内抗肿瘤实验】
BZAMH在X-ray作用下表现出明显的肿瘤生长抑制作用。皮下4T1荷瘤小鼠模型实验结果表明,BZAMH+X-ray介导的铁死亡和增强RT具有最明显的肿瘤生长抑制效果,延长了小鼠的生存期。对肿瘤组织进行切片染色发现,BZAMH+X-ray可以显著降低Ki67和GPX4的表达,造成严重的DNA损伤,从而成功抑制细胞增殖和控制肿瘤进展。
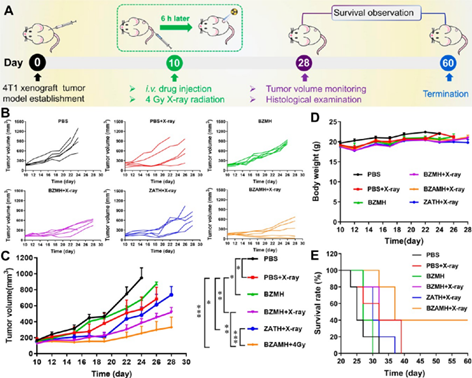
图5. BZAMH NPs体内抗肿瘤实验
【抗肺转移研究】
采用血流转移和乳腺癌原位肺转移双模型研究了BZAMH介导的增强放疗的抗TNBC肺转移能力。血流模型研究发现,BZAMH+X-ray可以明显抑制小鼠肺部肿瘤结节的产生;乳腺癌原位肺转移模型研究发现,BZAMH+X-ray不仅可以抑制原位肿瘤的生长,同样可以减少乳腺癌肺转移现象的发生。
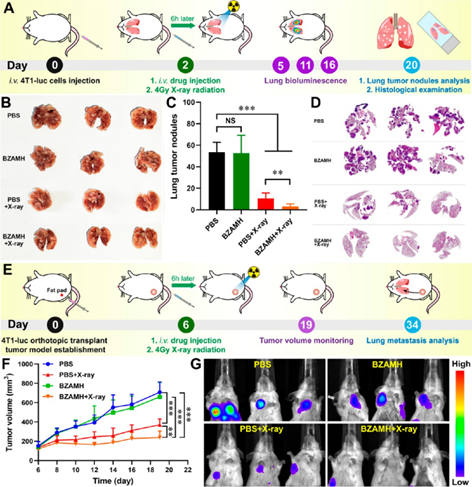
图6. 抗肺转移研究
【小结】
该研究研发了一种MOF基纳米药物,可控递送Fe2+以引发类芬顿效应以执行铁死亡,TME响应释放的BSO可内源性抑制GSH生成使GPX4失活以破坏铁死亡防御系统,二者协同诱导强烈的铁死亡。结合Au NPs的放疗增敏效应,高效控制原位瘤进展并有效抑制乳腺癌肺转移。总之,本研究引入的智能纳米药物为抗癌治疗提供了见解,有望为下一代纳米药物的发展提供可靠的参考。
原文链接:
https://pubs.acs.org/doi/abs/10.1021/acsnano.3c00048


