武汉大学郭明雄/孙桂鸿团队《AM》:构建人工携药囊泡以强化肿瘤特异性靶向疗法
时间:2023-07-12 17:34:13 热度:37.1℃ 作者:网络
多形性胶质母细胞瘤(GBM)的治疗受到复杂病理和药物输送过程中需要穿过血脑屏障(BBB)的阻碍。尽管外泌体在GBM治疗中具有巨大的潜力,但由于其在靶向和递送方面的局限性,仅凭外泌体不能完全满足治疗要求。
近期,武汉大学郭明雄教授和孙桂鸿副教授等人基于表达ANG-TRP-PK1肽的HEK293T细胞,开发了一种工程化人工囊泡(EAVs),即ANG-TRP-PK1@EAVs。ANG-TRP-PK1是Angiopep-2的融合肽,与TRP-PK1的N末端融合,在EAVs上呈递Angiopep-2。ANG-TRP-PK1@EAVs具有与分泌的外泌体相似的特性,但产量要高得多。ANG-TRP-PK1@EAVs在体外模拟血脑屏障模型和体内原位GBM小鼠模型中均展现出了有效的血脑屏障穿透和GBM靶向能力。负载阿霉素的EAVs(ANG-TRP-PK1@DOX)没有改变EAVs的特性,其可以在原位GBM小鼠模型中穿过血脑屏障、到达GBM并杀死肿瘤细胞。该工程载药人工囊泡在小鼠中显示出比替莫唑胺更好的GBM治疗效果,同时副作用很小。
总之,EAVs可以插入不同的靶向配体并包装不同的药物,有望成为一种独特而有效的药物递送和肿瘤治疗的纳米平台。相关工作以“Engineering and Characterization of an Artificial Drug-carrying Vesicles Nanoplatform for Enhanced Specifically Targeted Therapy of Glioblastoma”为题发表在Advanced Materials。

【文章要点】
一、ANG-TRP-PK1@DOX
为了制备一种适用于GBM化疗的具有高效靶向功能的人工囊泡仿生纳米药物,作者设计了一种策略来产生包载了DOX的EAVs,其中ANG-TRP-PK1融合肽存在于囊泡的细胞膜上(ANG-TRP-PK1@DOX)。如图1所示,作者构建了一个DNA克隆来有效表达ANG-TRP-PK1融合肽(ANG-TRP-PK1构建体),然后将其转染到HEK293T细胞中,以在细胞膜上表达和呈递融合肽ANG-TRP-PK 1。进一步地,将DOX电转染到表达ANG-TRP-PK1的HEK293T细胞中后,作者用脂质体挤压机挤压细胞,制备含有DOX的人工囊泡,其中囊泡的细胞膜上存在ANG-TRP-PK 1融合肽(ANG-TRP-PK1@DOX),可靶向在血脑屏障和GBM上高度表达的LRP1。
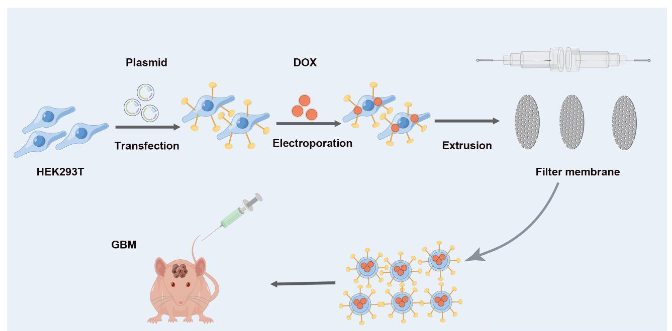
图1 材料制备与表征
二、特异性靶向疗法
实验显示,ANG-TRP-PK1@DOX具有靶向选择性,并且具有渗透血脑屏障的能力。此外,使用原位GBM小鼠模型,作者也在活体中验证了ANG-TRP-PK1@DOX的治疗效果。研究结果表明,这种纳米平台为靶向GBM化疗提供了巨大的前景。此外,EAVs可以插入不同的靶向配体,并有效地包装不同的药物用于各类肿瘤治疗,这将为靶向肿瘤精准治疗提供一种新的药物递送工具。
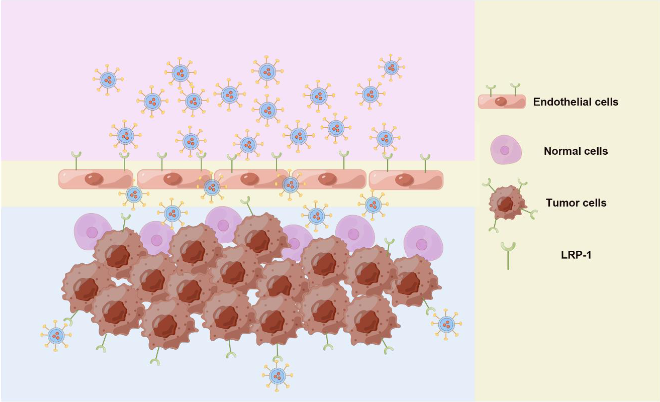
图2 抗肿瘤治疗示意图
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adma.202303660


