NEJM:Pirtobrutinib治疗慢性淋巴细胞白血病,总缓解率达84.4%
时间:2023-07-12 09:25:48 热度:37.1℃ 作者:网络
新年初始, FDA 批准了礼来的Jaypirca™(吡妥布替尼Pirtobrutinib,100 mg 和50 mg 片剂),用于治疗复发或难治性套细胞淋巴瘤(MCL) 成年患者,这些患者此前接受了至少两线全身治疗(包括布鲁顿氏酪氨酸激酶 (BTK) 抑制剂)。Jaypirca™通过FDA的加速批准途径获得批准,对该适应症的持续批准可能取决于验证性试验的结果。
Pirtobrutinib是第三代BTK抑制剂,也是第一款非共价型BTK抑制剂首创新药。这可以实现更高的选择性,减少脱靶效应的不利影响。Pirtobrutinib因此具有治疗复发性或复发性CLL的能力。
作为第三代BTK抑制剂,Pirtobrutinib不依赖于与活性位点的Cys481结合,因此不会产生明显耐药性。得益于显著延长的半衰期,当身体合成新的BTK 时,Pirtobrutinib将留在体内并引起持续抑制。这与那些半衰期过短的共价抑制剂所导致的抑制间隙形成了明显的对比。BTK在B细胞抗原受体信号通路中起着关键作用,这一信号通路对于B细胞的发育、激活和存活至关重要。值得注意的是,BTK是在包括CLL在内的多种B细胞白血病和淋巴瘤中经过验证的重要分子靶点。Pirtobrutinib被设计用于可逆地结合BTK,从而在任何BTK酶的周转率下,都能提供持续的高靶标覆盖率,甚至在携带C481位点的获得性耐药突变的情况下,依然能保持活性。2023年1月27日,pirtobrutinib获FDA加速批准,用以治疗复发/难治性套细胞淋巴瘤(MCL)患者。这些患者经过包含BTK抑制剂在内,至少2线的系统性疗法治疗。
患有复发或难治性 B 细胞癌的患者有资格在 1-2 期 BRUIN 试验中接受 pirtobrutinib 治疗,该试验的结果之前已发表在第 22 部分中。 房颤得到控制并同时接受抗凝剂(不包括华法林)和抗血小板药物的患者 注册时允许代理。 方案中提供了完整的资格标准,可在 NEJM.org 上获取本文全文。 该方案得到了监督每个站点的机构审查委员会或独立道德委员会的批准。 该试验是按照赫尔辛基宣言、良好临床实践指南和当地法律的原则进行的。 所有患者均提供了书面知情同意书。
试验设计和治疗
该试验由申办者(礼来公司的全资子公司Loxo Oncology)和研究者共同设计。 申办者与作者合作收集、分析和解释试验数据。 该手稿由作者在赞助商资助的写作协助下撰写。 作者保证数据的完整性和准确性,并保证试验遵守方案。
这项 1-2 期试验在 10 个国家(澳大利亚、法国、意大利、日本、波兰、韩国、瑞典、瑞士、英国和美国)的 49 个地点进行。 患者在试验的 1 期部分或 2 期部分接受 pirtobrutinib 单药治疗。 在第一阶段部分,患者接受 pirtobrutinib,剂量范围为 25 至 300 mg,每天一次,周期为 28 天。 在第 2 阶段部分,患者接受每日一次 200 毫克的推荐剂量。 治疗持续直至出现疾病进展、不可接受的毒性作用或患者退出。 如果根据研究者的意见,持续的临床获益是明显的,那么疾病进展的患者可以继续治疗。
主要的终点指标是最佳总缓解率(ORR),包括部分缓解(PR)或更佳的治疗效果,上述指标根据2018年国际慢性淋巴细胞白血病研讨会(iwCLL)的标准来评估。其他终点指标包括伴有淋巴细胞增多的部分缓解(PR-L)时的ORR、无进展生存期(PFS)、总生存期(OS)、安全性,以及生物标志物的探索性分析。除OS外,所有的疗效数据都由研究者和独立评审委员会(IRC)各自进行了评估。
从2019年3月21日到2022年7月29日,共有773名B细胞癌患者参加了该试验,其中317名患有复发或难治性CLL或SLL。 总共 247 名曾接受过至少一种 BTK 抑制剂的 CLL 或 SLL 患者(216 名患者使用伊布替尼,44 名患者使用阿卡替尼,44 名患者使用扎努布替尼和奈姆他布替尼,各 7 名患者使用维卡替尼和斯佩布替尼,各 3 名患者接受替拉替尼治疗,1 名患者接受替拉替尼治疗)。
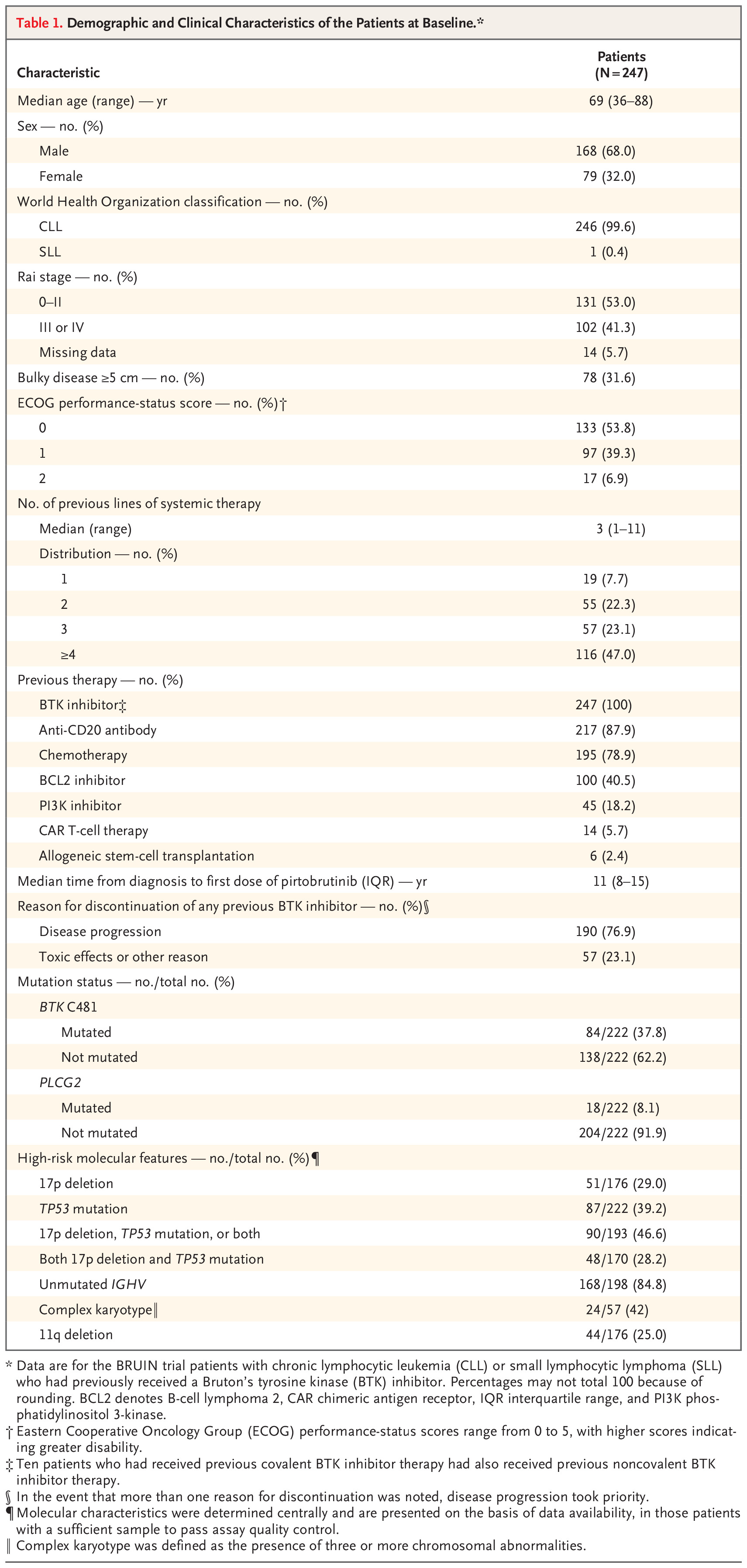
绝大多数接受 BTK 抑制剂预处理的患者接受至少一剂 pirtobrutinib(210 名患者 [85.0%]),推荐的 2 期剂量为 200 mg,每日一次。 中位年龄为 69 岁(范围为 36 至 88 岁),既往治疗次数中位为 3 次(范围为 1 至 11 次)。 除既往接受过BTK抑制剂治疗外,患者还接受过抗CD20抗体(87.9%)、化疗(78.9%)、BCL2抑制剂(40.5%)、PI3K抑制剂(18.2%)、嵌合抗原受体(CAR)治疗。 ) T 细胞疗法(5.7%)和同种异体干细胞移植(2.4%)。 大多数患者由于疾病进展而停止了先前的BTK抑制剂治疗(190例患者[76.9%]),其余患者由于毒性作用或其他原因而停止治疗(57例患者[23.1%])。 一项与接受过大量治疗的晚期疾病人群相一致的发现显示,高风险分子特征很常见,包括存在 del(17p) 或 TP53 突变或两者兼而有之(193 名患者中的 90 名 [46.6%])、复杂核型(57 例中的 24 例[42%])和未突变的 IGHV(198 例中的 168 例[84.8%])。
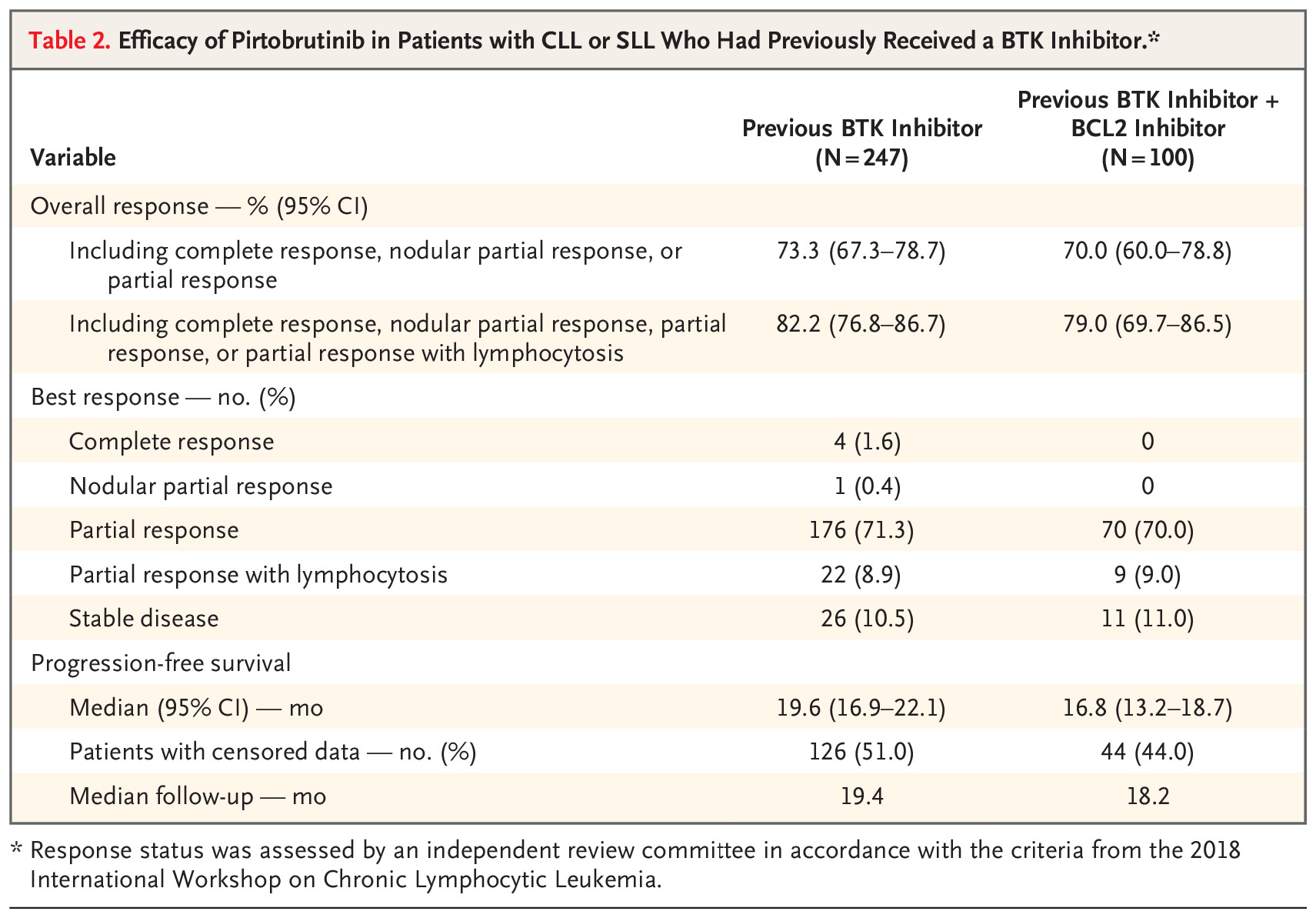
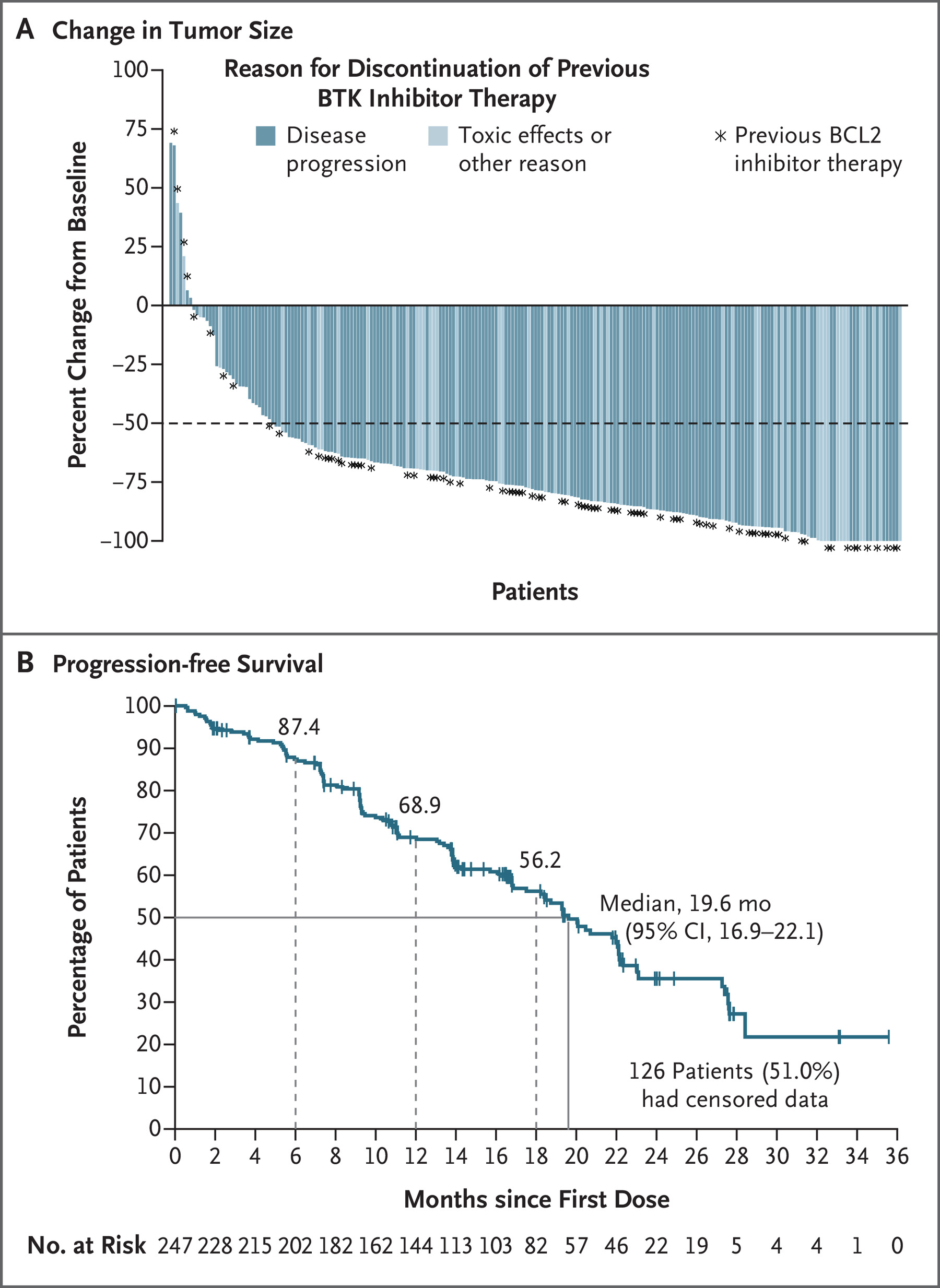
在既往接受过 BTK 抑制剂治疗的患者中,总体缓解率为 73.3%(95% 置信区间 [CI],67.3 至 78.7),其中 4 例完全缓解(1.6%),1 例结节部分缓解(0.4%) ),以及 176 份部分答复(占 71.3%)(表 2)。 当考虑淋巴细胞增多的部分缓解时,82.2% 的患者出现总体缓解(95% CI,76.8 至 86.7)。 根据患者人口统计特征、分子特征或先前额外治疗的程度定义的大多数亚组中,出现缓解(包括淋巴细胞增多的部分缓解)的患者百分比是一致的,百分比为 56%(95% CI,31 至 79) 少数患者 (18) 患有 PLCG2 突变(图 1)。 在之前同时接受过 BTK 抑制剂和 BCL2 抑制剂治疗的患者亚组中,总体缓解率为 70.0%(95% CI,60.0 至 78.8); 当包括淋巴细胞增多的部分缓解时,百分比为 79.0%(95% CI,69.7 至 86.5)。 如瀑布图所示(图 2A),无论出于何种原因停止先前的 BTK 抑制剂治疗,大多数可获得数据的患者(223 名患者中的 216 名患者 [96.9%])目标病灶的大小有所减小 并且无论之前的 BCL2 治疗如何。
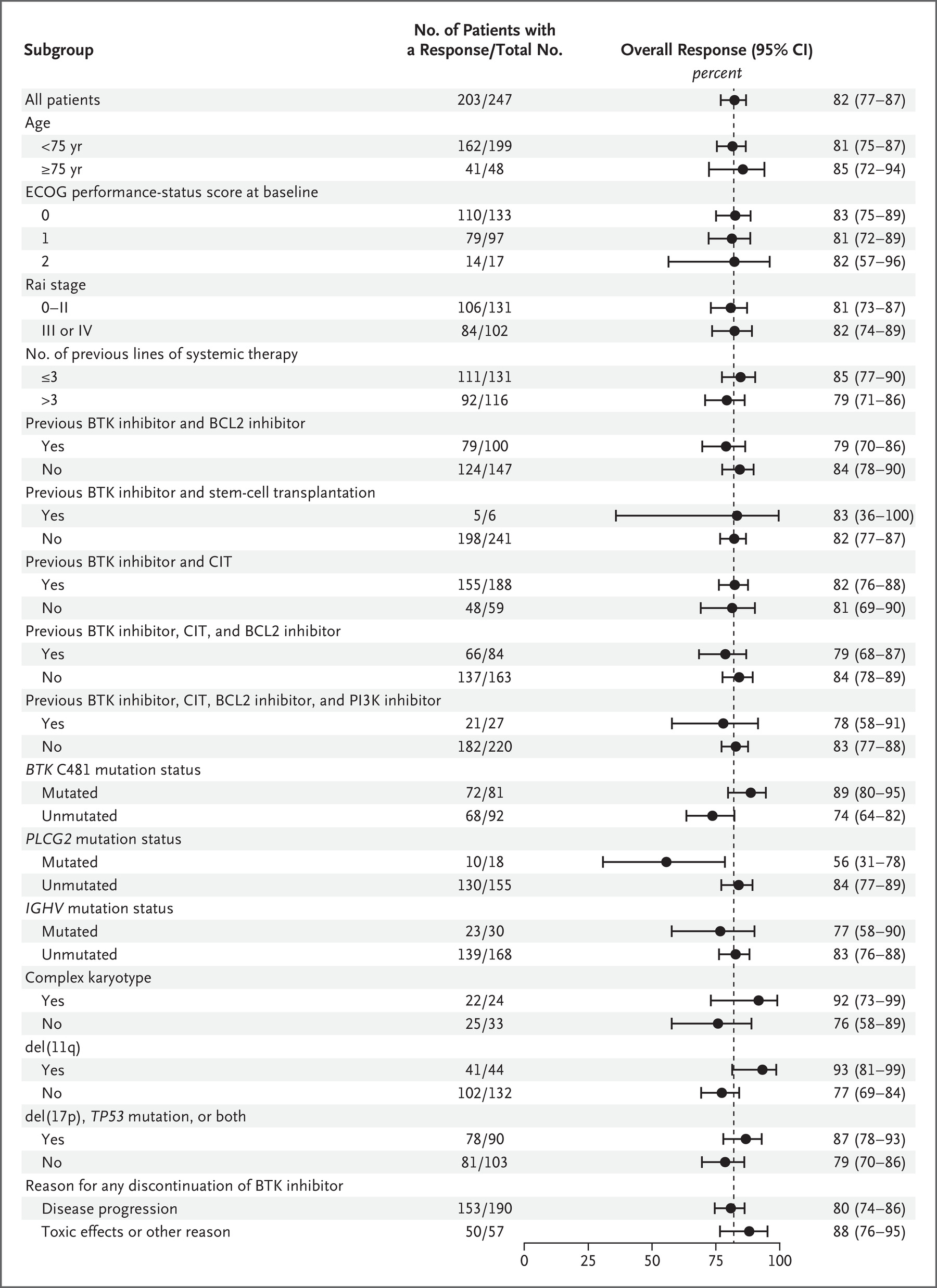
在总体疗效队列中,中位随访时间为 19.4 个月,中位无进展生存期为 19.6 个月(95% CI,16.9 至 22.1)(图 2B)。 在既往接受过 BTK 抑制剂和 BCL2 抑制剂治疗的患者亚组中,观察到中位无进展生存期为 16.8 个月(95% CI,13.2 至 18.7); 接受 BTK 抑制剂但未接受 BCL2 抑制剂的患者的中位无进展生存期为 22.1 个月(95% CI,19.6 至 27.4)(图 S2)。 在接受所有五类可用的 CLL 或 SLL 治疗(包括 BTK、BCL2 和 PI3K 抑制剂)以及化学免疫治疗(化疗和抗 CD20 抗体)的患者中,中位无进展生存期为 13.8 个月(95% CI) ,10.3 to 无法估计)(图S3A)。 无论 BTK C481 突变状态或患者年龄(<75 岁与≥75 岁)如何,都观察到类似的无进展生存期估计,估计范围为 17.5 至 20.0 个月(图 S3B 和 S3C)。 在根据是否存在高危分子特征定义的亚组中,del(17p)或TP53突变患者的中位无进展生存期估计为16.9个月,IGHV未突变患者的中位无进展生存期为18.7个月(图S3D和S3E) )。
pirtobrutinib在所有接受过至少一剂治疗的CLL/SLL患者(n=317)中显示出良好的安全性。截至数据截止日期,87.4%的患者接受过至少一剂pirtobrutinib,推荐的2期剂量为每日一次、每次200 mg,治疗时间中位数为16.5个月(范围:0.2-39.9)。安全性状况与先前报告的pirtobrutinib相关数据一致。总体而言,最常见的治疗伴发不良反应(TEAEs)是感染(71.0%)、出血(42.6%)和嗜中性白血球减少症(32.5%)。最常见的3级或以上TEAEs是感染(28.1%)和嗜中性白血球减少症(26.8%);最常报告的3级或以上治疗相关不良事件(AE)是嗜中性白血球减少症(14.8%),其他3级或以上AE如房颤(1.3%)、出血(6.9%)和高血压(3.8%)的发病率则相对较低。在CLL/SLL患者中,导致剂量减少的治疗相关AE发生率为4.7%,永久停药率为2.8%。
在这项 1-2 期试验中,非共价(可逆)BTK 抑制剂 pirtobrutinib 对接受过严格治疗的 CLL 或 SLL 患者(在之前使用共价 BTK 抑制剂治疗期间出现疾病进展)显示出疗效。 这些发现表明,无论先前的共价 BTK 抑制剂治疗是否因疾病进展、毒性作用或其他原因而停止,用 pirtobrutinib 重建 BTK 抑制都是一种潜在的治疗选择。 多项正在进行的临床试验正在评估 pirtobrutinib 治疗 B 细胞癌的效果,其中包括四项评估 pirtobrutinib 用于 CLL 或 SLL 患者的 3 期国际随机试验。
原始出处:
Pirtobrutinib after a Covalent BTK Inhibitor in Chronic Lymphocytic Leukemia,N Engl J Med 2023; 389:33-44
DOI: 10.1056/NEJMoa2300696
几种BTK抑制剂对比
表1. 上市以及部分在研BTK抑制剂药物属性