Nature Communications:浙大叶招明团队揭示化疗导致肿瘤免疫逃逸的机制
时间:2022-10-27 11:59:53 热度:37.1℃ 作者:网络
骨肉瘤(Osteosarcoma)是最常见的原发性骨恶性肿瘤。自1970年代以来,化疗显着提高了骨肉瘤患者的总体生存期。目前,手术结合新辅助化疗已经成为骨肉瘤的规范化治疗方法。顺铂、阿霉素、甲氨蝶呤和异环磷酰胺的组合化疗方案也已经使用了几十年。
尽管化疗显着提高了骨肉瘤的治疗效果,但骨肉瘤的临床预后仍不理想。约三分之一的骨肉瘤患者对化疗药物反应不佳,容易出现复发和转移,5年生存率仅为5-20%。化疗耐药和免疫逃逸已成为骨肉瘤治疗的主要挑战,因此,需要更有效的策略来提高患者的生存期。
2022年10月23日,浙江大学医学院附属第二医院叶招明教授团队在 Nature Communications 期刊发表了题为:Metabolic control of CD47 expression through LAT2-mediated amino acid uptake promotes tumor immune evasion 的研究论文。
该研究揭示了化疗诱导的巨噬细胞吞噬抑制的关键机制,化疗会诱导巨噬细胞分泌IL-18,上调肿瘤细胞的氨基酸转运体LAT2的表达,进而上调CD47表达,抑制巨噬细胞的吞噬作用,导致肿瘤细胞的免疫逃逸。
该研究还表明,抑制LAT2可以通过下调肿瘤细胞的CD47表达,增强肿瘤细胞的巨噬细胞浸润和吞噬作用,并使小鼠骨肉瘤对化疗药物阿霉素治疗敏感。
这些发现促进了我们对化疗耐药机制的理解,并强调了干预LAT2介导的氨基酸摄取具有增强癌症治疗的潜力。

癌细胞免疫逃逸的能力在癌症复发和转移中起着至关重要的作用。尽管化疗药物部分通过刺激免疫系统来清除肿瘤细胞,但越来越多的证据表明,化疗后的肿瘤对抗肿瘤免疫的抵抗力增强。
巨噬细胞是骨肉瘤中最丰富的免疫细胞类型,其密度与临床结果之间的关系仍然矛盾。对化疗前骨肉瘤标本的分析显示,巨噬细胞密度增加与转移抑制和转移无进展生存期延长有关,而对化疗后骨肉瘤标本的研究显示,与没有转移的骨肉瘤患者相比,可检测到转移的骨肉瘤患者肿瘤中有更多的巨噬细胞。这些结果表明,在骨肉瘤化疗过程中,癌细胞通过一些未知的机制加强了对巨噬细胞的免疫逃逸。
CD47,是人体中由CD47基因编码的跨膜蛋白,属于免疫球蛋白超家族。自20世纪80年代以来,CD47就被发现在多种人类血液肿瘤及膀胱癌、脑瘤等部分实体瘤中高表达。
2009年,斯坦福大学医学院 Irving Weissman 教授在 Cell 发表论文,表明肿瘤细胞高表达CD47,并通过与巨噬细胞表面的信号调节蛋白α(SIRPα)结合,释放 Don't Eat Me(别吃我)信号,从而防止肿瘤细胞被巨噬细胞吞噬。
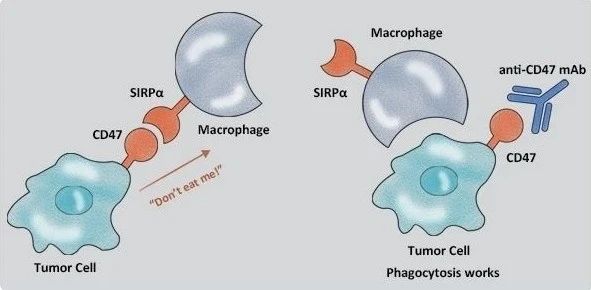
在骨肉瘤中,CD47在骨肉瘤组织中的表达水平通常高于周围正常组织,CD47的高表达与骨肉瘤患者生存率差相关。通过抑制CD47,激活肿瘤相关巨噬细胞增强了巨噬细胞介导的肿瘤细胞清除,抑制了小鼠骨肉瘤的生长和肺转移。CD47阻断剂在晚期血癌患者中也显示出很有希望的活性。目前正在设计临床试验,以评估抑制CD47是否能增强骨肉瘤患者对其他免疫疗法反应。
然而,骨肉瘤细胞中CD47的表达是否在化疗反应中受到调控,从而促进肿瘤免疫逃避,目前尚不清楚。
癌细胞需要充足的营养来维持它们的快速生长和增殖。氨基酸转运蛋白对维持癌细胞的高水平代谢和蛋白质合成至关重要。因此,在许多原发性人类肿瘤以及各种癌症细胞系中,观察到了通过上调特定转运体来增强氨基酸的吸收。
L型氨基酸转运体(LATs)是中性氨基酸(如谷氨酰胺和亮氨酸)的主要的不依赖钠离子的运输系统。到目前为止,已经发现了四种LATs(LAT1、LAT2、LAT3和LAT4),阻断LAT1已成为癌症治疗中一个有吸引力的策略。但氨基酸摄取与肿瘤免疫检查点调节之间的关系尚不清楚。
在这项研究中,研究团队发现,化疗后的骨肉瘤中CD47上调,且这种上调与患者死亡率相关。
从机制上说,化疗促进了巨噬细胞白细胞介素18(IL-18)的分泌,从而上调肿瘤细胞中LAT2的表达,进而大幅增强谷氨酰胺和亮氨酸的摄取,而它们是mTORC1的两种有效刺激因子。亮氨酸水平的增加和谷氨酰胺代谢增强激活了mTORC1和随后的c- Myc介导的CD47转录。LAT2缺失或用LAT抑制剂治疗,可下调肿瘤细胞的CD47表达,增强肿瘤细胞的巨噬细胞浸润和吞噬作用,并使小鼠骨肉瘤对化疗药物阿霉素治疗敏感。

这些发现揭示了巨噬细胞和肿瘤细胞之间的相互调节在肿瘤免疫逃逸中起着关键作用,并强调了干预LAT2介导的氨基酸摄取,具有改善癌症治疗效果的潜力。
原始出处:
Wang, Z., Li, B., Li, S. et al. Metabolic control of CD47 expression through LAT2-mediated amino acid uptake promotes tumor immune evasion. Nat Commun 13, 6308 (2022). https://doi.org/10.1038/s41467-022-34064-4.


