Brain:星形胶质细胞来源的APOE4可诱发血脑屏障损伤
时间:2022-01-30 18:19:16 热度:37.1℃ 作者:网络
载脂蛋白E(ApoE)是由星形胶质细胞和小胶质细胞在中枢神经系统合成的多面性分泌因子。APOE已被证明影响血脑屏障的完整性,在人类中,该基因的APOE4等位基因被报道会导致血脑屏障的渗漏。近日,《Brain》期刊上发表了题为 “APOE4 derived from astrocytes leads to blood–brain barrier impairment”的文章,该项研究使用APOE等位基因特异性敲入小鼠及纵向多光子活体显微镜,直接监测各种ApoE亚型对血脑屏障完整性的影响,进而研究清除星形胶质细胞产生的APOE是否会对BBB(血脑屏障)的完整性产生影响。这项工作显示了ApoE4在血脑屏障功能障碍中的细胞特异性功能增益效应,并指出星形胶质细胞产生的ApoE4可能是作为星形胶质细胞末端足与血管相互作用的功能枢纽,是血脑屏障完整性的关键调节因子。

与APOE3和APOE2相比,APOE4动物的血脑屏障被破坏
为了评估不同的APOE等位基因对血脑屏障完整性的影响,我们使用纵向体内多光子显微镜观察人源化的APOE floxed敲入(APOE4, APOE3, APOE2,作为一组称为APOE-KI)动物。对装有颅窗的小鼠静脉注射40kDa荧光素标记的右旋糖苷,在APOE3小鼠中,右旋糖苷不会被动穿过血脑屏障达到可测量的水平,如我们和其他组所示。在注射右旋糖酐染料3分钟内,每只小鼠取两个z层(508m x 508m x 120m) 作为基线,然后每10分钟对这些相同区域成像,持续30分钟,以评估随时间的渗漏情况。在每个时间点的图像中,在相同区域的脑实质毛细血管附近(直径<10mm)绘制和测量ROI,每个时间点的荧光强度以荧光强度增加的百分比与基线图像进行比较。每个区域6个毛细血管的强度和宽度也被测量(补充图1 B,C),并且正如预期,两组间的毛细血管宽度和腔内强度的变化没有差异(补充图1D)。在APOE4小鼠中观察到40kda荧光素标记的右旋糖酐外溢出增加,但在APOE3或APOE2小鼠中没有(图1 A, B)。在30分钟的成像中,我们检测到脑实质中葡聚糖的累进积累(补充图1E)。基质金属肽酶9 (MMP9)已被证明是APOE依赖性血脑屏障缺失的重要媒介,因此通过qPCR检测APOE-KI动物的Mmp9转录水平。与以前的研究一致,我们发现与APOE3或APOE2动物相比,APOE4小鼠脑中的Mmp9转录物有显著增加(约30%)(图1C)。正如预期,当作者通过蛋白印迹定量测定MMP9蛋白时,与APOE2小鼠和APOE3小鼠相比,APOE4的MMP9蛋白绝对增加(图1D)。Western blot分析显示,与APOE2和APOE3小鼠相比,APOE4小鼠的ApoE蛋白减少了约15%。相反,在5种不同的APOE-KI动物中APOE mRNA的含量没有差异,这表明APOE4蛋白可能比该蛋白的其他异构体降解得更快,这与先前的研究表明apoE4的周转速度更快是一致的。

图1. 与ApoE3-TR和ApoE2-TR小鼠相比,ApoE4-TR小鼠的血脑屏障受损
选择性敲除ALDH1L1阳性星形胶质细胞的APOE4可挽救BBB的完整性,但APOE敲除小鼠也显示出BBB的缺陷
APOE4-KI小鼠存在血脑屏障完整性缺陷。作者认为这可能是由于与ApoE2或ApoE3相比,ApoE4功能的增加或功能的丧失。为了评估这些可能性,作者首先评估了APOE KO小鼠,发现它们也出现了血脑屏障渗漏(补充图2A,B)。这与APOE4小鼠功能的丧失是一致的。作者测定了APOE KO小鼠MMP9mRNA和蛋白的含量(补充图2C,D),发现虽然与APOE3小鼠相比,MMP9蛋白的表达增加了,但mRNA水平并没有增加,这表明APOE KO和APOE4小鼠MMP9蛋白的这种增加可能是由于两种不同的机制。此外,APOE KO小鼠在整个发育过程中无论是在中枢神经系统还是在外周都缺乏ApoE,因此其潜在的分子水平可能是由两种不同的机制引起的。为了进一步探讨APOE4是否导致血脑屏障完整性的功能增强或功能丧失的问题,作者团队直接测试了成熟中枢神经系统星形胶质细胞中APOE4的抑制是否增加、减轻或不影响血脑屏障的渗漏。作者预计,如果APOE4功能效应丧失,表达抑制不会改善,甚至可能使BBB缺陷恶化。相反,如果抑制星形胶质细胞中的APOE4可以挽救血脑屏障缺陷,则功能机制的增益将得到支持。 在本研究中使用的小鼠模型允许ApoE的细胞类型特异性诱导敲除。他莫昔芬诱导ALDH1L1阳性星形胶质细胞表达重组酶Cre,导致ApoE的2-4号外显子被切除,并抑制ApoE在ALDH1L1阳性星形胶质细胞中的表达。这导致了一个DNA片段的产生,该片段只有在flox位点重组后才会被PCR检测到(图2A),并导致中枢神经系统APOE mRNA水平在qPCR中减少40%,在注射他莫昔芬后1个月和2个月,ApoE蛋白水平在Western blot中减少约50%,尽管在1周时没有减少(图2B、D、E)。RNAscope显示,这些小鼠大脑皮层中GFAP阳性的星形胶质细胞不再含有APOE mRNA(图2C)。在血浆中也检测到APOE蛋白的轻微减少,这可能是星形胶质细胞ApoE基因敲除影响外周水平的结果,也可能由于肝脏中少数细胞同时表达ALDH1L1和APOE,导致肝脏中产生APOE的轻微减少(图2D)。从星形胶质细胞中剔除APOE的APOE4和APO3动物分别被称为APOE aKO和APOE3 aKO。 APOE4/ALDH1L1-Cre小鼠和APOE3/ALDH1L1-Cre小鼠在注射他莫昔芬前1个月以及注射他莫昔芬后1周、1个月和2个月用双光子显微镜进行成像,以了解星形细胞APOE基因敲除(APOE3 aKO或APOE4 aKO)对血脑屏障完整性的影响(图3A)。作者发现,在APOE4 aKO小鼠中,在注射他莫昔芬前和注射后1周,血脑屏障对40 kDa右旋糖酐具有通透性,但在注射他莫昔芬后1个月,这种通透性降低,右旋糖酐从血管中渗出的情况与APOE3小鼠相似(图3B,C,E)。未从星形胶质细胞中剔除APOE4的小鼠在12个月时仍然对葡聚糖具有渗透性(图3D)。APOE3/ALDH1L1-CRE小鼠也进行了同样的处理,星形胶质细胞的ApoE3基因敲除对血脑屏障通透性没有影响(图3D)。后者的结果表明,在APOE KO动物中观察到的BBB完整性受损并不直接依赖于该小鼠品系中星形胶质细胞产生ApoE 的缺失,这突显了APOE相关机制影响BBB的潜在复杂性。
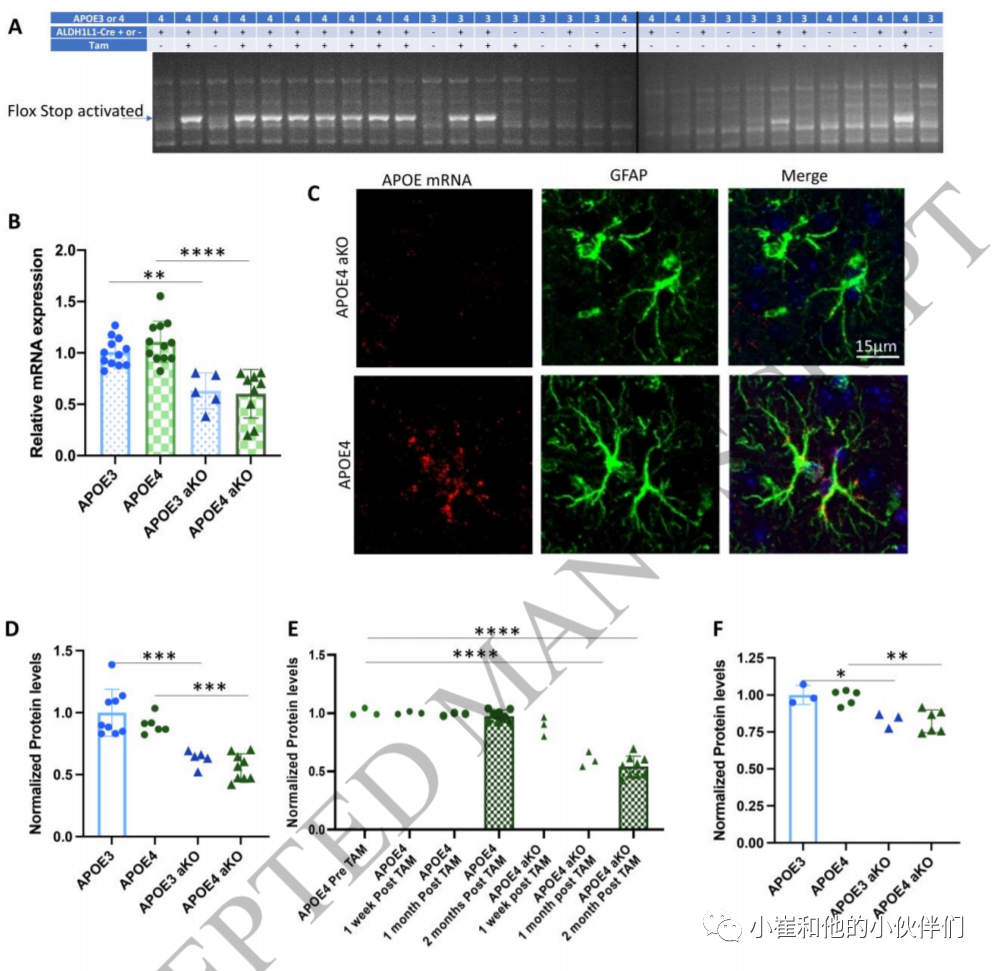
图2.他莫昔芬注射液特异性诱导星形胶质细胞持续敲除APOE

图3.星形胶质细胞特异性APOE4基因敲除挽救血脑屏障损伤
星形胶质细胞产生APOE4导致MMP9表达异常和紧密连接功能障碍
小分子血脑屏障通透性的增加可能表明有结构缺陷的元素,如紧密连接。因此,作者在注射他莫西芬后2个月的APOE3、APOE4、APOE3 aKO和APOE4 aKO小鼠的皮层切片上,通过透射电镜对紧密连接的完整性进行了评估(图4A)。紧密连接中膜的小牵拉部分已被证明是紧密连接功能障碍的标志(图4A)。因此,作者测量了每只小鼠4-10条血管中紧密连接的膜之间的距离以及内腔周围内皮的宽度。选择直径约为5-8μm 的血管,并以垂直于表面的横截面观察。对每只动物大脑皮层中发现的前10条血管进行了成像和分析,尽管并非所有血管都有可见的紧密连接。如果膜之间的距离太近,以至于无法测量,则将紧密连接膜之间的距离记录为0。与APOE3动物相比,作者发现APOE4小鼠的紧密连接膜之间的距离显著增加(图4B)。这似乎主要是由一些紧密连接的异常开放驱动的,而其他连接保持完整(图4C)。APOE4 aKO小鼠没有显示紧密连接膜之间的这种异常开放,其结果与APOE3小鼠相似。作者观察到小鼠品系之间的内皮层厚度没有差异(图4D)。
在其他模型中已经提出,MMP9和CYPA介导ApoE4驱动的血脑屏障功能障碍,并且MMP9水平的增加与紧密连接障碍相关。有趣的是,APOE4 aKO动物的Mmp9基因和蛋白质含量下降到APOE3动物的水平。此外,在APOE4动物而不是APOE3动物中,Mmp9转录物水平的增加与APOE转录物水平的增加呈正相关(图4F)。在蛋白质水平上,在APOE4动物中增加的MMP9蛋白质水平在APOE4 aKO动物中也降低(图4G),再次表明了MMP9蛋白质的量显示与APOE4表达正相关(图4H)。尽管在APOE3 aKO动物中MMP9蛋白没有显著增加,但是在MMP9蛋白量和APOE3蛋白量之间似乎存在负相关(图4G,H),进一步表明APOE蛋白同种型和MMP9之间存在复杂的关系。
为了开始研究MMP9和ApoE水平差异的细胞来源,作者分离了每组3只小鼠的血管,并对这些样本以及从整个前脑中提取的RNA进行qPCR检测。作者在血管标本中看到了Pecam水平的显著富集,这表明内皮细胞的富集主要存在于中枢神经系统的血管中(补充图4A)。作者还在APOE看到了约3倍的富集和约10倍的Mmp9在血管标本中的富集,表明中枢神经系统中的绝大多数Mmp9是由血管单位产生的,并且血管单位对于产生ApoE的细胞是富集的(补充图4B,C)。为了进行富集分析,将qPCR标准化为全脑APOE3水平的平均值。
为了了解ApoE星形胶质细胞敲除对血管内转录的影响,作者团队将血管预处理的qPCR归一到APOE3血管的水平。作者发现APOE aKO动物中APOE基因的数量减少了30-40%。由于血管提取物已经显示含有星形胶质细胞,这并不奇怪。进而观察出一个趋势(p=0.0588),即与APOE3动物相比,APOE4动物的APOE mRNA数量增加,而在从全脑提取的mRNA中并没有看到这种情况(补充图4D)。作者还发现与APOE3动物相比,APOE4动物血管中产生的MMP9的量增加了一倍,而在APOE4 aKO动物中,这一数量减少到APOE3动物的水平。作者进行了简单的线性回归,以确保这种增加不是更好的血管隔离的结果,并发现Pecam和Mmp9之间没有相关性(补充图4F)。
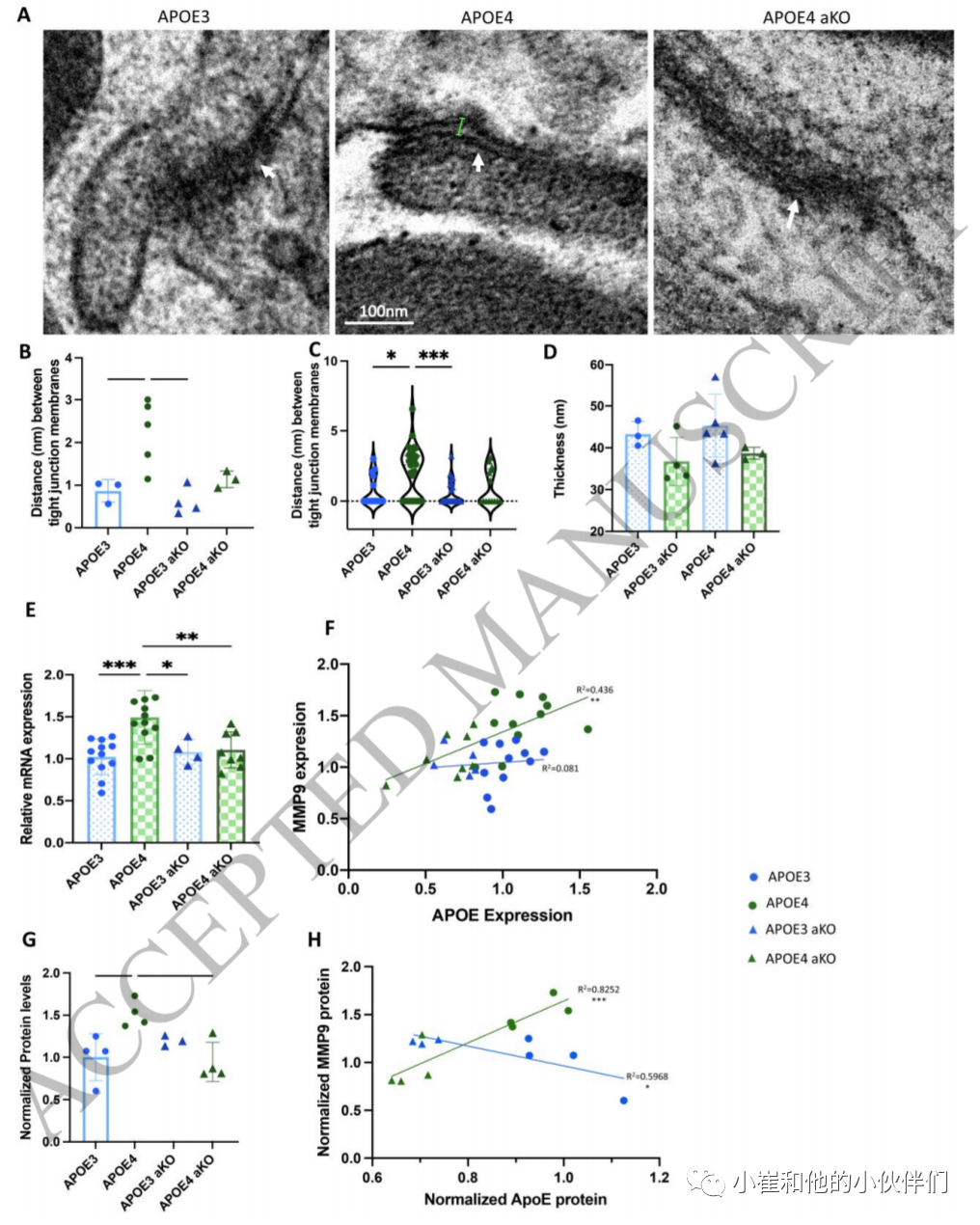
图4.ApoE4小鼠紧密连接受损,同时MMP9表达受损
星形胶质细胞产生的ApoE4导致血管的星形胶质细胞端足保护减少
星形胶质细胞的末端被认为对血脑屏障的形成和维持至关重要,部分是因为许多分泌因子已被证明通过内皮细胞或紧密连接调节屏障功能,但也是因为它们在神经元和血管之间形成连接。使用电镜观察了每只小鼠的10条毛细血管,并比较了血管周围的末端足面积,通过在内皮细胞层外侧画出感兴趣区域来测量血管外周长。在图像评分过程中,检查者并不知道小鼠的基因型。我们没有排除可见内皮细胞体的血管,但排除了与框架平行而不是垂直的血管(定义为有一个直径超过其他直径的两倍)。测量血管周围的端足面积显示,在APOE4动物中,端足面积减少,而在APOE4 aKO动物中则恢复到APOE3动物的水平(图5A)。在血管周长方面,各组之间没有差异(图5C)。
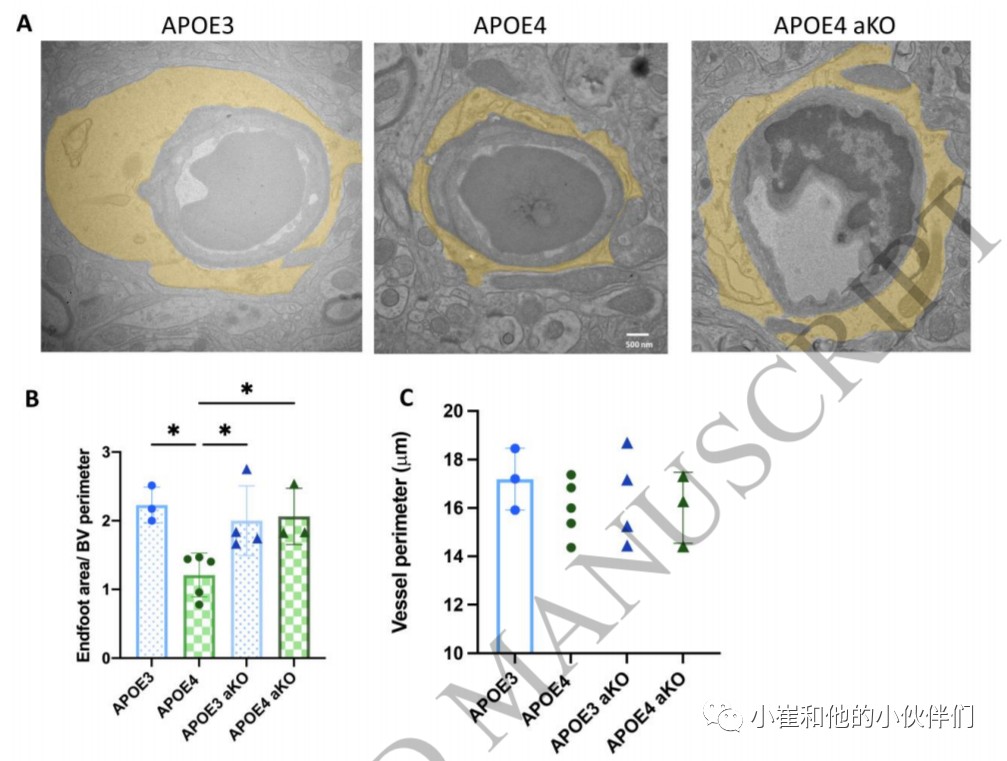
图5.APOE4小鼠星形胶质细胞终足受损
讨论
研究细胞特异性产生的APOE对BBB的影响对于我们了解这种载脂蛋白在维持大脑平衡方面的潜在功能非常重要。文章表明,人源化APOE4小鼠的BBB通透性增加,而且这种渗漏早在星形胶质细胞中的APOE4被敲除后的一个月时就可被挽救。此外,作者报告了APOE4小鼠存在紧密连接中断,MMP9表达异常增加,星形细胞末端足部血管覆盖率降低。这些表型通过敲除星形细胞中的APOE4而得到。目前的数据集首次显示了功能增益机制的影响,通过该机制,星形细胞产生的APOE4似乎对血脑屏障产生负面影响,并导致血浆成分渗透到大脑中。这对于理解阿尔茨海默病背景下ApoE4相关的血管功能障碍可能特别重要,例如ApoE4与淀粉样蛋白相关成像异常的相关风险。有趣的是,虽然目前的实验清楚地显示了通过减少星形胶质细胞产生的ApoE4在结构和功能水平上拯救BBB表型,但也显示了(并在这些实验(补充图2A,B)中得到证实,从出生起就完全敲除APOE会导致BBB泄漏的功能和生化表型。这些结果提示ApoE蛋白的存在或缺失通过多种机制影响血脑屏障的完整性。 星形胶质细胞来源的ApoE4对血脑屏障功能障碍的这种作用可能不依赖于LRP1,而导致MMP9通过不同的途径激活。有趣的是,当在蛋白质水平上观察到ApoE4和MMP9呈正相关时,也观察到ApoE3和MMP9蛋白呈负相关(图4H)。这与在APOE KO动物中看到的效果相似,在APOE KO动物中,mRNA水平与APOE3动物没有什么不同(补充图2C,D),但与APOE3动物相比,MMP9蛋白水平升高。这突出了ApoE对MMP9稳态水平和推测的BBB下游功能障碍的多种作用机制的可能性。当然也有可能,如果让这些动物放置更长时间,血脑屏障功能障碍就会开始由一种类似于APOE KO动物的不同机制驱动。 基于这些数据和其他研究小组的工作,作者认为ApoE4导致MMP9的增加,从而导致紧密连接蛋白的降解,并推测,MMP9活性的增加导致了这些结构的整体不稳定。在没有星形细胞ApoE4的情况下,MMP9水平恢复正常,紧密连接的完整性得以恢复,防止血脑屏障渗漏。APOE KO小鼠也表现出MMP9蛋白和BBB渗漏的增加。这表明ApoE的完全丧失具有负面后果,并提示非星形胶质细胞来源的ApoE对BBB的维持至关重要。总之,这支持了以星形胶质细胞为靶点的治疗策略,或者将ApoE4转化为ApoE3或ApoeE2可能比降低总体ApoE水平更有效。当然,星形细胞ApoE4对血脑屏障漏出的影响并不完全是由于对紧密连接的影响,也可能是通过细胞转运的改变而发生的,这是最近发现的跨越血脑屏障的一种重要的瞬间机制。小结
该研究与通过星形细胞产生的ApoE4对血脑屏障功能产生不利影响的假设是一致的。该研究有力地证明了ApoE的特定来源对其功能是至关重要的,这表明至少对于星形胶质细胞产生的ApoE来说,降低ApoE4携带者的血脑屏障完整性可能是有益的。原始出处:
Jackson RJ, Meltzer JC, Nguyen H, Commins C, Bennett RE, Hudry E, Hyman BT. APOE4 derived from astrocytes leads to blood-brain barrier impairment. Brain. 2021 Dec 27:awab478.
编 译 / 张 宇
校 审 / 李胜男


