如何重塑肿瘤微环境,强化抗PD-1疗效?Treg细胞的Blimp1表达是关键!
时间:2021-12-26 06:01:41 热度:37.1℃ 作者:网络
调节性T细胞(Regulatory Tcell, Treg)对维持自身免疫稳态、形成免疫耐受至关重要,但也是肿瘤抑制性微环境形成的重要原因。Treg细胞表达特异性转录因子Foxp3,因此常用Foxp3+Treg来表示。已有报道表明,肿瘤浸润性淋巴细胞(TIL)中Foxp3+ Treg细胞的出现频率常与各种类型癌症患者的不良预后有关。在Foxp3+Treg中,发挥免疫抑制效应的细胞亚群(effector Treg,eTreg)能表达特异性转录因子Blimp1,该分子已被证实对于维持Foxp3+Treg的免疫抑制功能与遗传稳定性必不可少。
另外,负责维持正常体液免疫稳态的主要是滤泡调节性T细胞(follicular regulatory T cells, TFR)。TFR主要来源于Treg的分化,能够负向调控体液免疫的中心轴“TFR-B细胞-抗体”,防止抗体介导的自身免疫性疾病发生。与之功能相反的则是滤泡辅助性T细胞(follicular helpful T cells, TFH),能够促进B细胞产生抗体。已有文献报道Blimp1分子的表达是TFR负向调控TFR、B细胞及生发中心(GC)抗体反应的必要条件。然而,Blimp1+eTreg以及其分化而来的TFR对于肿瘤发生发展的作用及机制尚不清楚。
近日,阿拉巴马大学伯明翰分校的科学家在Molecular Cancer发表题为“Remodeling ofthe tumor microenvironment via disrupting Blimp1+ effector Treg activity augmentsresponse to anti-PD-1 blockade”的最新研究成果。该研究揭示了Blimp1是一种肿瘤浸润性Treg细胞新的关键调控因子,以及通过调节Treg活性来治疗肿瘤的潜力。

Blimp1+eTreg和TFR在肿瘤组织中大量浸润
该团队首先比较了荷瘤小鼠的肿瘤组织与脾脏组织中TIL的eTreg比例,发现肿瘤中高达80%的TIL为eTreg,而在脾脏中这一比例仅为35%。进一步分析其Blimp1的表达情况,发现肿瘤中的Blimp1+eTreg占该亚群的50%,而脾脏中表达Blimp1的eTreg不足5%。其他表征eTreg免疫抑制功能的分子标志物如Foxp3/GITR/Helios/CTLA-4,均显示出类似的差异化表达。RNA测序分析显示TIL eTreg具有不同于脾脏eTreg的转录特征。这些数据表明eTreg能够适应肿瘤微环境,并且展现出更为活跃、强劲的免疫抑制能力。
研究人员同时对生发中心的 TFR、TFH和B细胞(GCB)比例进行分析,发现TFR:TFH比值和TFR:GCB比值均比脾脏中相应数值高2-3倍,提示肿瘤免疫抑制作用可能包括对TFH-B细胞介导的体液免疫的抑制。
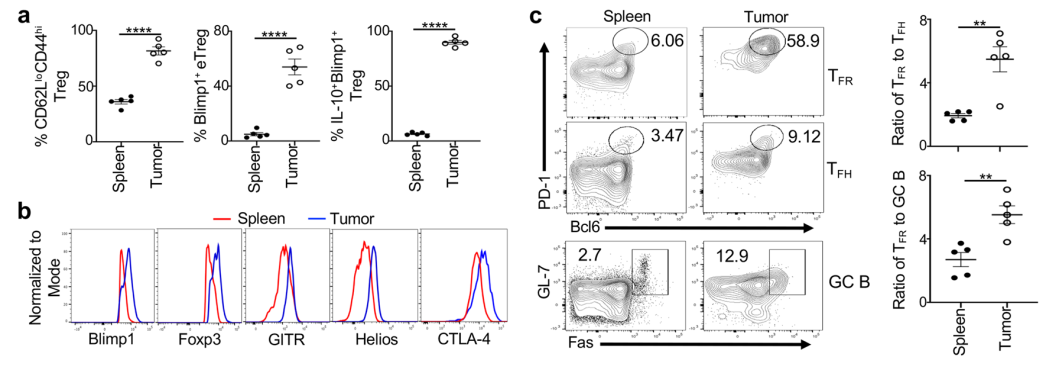
(肿瘤组织中Blimp1+ eTreg和TFR比例更高)
从黑色素瘤患者分离出的TIL Treg和TFR表达的Blimp1更高、免疫抑制能力更强
对黑色素瘤患者的多种转移灶组织及对照的临近正常组织的分析,包括Blimp1和其他表征eTreg免疫抑制功能的分子标志物的表达情况、TFR、TFH和B细胞的比例等,得到了与上述一致的结果。TGCA数据库中的分析显示出PRDM1(表达Blimp1的基因)mRNA水平与FOXP3表达正相关。并且在FOXP3高表达的人群中,PRDM1还与合成CD15的酶表达水平正相关,后者往往标志着eTreg细胞具有极强的免疫抑制能力。此外,PRDM1高表达的黑色素瘤患者出现转移的比例更大。
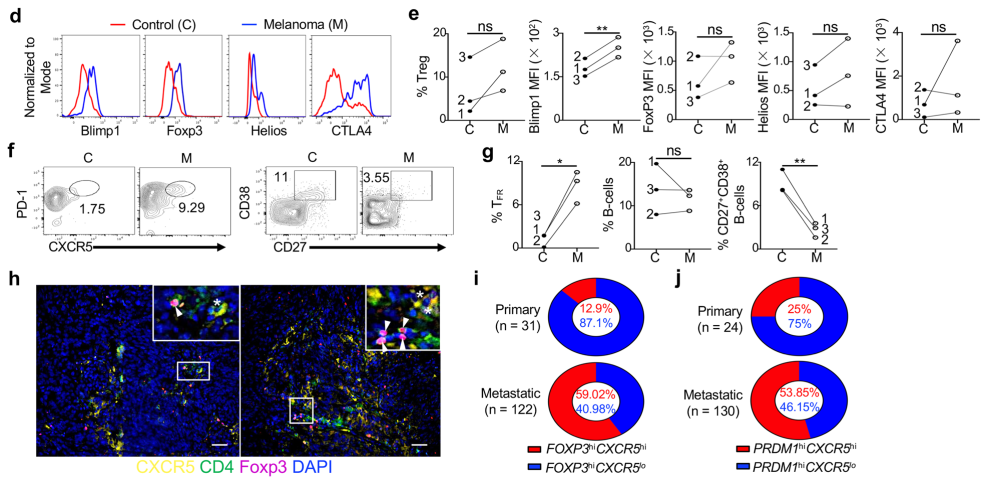
(黑色素瘤Blimp1+ eTreg和TFR集聚且PRDM1高表达的黑色素瘤患者更多出现转移)
特异性敲除Foxp3+eTreg和TFR中的Blimp1可以实现延缓肿瘤生长、增强抑制肿瘤效应
基于以上观察性的证据,该研究团队试图进一步验证Foxp3+eTreg和TFR中的Blimp1表达是否能够调控肿瘤免疫反应。结果显示,敲除PRDM1的转基因小鼠比野生型小鼠的肿瘤生长速度更慢。免疫图谱分析也显示,在敲除该基因后,适应性免疫细胞(CD8+ T细胞和 NK 细胞等)和固有免疫细胞(树突状细胞DC和MHCII+ M1类巨噬细胞等)数量更多、活化程度更高,即抗肿瘤免疫反应得到增强。体外实验也表明,TIL Blimp1缺陷的Treg分化为eTreg后,其免疫抑制能力被削弱。
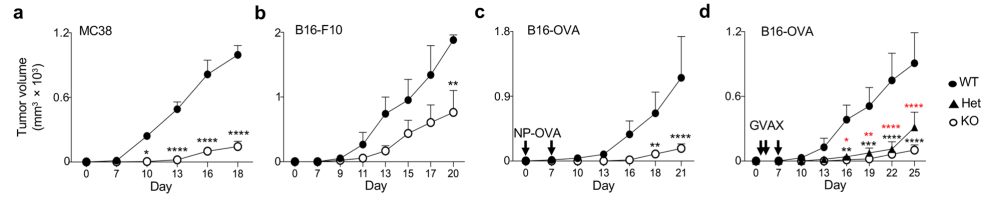
(Blimp1缺陷的荷瘤小鼠肿瘤生长速度放缓)
特异性敲除Foxp3+Treg中的Blimp1导致抗肿瘤体液免疫增强
与前述观察到的体液免疫增强的现象类似,在特异性敲除Foxp3+Treg中的Blimp1的荷瘤小鼠中,TFH和B细胞(GCB)的比例更多,肿瘤特异的IgE滴度更高,CD3和B220+细胞大量集聚,表示细胞免疫和体液免疫均得到增强。
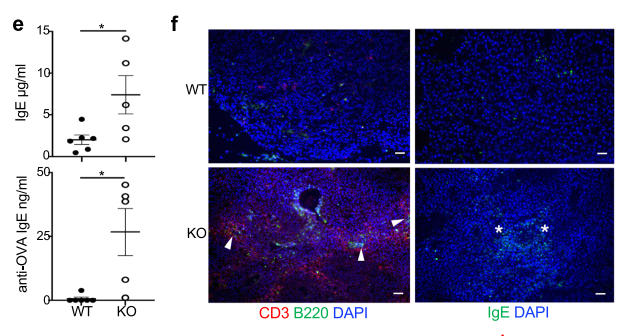
(特异性敲除Foxp3+ Treg中的Blimp1导致抗肿瘤体液免疫增强)
回输Blimp1缺陷的TFH,或特异性敲除Foxp3+ Treg中的Blimp1的荷瘤小鼠的血浆,均能发挥抑制肿瘤的作用
为了探索敲除Blimp1治疗潜力,研究人员将Blimp1缺陷的TFH基因工程小鼠,发现与对照组相比,实验组的肿瘤生长速度显著放缓,并且肿瘤特异性的抗体水平也显著增加。该研究还发现,这些含高水平(约为对照组的4.5倍)的肿瘤特异性IgE抗体的血浆可以激活巨噬细胞,增加巨噬细胞介导的吞噬和杀死肿瘤细胞,从而延缓肿瘤生长。
Blimp1缺陷Treg表达谱发生变化,重塑肿瘤微环境
利用RNA测序技术,该团队分析了Blimp1缺陷Treg差异表达的基因,发现反应Treg细胞稳定性和免疫抑制能力的基因下调,而与自然杀伤细胞(NK)的细胞毒性程序相关的基因上调,其中包括转录因子Exoms。删除Blimp1缺陷Treg中的Exomes,发现肿瘤生长速度加快,一定程度抵消了Blimp1缺陷的肿瘤抑制效应,表明Blimp1可能部分是通过Exome1起作用。对于肿瘤微环境的分析结果则显示,Blimp1缺陷引起CD45-细胞I型干扰素分泌相关基因下调,血管生成相关基因、MHCI 和MHCII 分子、抗原提呈相关通路基因上调,这些均表明TIL抗肿瘤免疫细胞活性增强、肿瘤自身免疫原性增加。

(Blimp1缺陷Treg细胞显示出不同的转录组谱)
基于以上证据,研究人员尝试比较在Blimp1缺失和野生型状态下免疫检查点阻断疗法的差异。令人惊喜的是, anti-PD-1显著降低了Blimp1缺陷小鼠的肿瘤生长,而对野生小鼠的肿瘤控制没有显著改善。
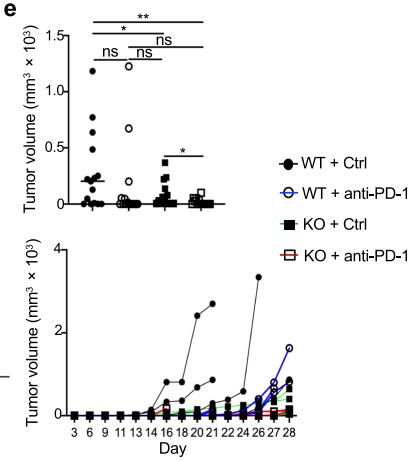
(Treg细胞中Blimp1的缺失重塑了TME肿瘤对抗PD -1治疗敏感)
尽管人们很早就尝试通过清除或抑制体内的Treg细胞来增强抗肿瘤反应,但该疗法往往受阻于严重的自身免疫性副作用。本研究发现TILBlimp1-deficient Treg细胞的独特转录特征及其对肿瘤微环境的重塑,可以显著增强抗肿瘤免疫反应,且不引起自身免疫性疾病,这对于开发有效的、较少不良反应的肿瘤免疫疗法带来了希望。该成果也为如何通过控制Treg活性用于肿瘤治疗以及如何设计联合免疫检查点阻断疗法提供了一个新的方向。


