Clin Cancer Res:TIGIT抗体Etigilimab±纳武单抗治疗晚期实体瘤
时间:2021-12-06 06:01:26 热度:37.1℃ 作者:网络
TIGIT是一种T细胞和自然杀伤细胞活性的共抑制受体。靶向TIGIT加上或不加上PD-1/PD-L1检查点抑制或均可强化抗肿瘤免疫。
这是一项首次在人体中开展的开放标签、多中心、剂量递增和扩展的1a/b期临床试验,招募了局部晚期或转移性实体瘤患者。采用3+3设计,受试患者接受周期为14天的治疗疗程:抗TIGIT抗体Etigilimab单药治疗(1a期:0.3、1.0、3.0、10.0、20.0 mg/kg)或联合抗PD-1抗体纳武单抗(1b期:3.0、10.0、20.0 mg/kg Etigilimab和240 mg 纳武单抗)。主要终点是安全性和耐受性。
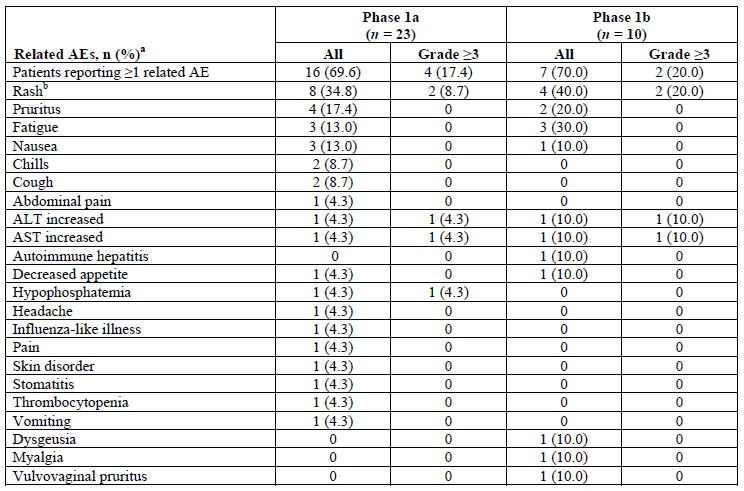
治疗相关副反应
共招募了33位患者(1a期 23位,1b期 10位)。无剂量限制性毒性。Etigilimab单用和联合使用时的最大耐受剂量(MTD)均未明确;最大使用剂量是 20 mg/kg。1a期最常报告的副反应(AE)有红疹(43.5%)、恶心(34.8%)和疲劳(30.4%);1b期最常见的AE有胃口减退(50.0%)、恶心(50.0%)和红疹(40%)。6位患者经历了≥3级的治疗相关的AE。
不同肿瘤的治疗反应
在1a期,7位患者(30.0%)的病情稳定。在1b期,1位患者获得了部分缓解;1位患者的病情稳定长达8个月。1a期和1b期的中期无进展生存期分别是56.0天和57.5天。
生物标志物相关分析显示,Etigilimab单抗具有明显的剂量依赖性靶向作用。
总而言之,Etigilimab具有可接受的安全性,初步证据表明单用和与纳武单抗联合使用均具有临床效益,值得在临床试验中进一步研究。
原始出处:
Niharika B. Mettu, Susanna V. Ulahannan, et al. A Phase 1a/b Open?Label, Dose?Escalation Study of Etigilimab Alone or in Combination with Nivolumab in Patients with Locally Advanced or Metastatic Solid Tumors. Clin Cancer Res November 29 2021 DOI:10.1158/1078-0432.CCR-21-2780