Cell Discovery:CD36+癌相关成纤维细胞通过分泌巨噬细胞迁移抑制因子为肝细胞癌提供免疫抑制微环境
时间:2023-03-10 20:52:39 热度:37.1℃ 作者:网络
肝细胞癌(HCC)是一种具有高度细胞异质性的免疫治疗耐药恶性肿瘤。细胞类型的多样性以及肿瘤细胞与非肿瘤细胞之间的相互作用仍有待阐明。
2023年3月6日,复旦大学史颖弘、樊嘉及刘卫仁共同通讯在Cell Discovery(IF=38)在线发表题为“CD36+ cancer-associated fibroblasts provide immunosuppressive microenvironment for hepatocellular carcinoma via secretion of macrophage migration inhibitory factor”的研究论文,该研究表明CD36+癌相关成纤维细胞通过分泌巨噬细胞迁移抑制因子为肝细胞癌提供免疫抑制微环境。人类和小鼠HCC肿瘤的单细胞RNA测序显示癌症相关成纤维细胞(CAF)的异质性。跨种分析发现CD36+ CAFs表现出高水平的脂质代谢和巨噬细胞迁移抑制因子(MIF)表达。
谱系追踪分析显示CD36+CAFs来源于肝星状细胞。此外,CD36在CD36+ CAFs中通过脂质过氧化/p38/CEBPs轴介导氧化性LDL摄取依赖的MIF表达,CD36+ CAFs以MIF和CD74依赖的方式募集CD33+髓源性抑制细胞(MDSCs)。CD36+ CAFs与HCC细胞共植入促进HCC在体内的进展。最后,CD36抑制剂通过恢复HCC中的抗肿瘤T细胞反应与抗PD-1免疫疗法协同作用。总之,该研究强调了阐明特定CAF亚群功能在理解肿瘤微环境和免疫系统之间相互作用的重要性。

肝细胞癌(HCC)是全球癌症相关死亡的第四大原因,而慢性乙型肝炎(HBV)病毒感染是主要危险因素。手术切除后的复发率仍然很高,不可切除的HCC患者预后仍然很差,治疗方案有限。HCC的肿瘤微环境(TME)的一个显着特征是大量的癌症相关成纤维细胞(CAFs),它可以分泌多种细胞因子、趋化因子和生长因子,直接和间接地支持癌细胞。尽管这些CAF衍生因子作为癌细胞的直接生存信号,但它们也通过抑制免疫效应细胞的活性和募集免疫抑制细胞来改变免疫细胞环境,使癌细胞能够逃避免疫监测。
在以前的研究中,具有不同功能的不同CAF亚型已在人胰腺导管腺癌(PDAC)、头颈部鳞状细胞癌、乳腺癌和肺部肿瘤中广泛揭示。因此,CAFs的多面性表明它们包括不同的亚群,对基质异质性的更好理解可能解释CAFs如何促进肿瘤生态系统的动态复杂性和功能可塑性。单细胞RNA测序(scRNAseq)的最新进展已经克服了研究复杂组织(如癌变)细胞异质性的一些技术障碍。
具体而言,scRNA-seq已被应用于肝内胆管癌(ICC)中将CAFs分离为炎症(iCAF)和肌成纤维细胞(myCAF)亚群,这些亚群显示出不同的配体-受体相互作用,并通过不同的CAFs -癌细胞相互作用促进ICC 。然而,在HCC中,基质异质性,特别是CAFs,以及恶性细胞和基质细胞在单细胞分辨率下的相互作用仍然知之甚少。尽管先前的研究报道了CAFs通过各种机制调节HCC的进展,而不管肿瘤中的CAF亚型如何,目前尚不清楚HCC中是否存在不同的CAF亚群的原机制,而且CAFs与TME中其他成分之间复杂的串扰仍不清楚,特别是对于不同的CAF亚型。
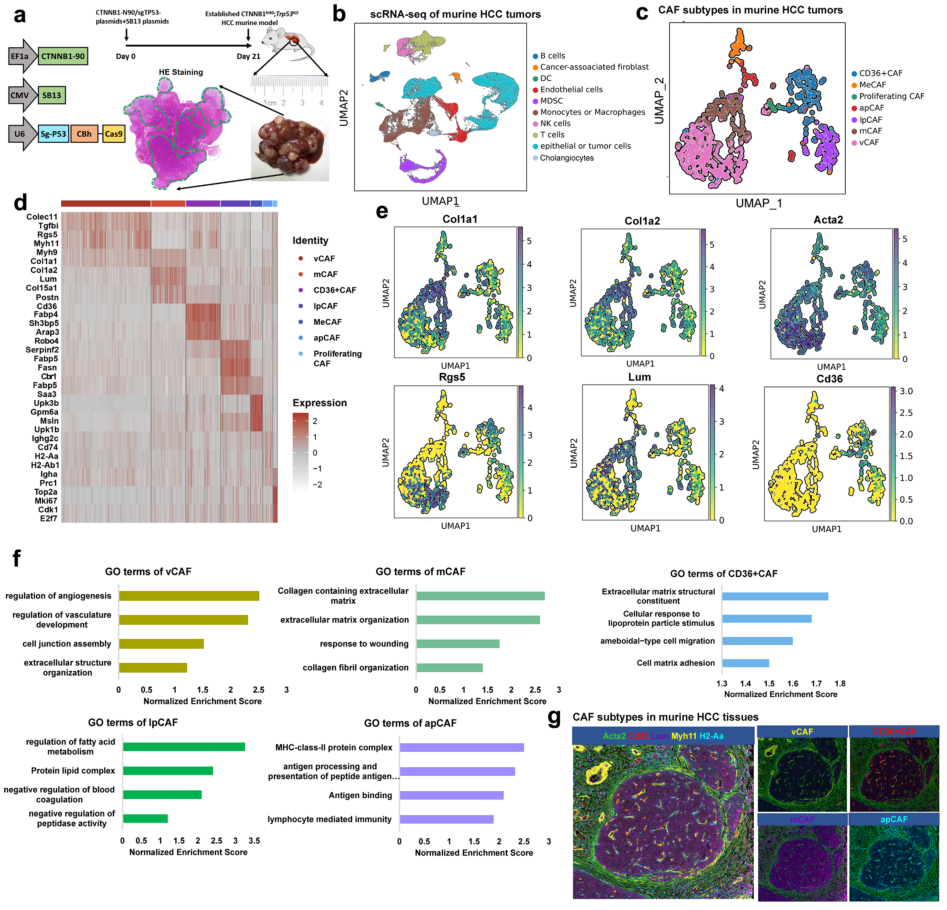
小鼠HCC组织中不同的成纤维细胞亚群(图源自Cell Discovery )
在该研究中,该研究在单细胞水平上提供了一个全面的HCC转录组景观,并确定了脂质过氧化诱导CD36+CAFs分泌的MIF调节肿瘤细胞免疫逃避的新机制。靶向CD36可有效提高免疫治疗的疗效。但仍需要进一步的研究来确定诱导不同CAF亚型形成和激活的瘤内信号,并确定其他CAF亚型在TME和肿瘤免疫中所起的作用。


