Gut:激活铁死亡,增强肝癌免疫治疗效果
时间:2023-02-27 06:18:58 热度:37.1℃ 作者:网络
多细胞生物在发育过程中,存在着多种预定的、受到精确控制的细胞程序性死亡,例如细胞凋亡(Apoptosis)、程序性坏死(Necroptosis)、细胞焦亡(Pyroptosis),以及铁死亡(Ferroptosis)等。
铁死亡是2012年由哥伦比亚大学 Brent Stockwell 实验室发现的一种铁依赖性的新型细胞程序性死亡方式,由过度堆积的过氧化脂质(peroxidized lipids)诱导发生,其形态特征,作用方式以及分子机制与其他程序性死亡方式截然不同。同时,细胞中也有多个对抗铁死亡的防御途径,其中最主要的一个是由谷胱甘肽过氧化物酶4(GPX4)所介导的,通过谷胱甘肽(GSH)特异性催化过氧化脂质来抑制铁死亡的发生。
近年来,免疫疗法已经成为对抗癌症的一有效治疗选择,尤其是以PD-1/PD-L1为代表的免疫检查点的发现及免疫检查点抑制剂为代表的癌症免疫疗法的出现,可以说是彻底改变了癌症治疗格局,为癌症患者带来了生的希望。
但不幸的是,免疫检查点抑制剂只对部分癌症患者有效,例如肝癌等癌症,患者对免疫检查点抑制剂的反应很低。如何提高癌症患者对免疫检查点抑制剂的反应成为当前重要的研究方向。
近日,德国法兰克福大学的研究人员在 Gut 期刊发表了题为:Combining ferroptosis induction with MDSC blockade renders primary tumours and metastases in liver sensitive to immune checkpoint blockade 的研究论文。
该研究表明,激活铁死亡、抑制髓源性抑制细胞(MDSC)联合抗PD-1单抗,三管齐下,能够极大地提高肝肿瘤小鼠模型的存活率,减少其他原位肿瘤的肝转移。这项研究强调了特定肿瘤为环境下铁死亡诱导的免疫反应,为治疗原发性肝肿瘤和肝转移开辟了新的思路。

在这项研究中,研究首先在患有结直肠癌的小鼠中发现,谷胱甘肽过氧化物酶4(GPX4)的缺失会导致T细胞的激活,然而,这些T细胞并未抑制肿瘤的发生发展。这是因为它们被两个独立的机制所阻断:首先,癌细胞通过其表达的PD-L1抑制了这些T细胞;其次,免疫系统的髓源性抑制细胞(MDSC)抑制了身体的免疫反应。
研究团队对小鼠模型同时给药铁死亡激活剂(Withaferin A)、免疫检查点抑制剂(α-PD-1)和髓源性抑制细胞抑制剂(SB225002)的三重组合时,显着降低了肝脏肿瘤的生长。进一步实验显示,这种联合疗法还能够减少由转移性结直肠肿瘤引起的肝转移,但结直肠肿瘤本身对联合治疗没有反应。
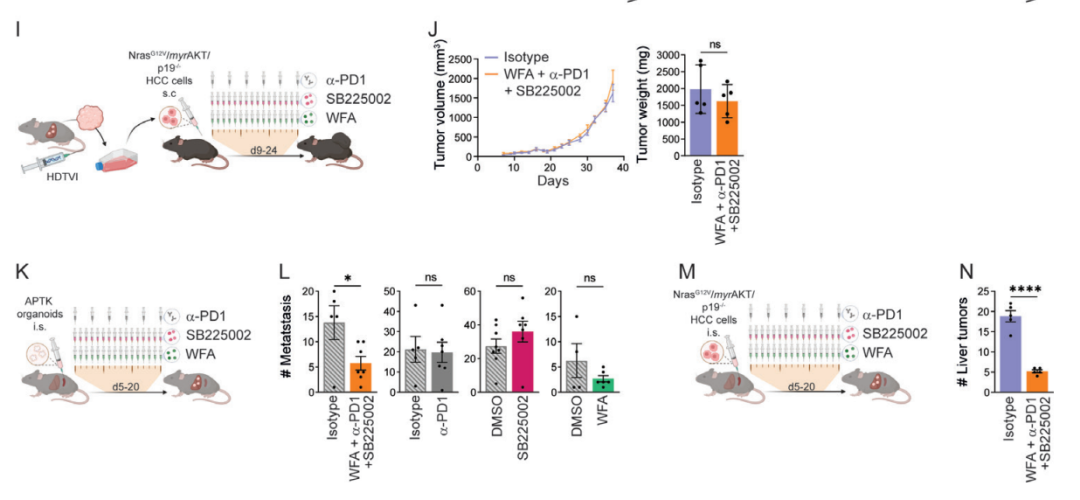
研究团队认为,这种联合疗法的疗效依赖于肝脏的微环境,而不是原发肿瘤。试验结果表明,这种联合疗法可以有效对抗任何类型的癌症的肝转移。通过这种联合疗法,能够从三个方面攻击肿瘤,首先让T细胞对癌细胞产生反应;然后消除了T细胞在抗击癌细胞时面临的两个障碍,即肿瘤细胞上的PD-L1的抑制作用和髓源性抑制细胞(MDSC)的抑制作用。
论文通讯作者、法兰克福大学 Florian Greten 教授表示,这项研究强调了肿瘤微环境在癌症治疗中的关键作用,这些在临床前模型中的数据为改善肝细胞癌和肝转移癌症患者的免疫治疗方案提供了令人鼓舞的基础。


