熊建萍教授组稿 | 邓军主任:靶向FGF/FGFR信号通路-从调节肿瘤微环境到联合免疫治疗
时间:2023-07-05 17:17:30 热度:37.1℃ 作者:网络
成纤维细胞生长因子 (FGF) 及其受体 (FGFR) 在细胞命运和血管生成中起着至关重要的作用,其信号轴失调驱动肿瘤发生。因此,许多研究已将 FGF/FGFR 信号转导用于癌症治疗,一些FGFR抑制剂在不同肿瘤中取得了有希望的结果,但治疗效率仍有待提高。免疫检查点阻断剂 (ICB) 的临床应用可使部分患者获得持续缓解。尽管将FGFR抑制剂与免疫疗法联系起来的数据有限。
但临床前研究表明,FGF/FGFR 信号通路参与调节肿瘤微环境 (TME),包括免疫细胞、血管发生和上皮-间质转化 (EMT)。这使得ICB与FGFR-酪氨酸激酶抑制剂 (FGFR-TKIs) 联合用于FGF/FGFR信号失调患者成为可能。本文中,我们回顾了FGF/FGFR 信号在TME调节中的作用以及FGFR-TKI联合ICB的潜在机制,单独使用ICB或与FGFR-TKI联合治疗FGFR失调肿瘤的临床数据,阐述 FGFR 抑制剂可能通过影响“癌症免疫周期”的各个阶段来提高其对ICB的反应。
FGF/FGFR信号致癌失调
FGF在细胞生长中起着至关重要的作用,依照功能主要分为分泌型信号蛋白 (FGF1-10、16-23) 和细胞内非信号电压门控钠通道蛋白 (FGF11-14)。FGFs结合相应的FGFR(包括 FGFR1-4 和 FGFRL1)激活下游信号通路(Fig1),如 PI3K/AKT、RAS/MAPK、JAK/STAT 和 PLCγ,从而调节细胞生长、转移、免疫调节和血管生成。FGFR 在生物体中高度保守,可调节增殖、分化和存活等细胞行为。在配体依赖性或配体非依赖性的条件下,FGF/FGFR信号轴受到肿瘤细胞的劫持,从而导致致癌行为的发生。
具体而言,FGF/FGFR致癌失调的形式包括遗传改变(基因扩增、激活突变、致癌融合),分泌自分泌和旁分泌信号(如FGF信号)、调节血管生成和上皮-间质转化等。这些致癌失调促进了增殖、迁移、侵袭、血管生成等恶性生物学行为的发生,从而促进肿瘤发生发展。已在多数恶性肿瘤中发现 FGFR信号通路失调。
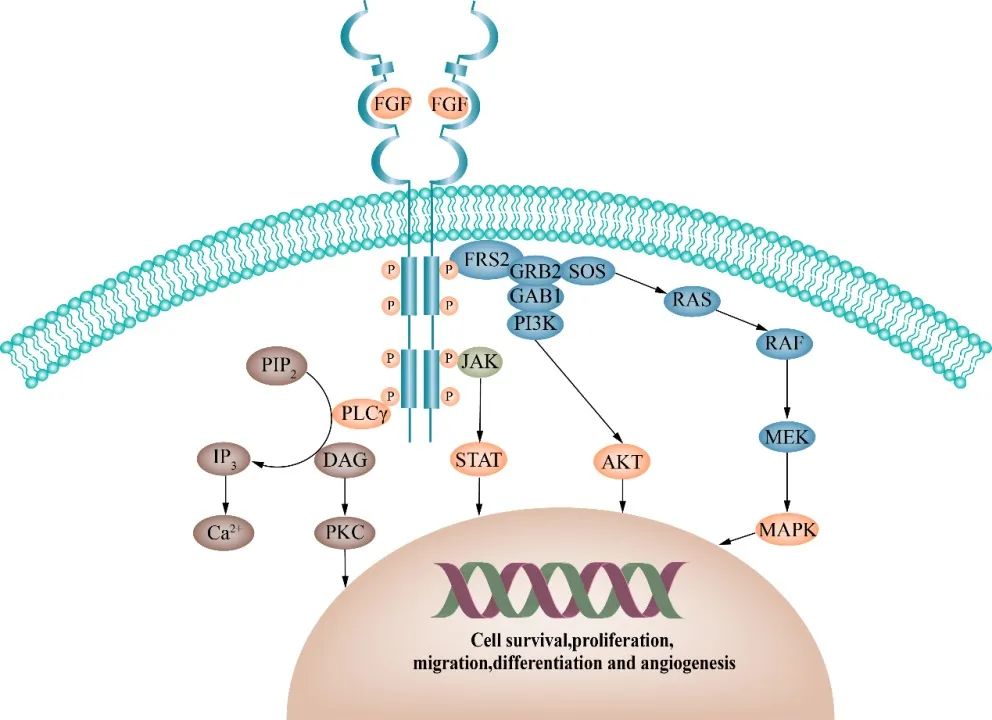
FGFR信号的微环境调控
肿瘤微环境 (TME) 是由癌细胞、免疫细胞、基质细胞、细胞外基质和血管-淋巴结系统组成的复杂网络,它在肿瘤发展和治疗中起着至关重要的作用。有越来越多的研究聚焦于通过靶向TME来治疗恶性肿瘤,包括消除异常脉管系统、基质细胞的再教育、抑制TAM募集、恢复T细胞耗竭等方式。肿瘤驱动通路中的突变可以激活 TME 内的免疫抵抗和免疫失调,促进肿瘤免疫逃逸。值得注意的是,FGF/FGFR 通路激活与 TME 相关。本节探讨 FGF/FGFR 信号在 TME 中的作用(Table1)。

1.T淋巴细胞浸润
实验证明,失调的FGF/FGFR 信号与各种肿瘤中 T 细胞浸润减少和T细胞耗竭增加有关,其潜在机制涉及IFN-γ和PPARG通路。对临床试验的数据集分析后也发现,T细胞浸润减少与FGFR表达及IFN-γ信号受损有关[1, 2,3]。抗VEGFR和FGFR单抗的使用也增加了激活CD8+T细胞分泌的IFN-γ和颗粒酶B(GZMB)的百分比[4]。而IFN-γ、GZMB是肿瘤免疫中的重要中间因子,与T细胞浸润有关。此外,研究证实β-catenin、PPAR-γ和FGFR3通路在非T细胞炎性肿瘤中同时被激活[5]。而PPARG信号与非T细胞浸润表型肿瘤相关[6]。这提示FGFR突变可能通过PPARG通路抑制了NF-κB而减少T细胞浸润。
2. MHC表达
MHC 系统通过将抗原呈递给T细胞在免疫反应中起着至关重要的作用。肿瘤通常通过改变 MHC 表达来逃避免疫监视。FGFR信号一方面通过抑制IFN-γ介导的JAK/STAT信号通路间接抑制MHCⅠ类分子的表达[7],另一方面通过MAPK通路直接抑制MHCⅡ类分子表达,从而减少T细胞浸润和促进免疫逃逸[8]。
3. PD-1/PD-L1调控
TME由各种免疫细胞组成,它们的相互作用对于抗肿瘤免疫至关重要。FGFR信号可通过上调 PD-1和PD-L1表达诱导免疫抵抗[4,9]。然而,FGFR 信号转导对PD-1/PD-L1 表达的调节是复杂且依赖于环境的。有少量研究观察到FGFR信号与PD-1/PD-L1表达无直接相关[10],甚至出现相反结果[11,12]。
4. 调节免疫抑制细胞浸润和巨噬细胞极化
在肿瘤发展过程中调节免疫抑制细胞浸润和巨噬细胞极化对于免疫逃逸和肿瘤生长至关重要。巨噬细胞、调节性T (Treg) 细胞和髓源性抑制细胞 (MDSC) 等免疫抑制细胞在创建免疫抑制性肿瘤微环境 (TME) 中发挥着重要作用。巨噬细胞具有可塑性,可以从抗肿瘤M1表型转变为促肿瘤M2表型,促进血管生成、肿瘤细胞增殖、转移、化疗耐药和免疫逃逸。同样,MDSCs通过激活M2巨噬细胞和Treg细胞、阻断淋巴细胞归巢以及促进上皮-间质转化 (EMT) 和血管生成来抑制免疫反应。
FGFR的激活促进TME中巨噬细胞的募集、极化和Treg细胞存活。在表达FGFR的肺部恶性肿瘤中观察到M2巨噬细胞和 Treg 细胞的浸润增加[13]。研究表明,激活的FGFR1信号通过NF-κB信号诱导趋化因子CX3CL1表达促进了巨噬细胞募集[14]。FGFR信号通过调节IL-2的下游通路介导了Treg细胞的分化和存活[4]。此外,抑制 FGFR可减少 MDSC 的浸润,但具体调节机制仍有待完善[15,16]。
5. 间质改变
上皮-间质转化 (EMT) EMT指的是上皮细胞获得间质特征的过程,与肿瘤的发生、转移、侵袭有关。FGF/FGFR信号可与TGF-β合作,在 EMT诱导和肿瘤生长中发挥作用[17]。另外,FGFR2 IIIb和FGFR2 IIIc亚型之间的转换诱导了EMT,这种转换可能由AKT3/IWS1通路促进[18]。然而,有少量研究指出FGF信号妨碍了血管内皮细胞的EMT,这可能与不同FGF/FGFR 信号之间的串扰有关[19]。另外,癌症相关成纤维细胞 (CAF) 是TME的重要组成部分,有助于肿瘤进展和调节免疫。FGF有助于CAF的激活,而阻断FGFR信号将抑制 CAF的增殖、迁移[20]。
6. 异常脉管网络
TME内的异常血管网络以间质流体压力升高和血管供应效率降低为特征,影响氧气和药物输送并阻碍免疫细胞浸润。FGF/FGFR信号以及 VEGF/VEGFR 信号在肿瘤血管发生、促进内皮细胞增殖、迁移和血管生成中起着关键作用[21–23]。同时,FGF信号还可以通过抑制粘附分子的表达来损害T细胞归巢和募集[24]。
FGFR-TKI的免疫学作用
FGFR-TKI通过多种途径参与肿瘤微环境的调控。首先,它可以诱导肿瘤细胞发生免疫原性死亡,增加免疫原性并激活免疫反应。其次,FGFR-TKI有助于正常化肿瘤脉管系统,改善血管结构和功能,促进免疫细胞的外渗和T淋巴细胞的浸润。此外,它还能调节T细胞的活化和渗透,并降低肿瘤细胞上PD-1/PD-L1的表达,从而增强免疫激活的效应。研究还发现,在肺癌、乳腺癌和肝癌等多种肿瘤中,FGFR-TKI可以增强CD4+和CD8+ T细胞的渗透,抑制Treg细胞和终末耗竭T细胞的生成,降低PD-L1的表达。此外,FGFR-TKI还能影响肿瘤相关巨噬细胞的编程、减少免疫抑制细胞(MDSCs)的活化,并抑制Treg细胞的生成,阻止肿瘤的免疫逃逸。此外,FGFR-TKI还可能通过调节MHC的表达,改善肿瘤细胞对免疫细胞的识别和攻击,并减少获得性免疫抵抗的产生。然而,FGFR信号的调控效应可能受到肿瘤的异质性和其他内在分子的影响,需要进一步深入研究来验证和解释这些机制。总之,FGFR-TKI以癌症免疫循环依赖的方式对某些肿瘤的T细胞激活进行辅助(Fig2),其作用于癌症免疫周期的不同阶段,例如 T 细胞的表观遗传改变、T 细胞活化和浸润以及肿瘤血管的正常化,最终促进 T 细胞活化和抗肿瘤免疫反应。
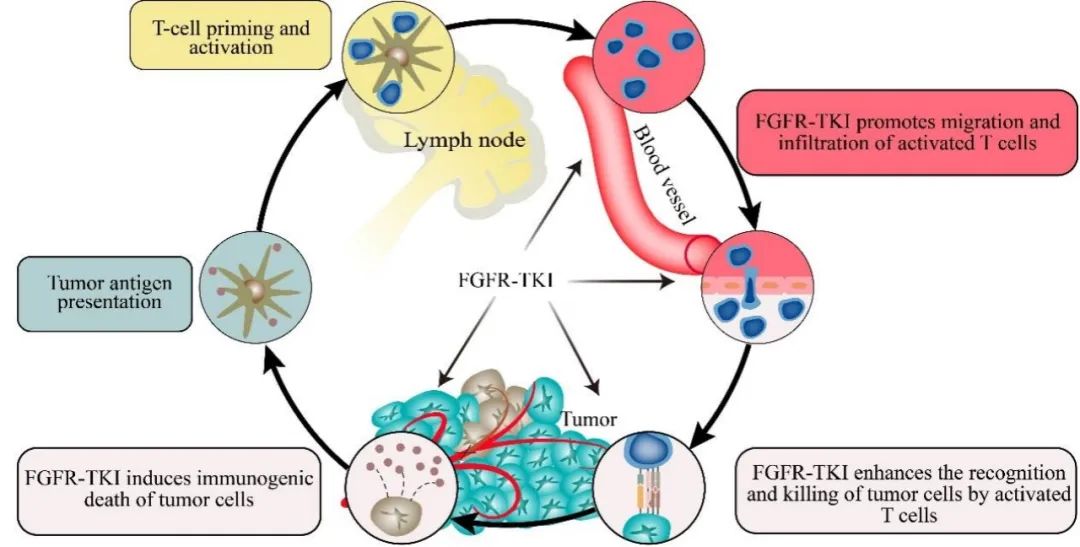
4 FGFR-TKI与免疫检查点疗法的组合
1. PD-1/PD-L1抑制剂对FGFR失调的应答
部分研究表明,致癌性FGFR突变与免疫检查点阻断 (ICB) 治疗反应不佳有关[25]。对使用免疫治疗的黑色素瘤患者的分析指出,与应答者相比,无应答者治疗前肿瘤中的FGFR1 mRNA 表达相对较高[20]。并且,与低表达患者相比,接受抗PD-1治疗的高FGFR1表达患者具有更短的总生存期,高表达FGFR3的患者具有更短的无进展生存期[20]。此外,晚期尿路上皮癌患者的PD-L1治疗结果显示,FGFR+ 患者的中位 OS 低于 FGFR- 患者[26,27]。另外,有研究指出免疫治疗期间的超进展性疾病 (HPD) 与T细胞分泌的IFN-γ作用与FGF-2 信号有关[28]。
然而, FGFR失调对ICB单一疗法的影响存在矛盾的发现。FGFR1在胃癌模型中的表达提高了免疫治疗效果[29],并且黑色素瘤和非小细胞肺癌中的 FGFR突变也与更好的生存和治疗反应相[30,31]。另外,对Checkmate 275及IMVigor 210两项2期临床试验分析后指出,ICI治疗的反应率或OS与有无mFGFR3失调无关[2]。
2. FGFR抑制剂与ICI治疗的联用效果
将FGFR酪氨酸激酶抑制剂 (TKI) 与ICB疗法相结合已显示出增强FGFR突变肿瘤抗肿瘤作用的前景。FGFR-TKI有助于克服阻碍ICB疗效的 T 细胞活化不足和不适当的肿瘤微环境 (TME) 条件。临床前研究表明,FGFR-TKI联合PD-1/PD-L1抑制剂可增加T细胞浸润,诱导免疫细胞死亡[4,32],并改善肺癌、膀胱癌等的治疗效果[13]。
几项正在进行的临床试验正在评估 FGFR-TKI 和 ICB 疗法的组合,在某些恶性肿瘤中取得了有希望的早期结果。然而,一些临床研究报告 FGFR-ICB 联合治疗没有显着获益,这可能与不同的肿瘤分型或某些生物标志物有关[21,33]。
总之,虽然临床前研究表明联合FGFR-TKI和 ICB 疗法具有增强抗肿瘤作用的潜力,但直接的临床证据仅限于特定的恶性肿瘤。正在进行的针对各种癌症类型的临床试验也许将为联合治疗的疗效提供更确凿的结果。
主编评语
FGFR被发现参与癌症的多种过程,是治疗肿瘤有应用前景的靶点,越来越多的FGFR抑制剂进入临床前研究及临床研究阶段,部分FGFR抑制剂已被批准应用于临床。但获得性耐药及全身毒性等问题阻碍了FGFR抑制剂的应用,联合用药是解决全身毒性和获得性耐药的有效措施。免疫检查点疗法 (ICB) 开辟了肿瘤治疗新格局,使部分患者获得持续缓解。FGF/FGFR信号通路参与调节肿瘤微环境 (TME),包括免疫细胞、血管发生和上皮-间质转化 (EMT),这使得ICB与FGFR抑制剂联合用于 FGF/FGFR 信号失调患者理论上可行。我们需要进一步探索FGF/FGFR信号在TME 调节中的作用以及 FGFR抑制剂联合ICB 的潜在机制,以期为免疫联合FGFR抑制剂治疗提供更多认识,有望将来为相关临床实践提供依据。
参考文献
1. Ruan R, Li L, Li X, Huang C, Zhang Z, Zhong H, et al. Unleashing the potential of combining FGFR inhibitor and immune checkpoint blockade for FGF/FGFR signaling in tumor microenvironment. Mol Cancer. 2023;22:60.
2. Wang L, Gong Y, Saci A, Szabo PM, Martini A, Necchi A, et al. Fibroblast Growth Factor Receptor 3 Alterations and Response to PD-1/PD-L1 Blockade in Patients with Metastatic Urothelial Cancer. European Urology. 2019;76:599–603.
3. Necchi A, Joseph RW, Loriot Y, Hoffman-Censits J, Perez-Gracia JL, Petrylak DP, et al. Atezolizumab in platinum-treated locally advanced or metastatic urothelial carcinoma: post-progression outcomes from the phase II IMvigor210 study. Ann Oncol. 2017;28:3044–50.
4. Yi C, Chen L, Lin Z, Liu L, Shao W, Zhang R, et al. Lenvatinib Targets FGF Receptor 4 to Enhance Antitumor Immune Response of Anti-Programmed Cell Death-1 in HCC. Hepatology. 2021;74:2544–60.
5. Sweis RF, Spranger S, Bao R, Paner GP, Stadler WM, Steinberg G, et al. Molecular Drivers of the Non-T-cell-Inflamed Tumor Microenvironment in Urothelial Bladder Cancer. Cancer Immunol Res. 2016;4:563–8.
6. Kardos J, Chai S, Mose LE, Selitsky SR, Krishnan B, Saito R, et al. Claudin-low bladder tumors are immune infiltrated and actively immune suppressed. JCI Insight. 2016;1:e85902.
7. H W, B L, J W. Beta2-microglobulin(B2M) in cancer immunotherapies: Biological function, resistance and remedy. Cancer letters [Internet]. 2021 [cited 2022 Sep 15];517. Available from: https://pubmed.ncbi.nlm.nih.gov/34129878/
8. Kono M, Komatsuda H, Yamaki H, Kumai T, Hayashi R, Wakisaka R, et al. Immunomodulation via FGFR inhibition augments FGFR1 targeting T-cell based antitumor immunotherapy for head and neck squamous cell carcinoma. OncoImmunology. 2022;11:2021619.
9. Deng H, Kan A, Lyu N, Mu L, Han Y, Liu L, et al. Dual Vascular Endothelial Growth Factor Receptor and Fibroblast Growth Factor Receptor Inhibition Elicits Antitumor Immunity and Enhances Programmed Cell Death-1 Checkpoint Blockade in Hepatocellular Carcinoma. Liver Cancer. 2020;9:338–57.
10. Jusakul A, Cutcutache I, Yong CH, Lim JQ, Huang MN, Padmanabhan N, et al. Whole-Genome and Epigenomic Landscapes of Etiologically Distinct Subtypes of Cholangiocarcinoma. Cancer Discov. 2017;7:1116–35.
11. Maraz A, Takacs P, Lawson J, Santiago-Walker A, Pajor L, Sukosd F, et al. Correlation between FGFR mutation and PD-L1 expression of urinary bladder cancers: A real-world based biomarker study. JCO. 2019;37:e16030–e16030.
12. Roghmann F, Wirtz R, Jarczyk J, Kriegmair MC, Worst TS, Sikic D, et al. 933P - Prognostic role of FGFR Mutations and FGFR mRNA expression in metastatic urothelial cancer treated with anti-PD(L1) inhibitors in first and second-line setting. Annals of Oncology. 2019;30:v375–6.
13. Palakurthi S, Kuraguchi M, Zacharek SJ, Zudaire E, Huang W, Bonal DM, et al. The Combined Effect of FGFR Inhibition and PD-1 Blockade Promotes Tumor-Intrinsic Induction of Antitumor Immunity. Cancer Immunol Res. 2019;7:1457–71.
14. Reed JR, Stone MD, Beadnell TC, Ryu Y, Griffin TJ, Schwertfeger KL. Fibroblast Growth Factor Receptor 1 Activation in Mammary Tumor Cells Promotes Macrophage Recruitment in a CX3CL1-Dependent Manner. Li Y, editor. PLoS ONE. 2012;7:e45877.
15. Ye T, Wei X, Yin T, Xia Y, Li D, Shao B, et al. Inhibition of FGFR signaling by PD173074 improves antitumor immunity and impairs breast cancer metastasis. Breast Cancer Res Treat. 2014;143:435–46.
16. Akhand SS, Liu Z, Purdy SC, Abdullah A, Lin H, Cresswell GM, et al. Pharmacologic Inhibition of FGFR Modulates the Metastatic Immune Microenvironment and Promotes Response to Immune Checkpoint Blockade. Cancer Immunol Res. 2020;8:1542–53.
17. Shirakihara T, Horiguchi K, Miyazawa K, Ehata S, Shibata T, Morita I, et al. TGF-β regulates isoform switching of FGF receptors and epithelial-mesenchymal transition. EMBO J. 2011;30:783–95.
18. D R, B R, M N, A M, F B, Mr T. Expression of the FGFR2 mesenchymal splicing variant in epithelial cells drives epithelial-mesenchymal transition. Oncotarget [Internet]. 2016 [cited 2023 Jan 25];7. Available from: https://pubmed.ncbi.nlm.nih.gov/26713601/
19. Chen P-Y, Qin L, Barnes C, Charisse K, Yi T, Zhang X, et al. FGF Regulates TGF-β Signaling and Endothelial-to-Mesenchymal Transition via Control of let-7 miRNA Expression. Cell Reports. 2012;2:1684–96.
20. Wu Y, Yi Z, Li J, Wei Y, Feng R, Liu J, et al. FGFR blockade boosts T cell infiltration into triple-negative breast cancer by regulating cancer-associated fibroblasts. Theranostics. 2022;12:4564–80.
21. Lee HW, Seo HK. Fibroblast Growth Factor Inhibitors for Treating Locally Advanced/Metastatic Bladder Urothelial Carcinomas via Dual Targeting of Tumor-Specific Oncogenic Signaling and the Tumor Immune Microenvironment. IJMS. 2021;22:9526.
22. Yu P, Wilhelm K, Dubrac A, Tung JK, Alves TC, Fang JS, et al. FGF-dependent metabolic control of vascular development. Nature. 2017;545:224–8.
23. Liu G, Chen T, Ding Z, Wang Y, Wei Y, Wei X. Inhibition of FGF-FGFR and VEGF-VEGFR signalling in cancer treatment. Cell Prolif. 2021;54:e13009.
24. Sackstein R, Schatton T, Barthel SR. T-lymphocyte homing: an underappreciated yet critical hurdle for successful cancer immunotherapy. Lab Invest. 2017;97:669–97.
25. Loriot Y, Necchi A, Park SH, Garcia-Donas J, Huddart R, Burgess E, et al. Erdafitinib in Locally Advanced or Metastatic Urothelial Carcinoma. N Engl J Med. 2019;381:338–48.
26. Santiago-Walker AE, Chen F, Loriot Y, Siefker-Radtke AO, Sun L, Sundaram R, et al. Predictive value of fibroblast growth factor receptor (FGFR) mutations and gene fusions on anti-PD-(L)1 treatment outcomes in patients (pts) with advanced urothelial cancer (UC). JCO. 2019;37:419–419.
27. Benjamin DJ, Mar N, Rezazadeh Kalebasty A. Immunotherapy With Checkpoint Inhibitors in FGFR-Altered Urothelial Carcinoma. Clin Med Insights Oncol. 2022;16:11795549221126252.
28. Li G, Choi JE, Kryczek I, Sun Y, Liao P, Li S, et al. Interp of immune and oncometabolic pathways drives cancer hyperprogression during immunotherapy. Cancer Cell. 2023;S1535-6108(22)00594-3.
29. Yang C, Song D, Zhao F, Wu J, Zhang B, Ren H, et al. Comprehensive analysis of the prognostic value and immune infiltration of FGFR family members in gastric cancer. Front Oncol. 2022;12:936952.
30. G G, L C, F Z, T J, W W, S M, et al. Special issue “The advance of solid tumor research in China”: FGFR4 alterations predict efficacy of immune checkpoint inhibitors in nonsmall cell lung cancer. International journal of cancer [Internet]. 2023 [cited 2023 Jan 29];152. Available from: https://pubmed.ncbi.nlm.nih.gov/36062503/
31. Zhang W, Xia H, Yang R, Zhang Y, Zheng Q, Shang X, et al. Fibroblast growth factor receptor family mutations as a predictive biomarker for immune checkpoint inhibitors and its correlation with tumor immune microenvironment in melanoma. Front Immunol. 2022;13:1030969.
32. Kato Y, Tabata K, Kimura T, Yachie-Kinoshita A, Ozawa Y, Yamada K, et al. Lenvatinib plus anti-PD-1 antibody combination treatment activates CD8+ T cells through reduction of tumor-associated macrophage and activation of the interferon pathway. PLoS One. 2019;14:e0212513.
33. Kacew A, Sweis RF. FGFR3 Alterations in the Era of Immunotherapy for Urothelial Bladder Cancer. Front Immunol. 2020;11:575258.


