沈阳药科大学罗聪教授/张申武教授团队《AHM》:自增强型纳米组装体实现PTT/铁死亡协同诱导的肿瘤消融
时间:2024-05-22 19:00:21 热度:37.1℃ 作者:网络
恶性肿瘤仍严重威胁着人类的生命健康。近年来,研究者们致力于多种新型抗肿瘤策略的设计与开发。其中,铁死亡作为一种新型的调节性细胞死亡方式,于2012年被定义为细胞内铁超载诱导的细胞死亡,已被用于癌症治疗策略的构建。然而,肿瘤细胞内的铁含量受到铁稳态系统的调节,单一的铁离子递送策略的铁死亡诱导效果并不理想。并且,传统的铁递送策略往往有金属材料及相关载体的参与,存在安全性隐患。此外,生理温度下铁介导的芬顿反应过程进行较为缓慢,并不足以产生大量高细胞毒性的羟基自由基(·OH)以触发脂质过氧化风暴。因此,亟待开发一种可促进肿瘤细胞铁超载并升高肿瘤局部温度以触发脂质过氧化风暴的高效低毒的纳米药物递送策略。
随着纳米技术的不断发展,无载体纳米药物递药系统在药物递送方面显示出潜力。其中,无载体纯药共组装纳米递送系统是由两种或两种以上药物共组装形成的不依赖载体材料的新型纳米制剂,具有多种优势,如简易的制备工艺、高效的药物共载、灵活的剂量调节及精确的体内同步共递送等。此外,凭借无载体共组装纳米递送系统中药物分子的特殊性质,有望实现肿瘤部位可控的药物释放,为高效低毒的抗肿瘤药物联合递送提供优良的技术平台。
2024年4月16日,沈阳药科大学罗聪教授/张申武教授团队报道了一种光热(PTT)/铁死亡协同诱导肿瘤消融的策略,将芬顿反应反应物二茂铁(Fc)与光热光敏剂(DiR)共组装成纳米组装体,并在其表面修饰20%(w/w)DSPE-PEG2K以提升其稳定性(pDF NAs)。Fc可促进肿瘤细胞铁超载,诱导芬顿反应的发生,生成高细胞毒性的羟基自由基(·OH)。与此同时,DiR诱导的过高热可加速芬顿反应动力学,触发脂质过氧化风暴。此外,大量积累的脂质过氧化物(LPOs)及其代谢产物可破坏热休克蛋白(主要为热休克蛋白90,HSP90)的结构,使肿瘤细胞对光热疗法敏感。在4T1乳腺癌荷瘤小鼠中,尾静脉注射纳米组装体后其可在肿瘤部位实现特异性的蓄积。在肿瘤部位给予808 nm近红外照射后,pDF NAs表现出优良的体内抗肿瘤效果,且未观察到明显的正常组织损伤,具有良好的安全性,表现出高效低毒的PTT/铁死亡协同肿瘤杀伤效果。该研究成果以“Precisely Self-Cooperative Nanoassembly Enables Photothermal/Ferroptosis Synergistic Tumor Eradication”为题发表在《Advanced Healthcare Materials》期刊上,沈阳药科大学罗聪教授/张申武教授为该论文的共同通讯作者,罗聪教授课题组硕士生杨小红为本文的第一作者。

【自增强型纳米组装体实现PTT/铁死亡协同诱导的肿瘤消融】
研究者们构建了一种由DiR与Fc共组装的无载体纳米组装体,以实现自增强的PTT/铁死亡协同抗肿瘤治疗。接着,研究者们在表面修饰20%(w/w)DSPE-PEG2K以提升纳米组装体的稳定性(图1)。Fc及其衍生物作为优良的铁供体,表现出较Fe2+更加稳定的氧化还原特性,已被广泛用于芬顿反应诱导的铁死亡抗肿瘤策略的构建。并且,DiR介导的过高热可通过升高肿瘤局部的温度加速芬顿反应进程,加速·OH的积累,突破生理温度下芬顿反应进行较为缓慢的限制,在增强铁死亡疗效方面展现出潜力。值得注意的是,PTT增强的铁死亡过程中LPOs的生成不断增加,其可通过抑制HSP90的表达增强肿瘤细胞对PTT疗效的敏感性。将pDF NAs静脉注射到4T1乳腺癌荷瘤小鼠中后,可特异性蓄积在肿瘤部位。在给予808 nm近红外光照射后,促进纳米组装体中Fc和DiR的释放,实现PTT/铁死亡协同肿瘤消融(图1)。

图1 | 一种自协同的纳米组装体实现PTT/铁死亡协同诱导的肿瘤消融。
【纳米组装体的制剂表征及光热效率评价】
首先将DiR与Fc通过一步纳米沉淀法制备成纳米组装体,并在其表面修饰20%(w/w)DSPE-PEG2K以提升其稳定性,纳米组装体具有均一的粒径并在透射电镜下呈现出球形结构。上述共组装过程由疏水作用力主导的多种作用力共同参与,并且纳米组装体的形成并未影响DiR自身的光热效率,pDF NAs的光热转换效率为30.8%,升温过程具有制剂浓度及光照功率依赖特性(图2)。
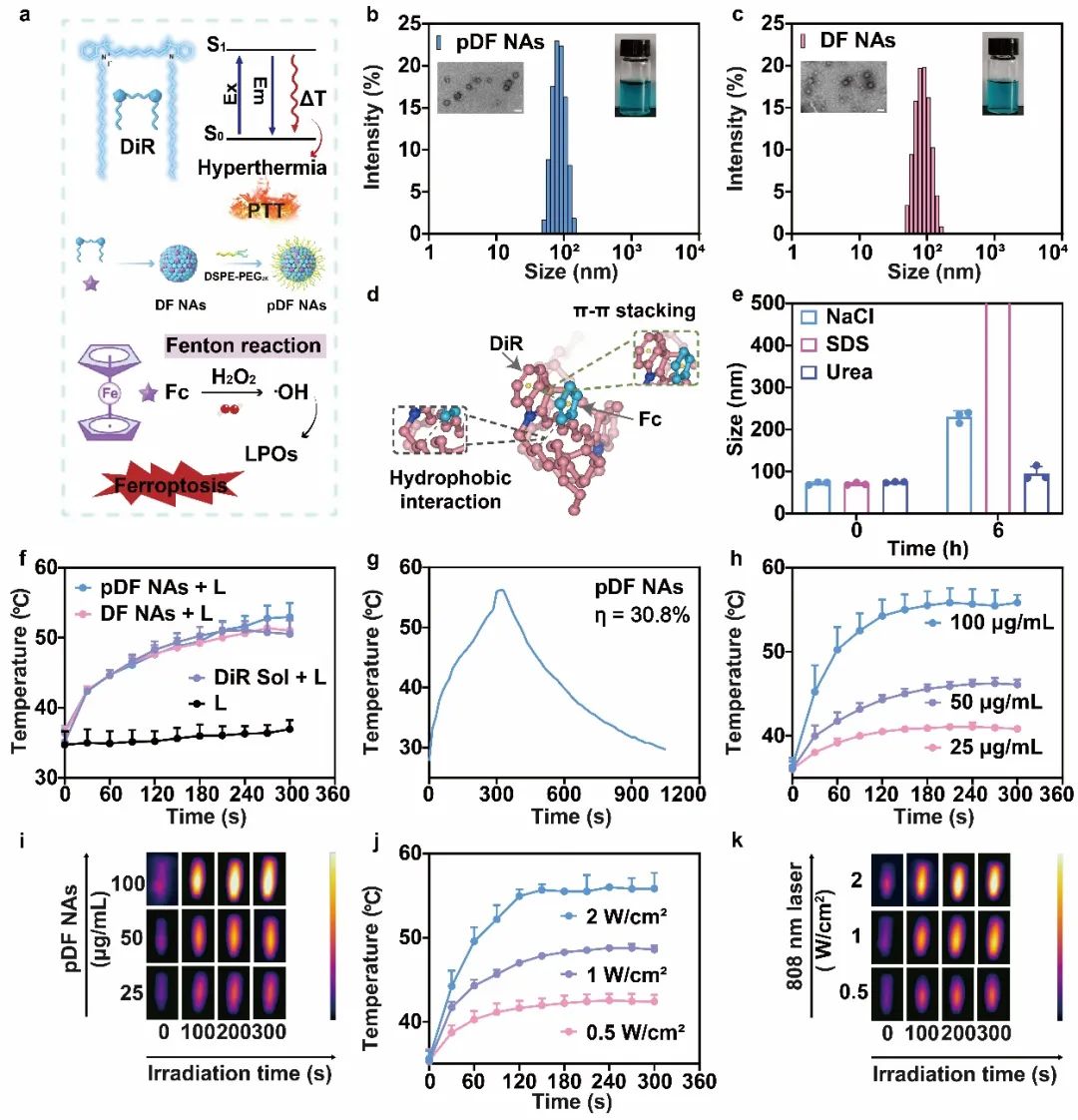
图2 | 纳米组装体的制剂表征及光热效率评价。
【针对4T1乳腺癌细胞的细胞摄取及细胞毒性实验】
首先,通过测定Bipy-Fc复合物的形成考察纳米组装体中光触发的Fc的释放行为。结果显示,随光照时间的延长,Bipy-Fc复合物在519 nm处的紫外吸收明显增强,表明808 nm近红外光照射可促进pDF NAs中Fc的快速释放,并具有光照时间依赖特性。其次,通过对苯二甲酸二钠捕获·OH的实验验证了Fc介导的芬顿反应具有温度和时间依赖特性,并且纳米组装体中DiR在808 nm近红外光下诱导的过高热可显著促进芬顿反应动力学,加速·OH的产生和蓄积。接下来,通过DiR自身的荧光特性考察了纳米组装体在4T1乳腺癌细胞中的摄取行为。实验表明,纳米组装体的形成提升了细胞摄取效率并具有时间依赖特性。并且,pDF NAs在808 nm近红外光照射的条件下对4T1乳腺癌细胞表现出最强的细胞毒性,这也进一步说明了纳米组装体的优势(图3)。
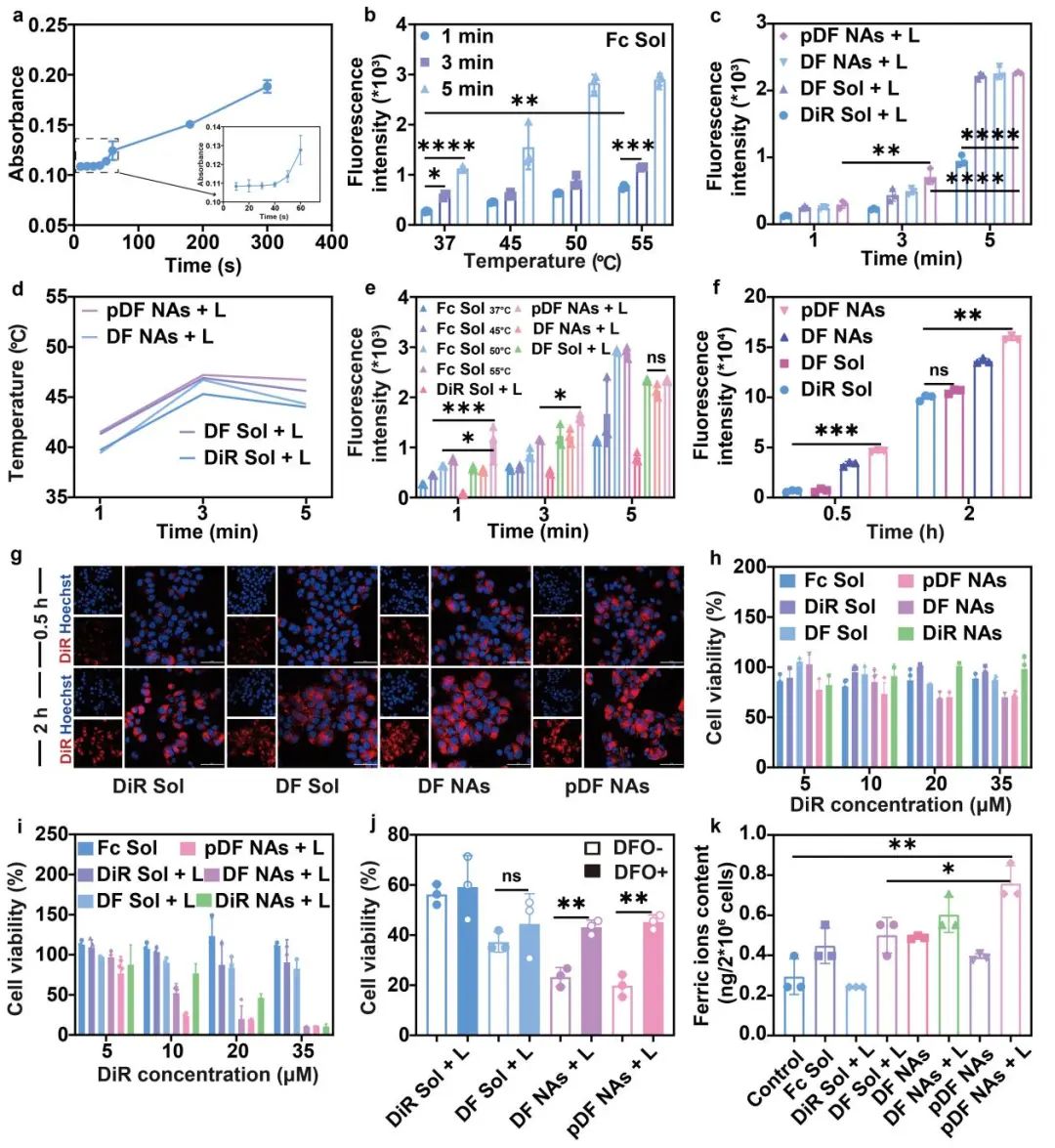
图3 | 纳米组装体的体外·OH产量测定与细胞摄取及细胞毒性实验结果。
【针对4T1乳腺癌细胞的细胞协同机制探究】
首先,通过测定4T1乳腺癌细胞中ROS、LPOs、·OH和MDA的含量,评估了不同制剂组诱导铁死亡的能力。结果显示,pDF NAs在808 nm近红外光照射的条件下(pDF NAs + L)诱导铁死亡的效果显著强于Fc Sol、DF Sol + L与非光照的pDF NAs组,这主要得益于其更加优良的细胞摄取与过高热促进的芬顿反应触发的脂质过氧化风暴。此外,由于剧烈的氧化应激可破坏细胞内的氧化还原稳态,促进氧化物质的积累,从而间接削弱肿瘤细胞的抗氧化系统。因此,研究者们进一步探究了细胞内GSH含量与GPXs抑制率水平。结果显示,pDF NAs + L可在一定程度上抑制GSH和GPX4的表达。最后,通过western blot实验验证了pDF NAs + L可抑制HSP90的表达,使4T1乳腺癌细胞对PTT疗效增敏(图4)。
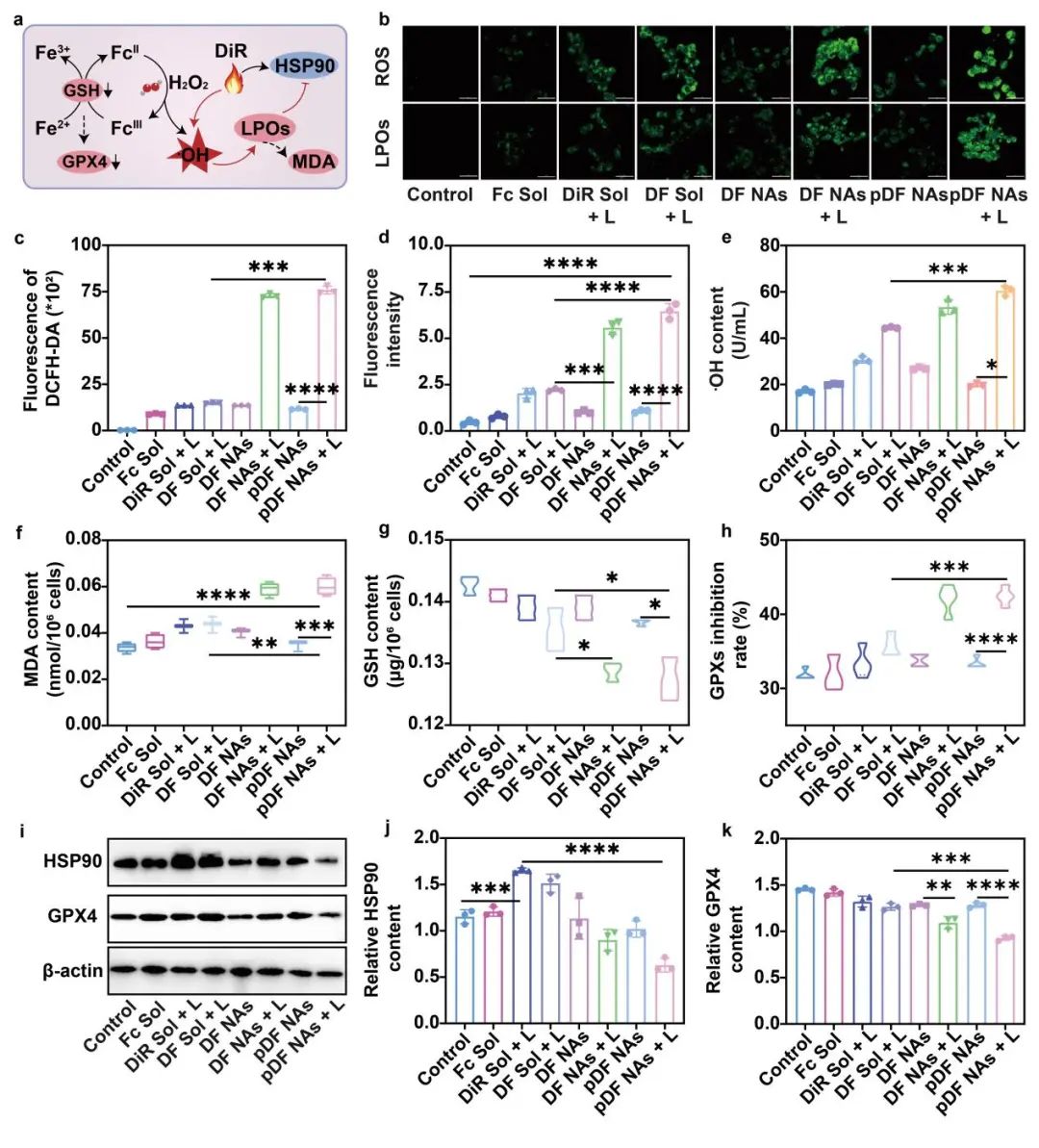
图4 | 纳米组装体针对4T1乳腺癌细胞的协同机制探究。
【纳米组装体的体内药动学、体内分布及光热转化效率】
首先,研究者们考察了纳米组装体的体内药动学行为。结果显示,pDF NAs具有显著延长的血液循环时间,这有利于其在肿瘤部位的高效蓄积。随后,作者建立了4T1乳腺癌荷瘤小鼠模型,通过体内分布实验探究了pDF NAs在小鼠体内的分布情况,表明它们可实现肿瘤部位特异性的蓄积。接着,作者采用同样的动物模型,通过近红外成像仪考察了pDF NAs的体内升温效应。结果表明,pDF NAs处理后的小鼠肿瘤部位表现出最显著的温度升高,有利于高效的肿瘤杀伤(图5)。
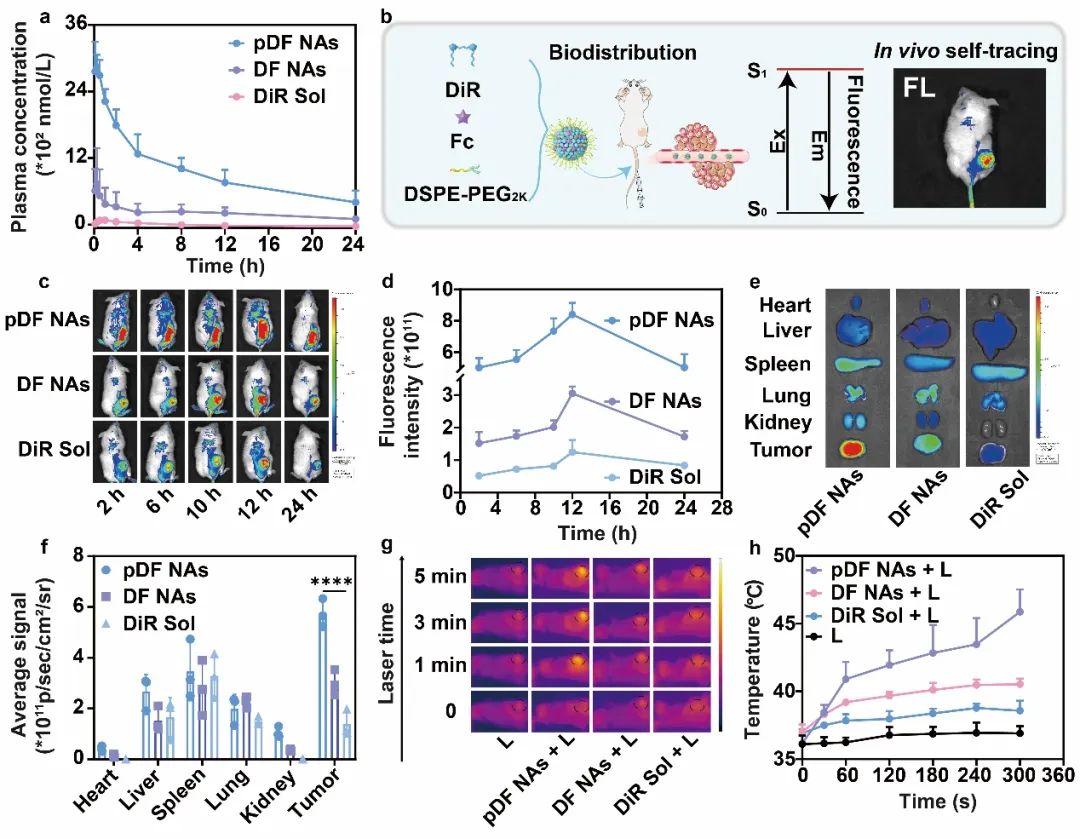
图5 | 纳米组装体的体内药动学、体内分布及体内光热转换效率的探究。
【体内抗肿瘤效果】
首先,研究者们对4T1乳腺癌荷瘤小鼠进行了不同组别的制剂处理,包括Saline、Fc Sol、DiR Sol + L、DF Sol + L、DF NAs、DF NAs + L、pDF NAs和pDF NAs + L。实验结果表明,在808 nm近红外光照射下,pDF NAs + L具有最强的抗肿瘤效果,并且体内协同机制实验也进一步表明pDF NAs在给予808 nm近红外光照射后,具有优良的氧化损伤相关因子的诱导及HSP90抑制效果。此外,研究者们进行了体内安全性的初步评价,发现纳米组装体具有良好的体内安全性,小鼠体重与主要的组织器官均未观察到明显异常。综合来看,研究者们构建的pDF NAs在808 nm近红外光照射下具有较为良好的PTT/铁死亡协同肿瘤抑制效果(图6)。
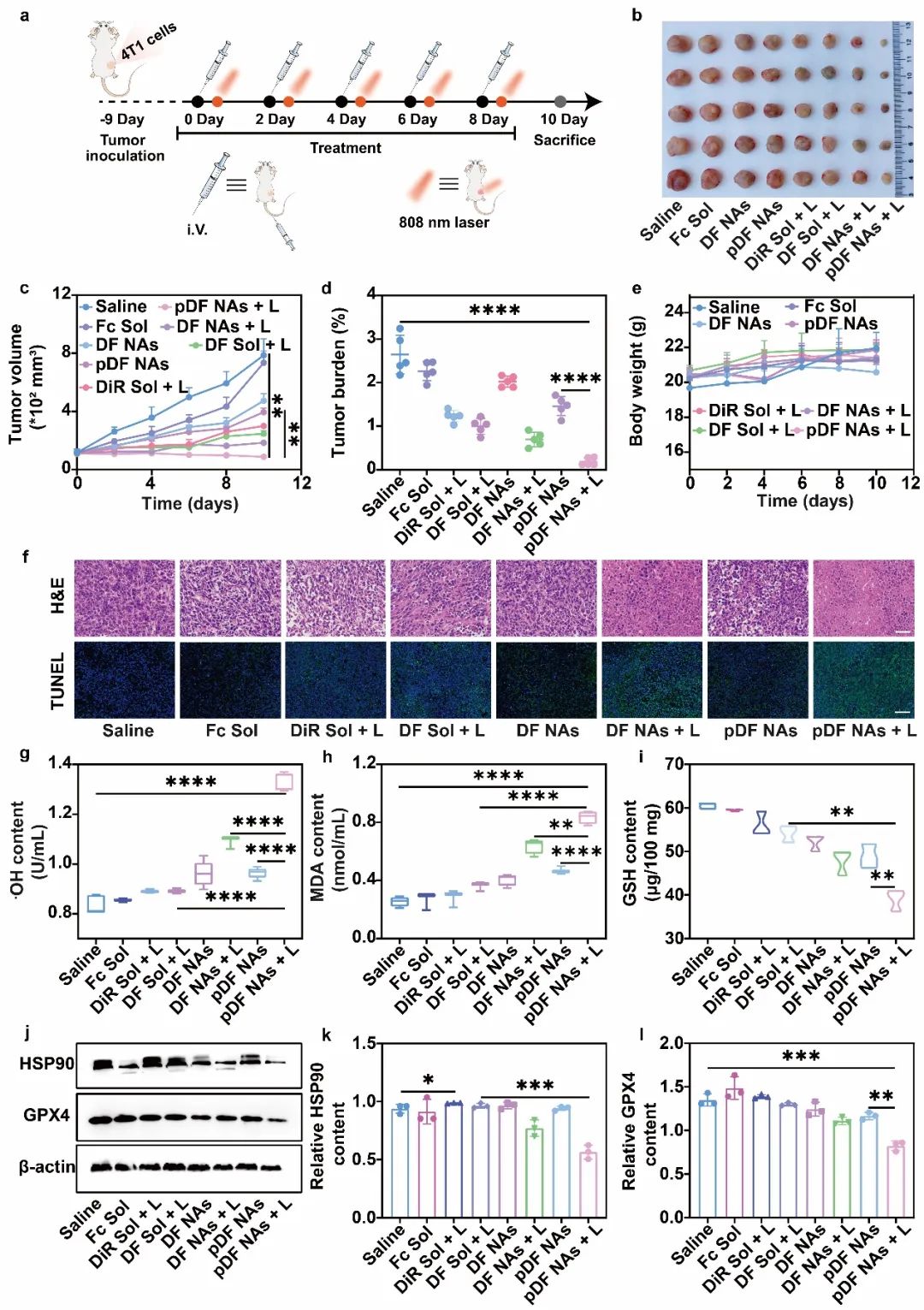
图6 | 纳米组装体在4T1乳腺癌荷瘤小鼠中的抗肿瘤作用。
【小结】
总之,研究团队制备了DiR与Fc共组装的纳米组装体用于PTT/铁死亡协同诱导的肿瘤消融。纳米组装体可在808 nm近红外光的照射下释放DiR与Fc,Fc可提升胞内铁含量并催化H2O2生成高细胞毒性的·OH,DiR介导的肿瘤局部过高热可加速上述芬顿反应过程,加剧铁死亡诱导的氧化损伤。此外,铁死亡过程不断积累的LPOs也可通过抑制HSP90的表达进一步增强肿瘤细胞对PTT疗效的敏感性,达到PTT/铁死亡协同杀伤肿瘤细胞的效果。这种自协同的无载体纳米药物联合抗肿瘤策略可能为新型的癌症治疗策略提供新的思路。
原文链接:
https://doi.org/10.1002/adhm.202304485


