Nat Commun:合成生物学领域突破性新方法“CReATiNG”,利用天然DNA简单、快速构建合成染色体
时间:2024-01-26 19:26:50 热度:37.1℃ 作者:网络
随着科技的进步和相关方法、技术的创新发展,人们可以通过合成染色体来回答生物学中的基本问题。目前,常用的合成染色体方法是从头合成,通过结合体外和体内技术将小的合成DNA片段逐渐组装成较大的分子,但该方法既昂贵又耗时,限制了其在生物学研究、技术中的应用。与从头合成染色体相比,利用天然DNA的克隆片段构建合成染色体可能是一种相对便宜且快速的替代方案,具有许多潜在的应用。
近日,美国洛杉矶南加州大学的Daniel T. Lusk & Ian M. Ehrenreich团队在Nature Communications上发表了题为“Building synthetic chromosomes from natural DNA”的文章。研究团队开发了一项突破性的新技术,即CReATiNG(Cloning Reprogramming and Assembling Tiled Natural Genomic DNA,克隆、重编程和组装平铺天然基因组DNA),这是一种从酵母天然成分构建合成染色体的方法,通过克隆和重组酵母的天然DNA片段,创造出人工合成的染色体,可取代细胞中的天然染色体。
研究团队使用CReATiNG重组不同酵母菌株和物种之间的染色体,修改染色体结构,并删除了染色体序列中许多连锁、不相邻的区域(约占染色体39%)。多重删除实验表明,CReATiNG可以通过合成染色体与天然对应染色体之间的重组来修复合成染色体设计中的缺陷。综上,CReATiNG拓展了染色体合成在多种生物学问题中的应用,包括解决遗传学、基因组学和进化中的各种基本问题。

文章发表在Nature Communications
CReATiNG的第一步是克隆酵母供体细胞中的天然染色体片段,将独特的接头序列(adapter)添加到其末端,指定这些分子在组装后如何彼此重组;第二步是将克隆片段共转化到细胞中,并通过体内同源重组对这些片段进行组装。
具体而言,研究团队将三种试剂共转化到持续表达Cas9的供体细胞中以克隆目标片段:1) 通过体外转录(IVT)导向RNA(gRNA),使用Cas9定向切割目标片段的两侧,将其从染色体中切除;2) 使用线性的细菌人工染色体/酵母人工染色体(BAC/YAC)克隆载体(pASC1),其两端具有与目标片段末端同源的序列,能够通过体内同源重组将片段整合到载体中;3) 修复模板由一个显性药物标记物(KanMX)组成,其两侧有同源臂,使得细胞能够通过同源重组重新组装断裂的染色体,从而能够用标记物替代一个片段(图1)。
通过选择URA3和KanMX中的标记物,可分离包含成功克隆事件的供体细胞,在载体与克隆片段连接处进行PCR验证克隆是否成功。克隆片段可从酵母供体细胞中提取,转化到EPI300大肠杆菌细胞中,能够诱导高pASC1拷贝数。诱导后,从大肠杆菌中提取含有片段的pASC1,然后用I-SceI消化将片段与载体分离。最后,具有相同末端adapter的多个不同片段与适当载体共转化到受体酵母细胞中,从而可以选择含有染色体组装的细胞。
为制作CReATiNG的原型,研究团队选择酿酒酵母(S. cerevisiae)属中最小的I号染色体(ChrI),这是一条230kb的染色体,包含117个已知或预测的蛋白质编码基因;并选择S.paradoxus(奇异酿酒酵母)作为CReATiNG原型的初始供体,按照上述步骤在BY4742(BY)参考菌株中进行染色体组装。研究团队对单个酵母克隆进行了全基因组纳米孔测序(Oxford Nanopore Technologies测序),并确认存在两个ChrI拷贝;一个来自BY、一个来自S. paradoxus,表明CReATiNG可构建能够替代受体细胞中天然染色体的合成染色体。
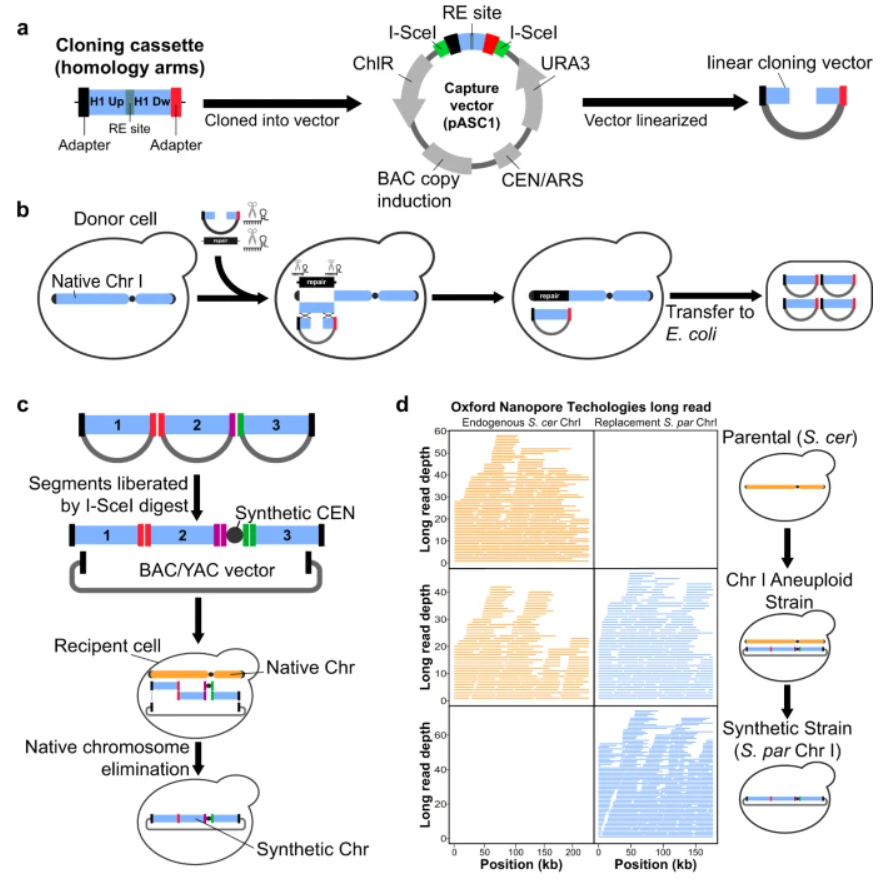
图1. 使用CReATiNG从酵母中的天然成分合成染色体。
在确认CReATiNG功能后,研究团队进一步探索了其潜在的应用领域。
第一个应用是在菌株和物种之间合成重组染色体,这有助于研究遗传表型的遗传基础。研究团队克隆了来自BY和另一种酿酒酵母菌株(RM11-1a,RM)的三个ChrI 片段,在克隆过程中,附加了与S. paradoxus片段使用相同的adapters,生成了所有可能的BY、RM和S. paradoxus片段的同源组合。由于已生成一个完全由S. paradoxus组成的ChrI的菌株,研究团队单独组装了剩余26个可能的染色体,并通过ONT测序对其进行验证。
通过对重组ChrI的酿酒酵母菌进行耐热性实验,研究团队证明了CReATiNG可以为研究物种间性状差异的遗传因素提供新见解。相对于传统上用于产生重组体的杂交方法,CReATiNG的优势在于不需要杂交、减数分裂或自然同源性,能够允许三个或更多条亲本染色体在单个组装中进行重组,但其目前不能应用于全基因组。
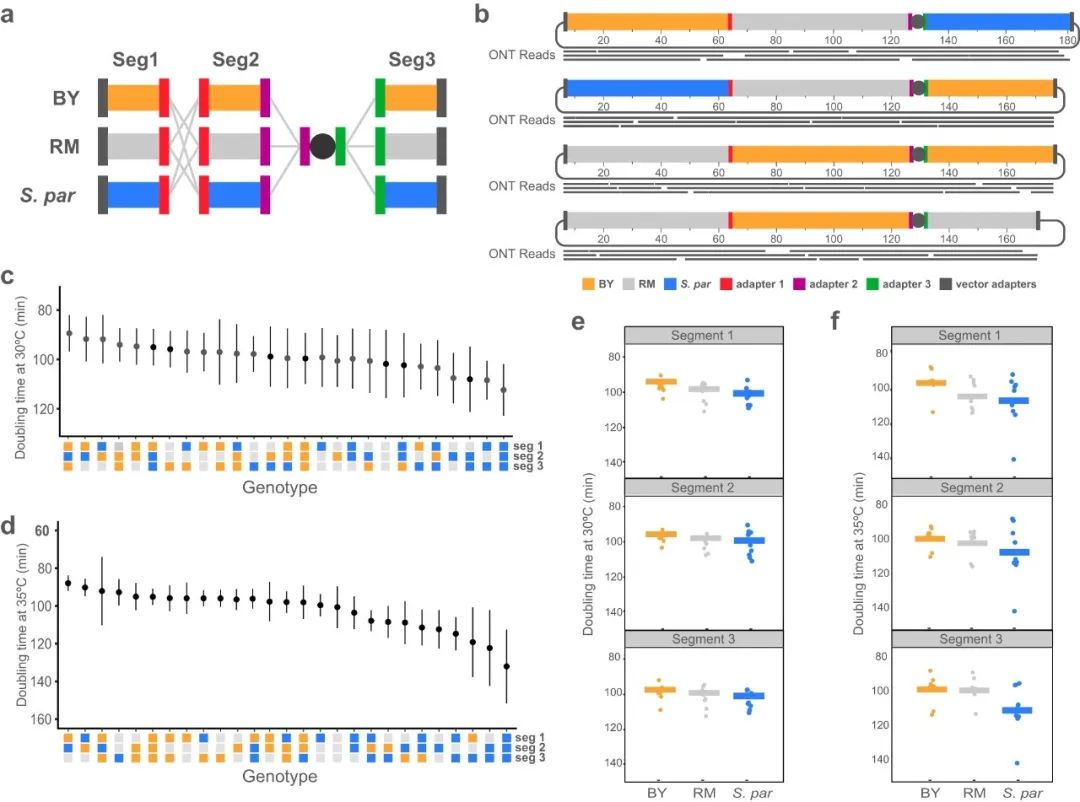
图2.使用CReATiNG在菌株和物种之间重组染色体。
第二个应用是用于实验性地探索支撑染色体组织的结构规律,这是与基因组功能和进化相关的一个课题。CReATiNG可以特定的非自然配置重构染色体的内容,这些配置由adapter进行编程;其可用于合成具有一个或多个倒位、重复、缺失或基因顺序修改的染色体。
为展示CReATiNG如何用于染色体重组,研究团队重新克隆了BY的1-3号片段,并修改了附加在每个片段上的adapter,让这些片段能够以不同的顺序组装起来。利用这些重新克隆的片段,研究团队设计了五个内容相同但顺序不同的非天然ChrI结构(即1-3-2、2-3-1、2-1-3、3-1-2 和 3-2-1),将其与合适的adapter组装在一起;然后去除天然ChrI,生成具有不同非天然ChrI结构的整倍体菌株(图3)。
整倍体菌株的成长实验显示,与天然1-2-3(IEY402)结构菌株相比,2-3-1(IEY423)结构菌株表现出7%的生长改善,3-1-2(IEY421)和1-3-2(IEY425)结构菌株分别显示了18%和68%的生长减少,表明可使用CReATiNG对染色体进行编程重组,以识别具有表型效应的非天然染色体构型。
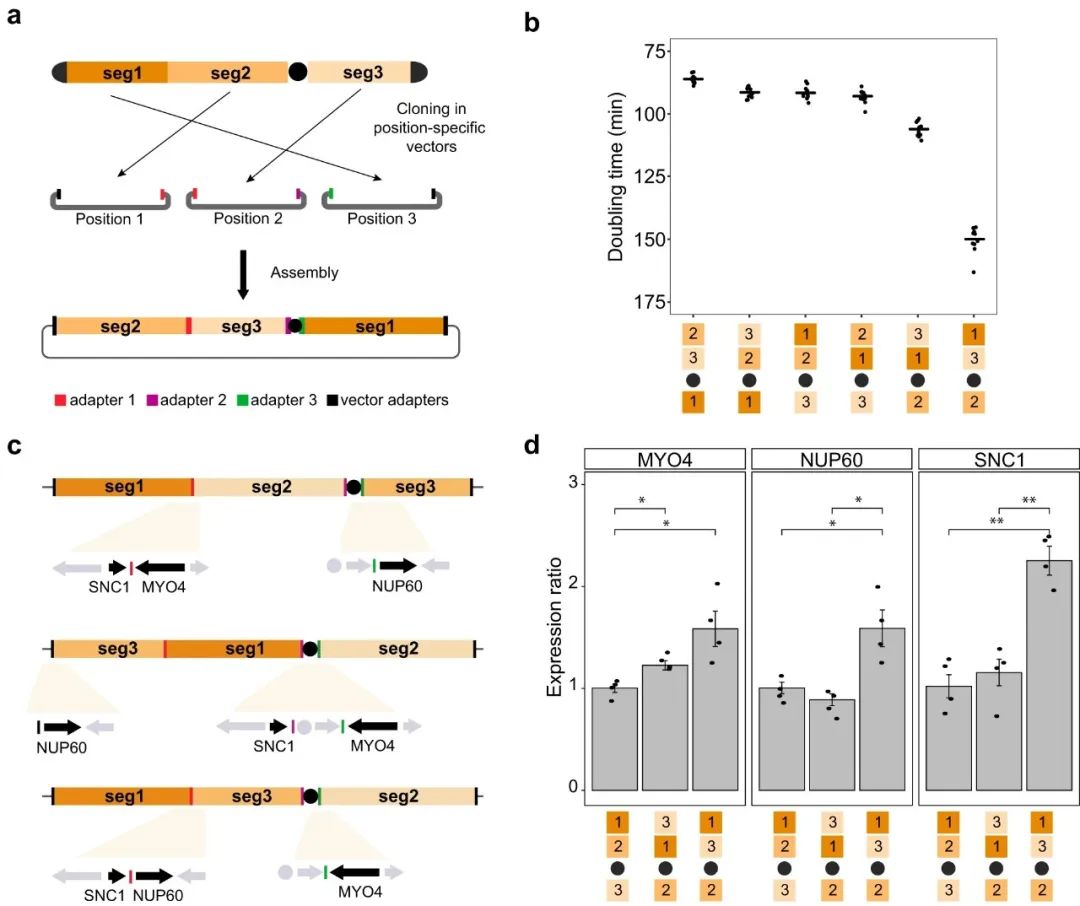
图3.用CReATiNG重组ChrI。
CReATiNG第三个应用是用于高度多重删除,这在传统基因组编辑技术中仍然具有挑战性。多重删除可消除许多非必需的遗传元素已被消除,生成精简的染色体;这种精简有利于生成具有大幅基因组成减少的酵母菌株,以及将功能相关的基因重组成模块。CReATiNG简化了多重删除过程:应该保留的天然染色体的片段可被克隆和组装,剩余染色体部分则被干净地删除。
研究团队设计了一个CReATiNG工作流程,从BY ChrI中删除了十个核心染色体区域(计30 kb),其包含18个非必需的不相邻遗传元素;并克隆11个片段,大小从3.8 kb-21kb不等,使用适当的adapter对其进行编程,以便进行组装(图4)。结果显示,CReATiNG的多重删除设计将ChrI减少了39.9%(91.7kb),并消除了45个遗传元素,表明CReATiNG可在单个组装中删除染色体上许多不相邻片段。此外,CReATiNG也可以用于检测具有遗传背景的未知相互作用,从而改善对基因功能和上位性的理解。
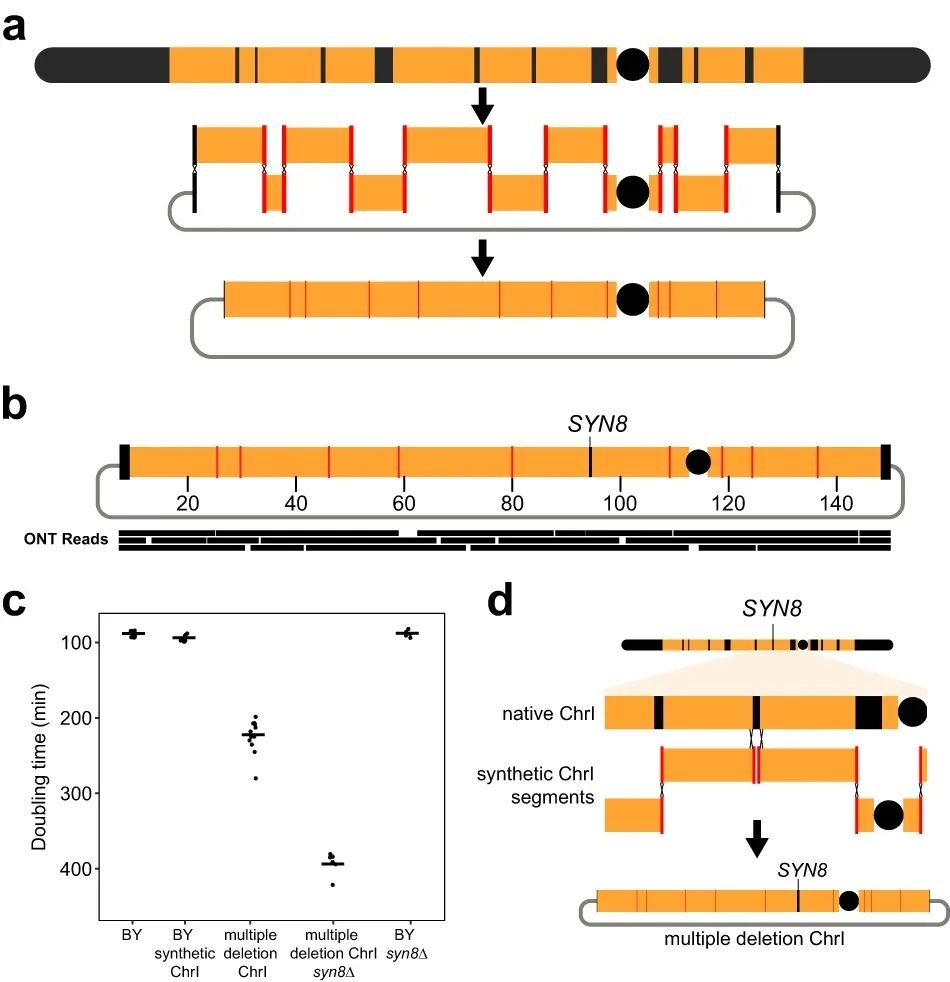
图4.使用CReATiNG进行多重删除。
综上所述,研究团队开发了CReATiNG技术,能够使用天然成分构建具有不同设计的合成染色体。CReATiNG使用天然染色体的克隆片段,与比从头合成染色体方法相比,更简单且更具成本效益。总之,CReATiNG技术的出现为合成生物学领域带来了新的里程碑,不仅能够显著推进基因工程的发展,还为医学、生物技术、生物燃料生产乃至太空探索等领域带来了巨大的潜力。
参考文献:
Coradini ALV, Ne Ville C, Krieger ZA, et al. Building synthetic chromosomes from natural DNA. Preprint. bioRxiv. 2023;2023.05.09.540074. Published 2023 May 9. doi:10.1101/2023.05.09.540074


