最新Nature Nanotechnology:纳米机器人,治疗膀胱癌!
时间:2024-01-26 19:20:50 热度:37.1℃ 作者:网络
膀胱癌在全球范围内仍然是一个重大的健康问题。在诊断阶段,大约75%的病例是非肌肉侵袭性膀胱癌,通常通过膀胱内注射免疫治疗剂(BCG)和化学治疗剂(丝裂霉素C)治疗,但这些治疗方法存在不良副作用,并且疗效有限。由于膀胱癌患者需要经常进行膀胱镜监测和重新治疗,这使得膀胱癌成为最昂贵的恶性肿瘤之一。
传统治疗方法的疗效受到多种因素的限制,包括治疗剂的沉淀和持续添加新尿液,阻碍其均匀扩散到整个膀胱容积,以及在膀胱中的保留不良和对目标部位的弱粘附。相对于标准的非肌肉侵袭性膀胱癌治疗,还有一种非运动性BCG以外的理想治疗方法,即利用自主推进的纳米颗粒(以下称为纳米机器人)作为治疗剂的递送系统。这些纳米机器人通过其运动能力,能够在复杂的液体中导航,克服生物学基质的障碍,从而提高治疗剂的递送效果。
2024年1月15日,巴塞罗那科学技术研究所(BIST)的Samuel Sánchez和Julien Colombelli以及巴斯克研究与技术联盟(BRTA)的Jordi Llop合作,使用基于介孔硅的脲酶动力学纳米机器人,在膀胱癌的小鼠模型中进行了实验。在小鼠膀胱癌模型中,这些纳米机器人在体内和体外均显示出增强的积聚能力,通过正电子发射断层扫描等手段可见积聚量增加了8倍。无标光学对比方法证实了纳米机器人能够穿透肿瘤。将放射性碘131I标记的纳米机器人通过膀胱内给予放射性核素治疗,导致肿瘤大小减小约90%。因此,这项研究的结果表明,这种脲酶动力学纳米机器人可能成为治疗膀胱癌的高效递送纳米系统。该研究成果以“Urease-powered nanobots for radionuclide bladder cancer therapy”为题,发布在Nature Nanotechnology上。论文共同第一作者是华盛顿大学圣路易斯分校的Cristina Simó和巴塞罗那科学技术研究所(BIST)的Meritxell Serra-Casablancas。

【脲酶动力学纳米机器人的制备和表征】
采用改良的Stöber方法,通过氨基丙基三乙氧基硅烷(APTES)修饰MSNPs表面,然后用戊二醛激活,并在MSNPs、脲酶(或BSA作为对照)和异质双功能聚乙二醇(PEG)分子之间形成交联。最终,纳米机器人表面还装饰有金纳米颗粒(AuNPs)。为了通过正电子发射断层扫描(PET)成像进行定量,纳米机器人和BSA-纳米颗粒(BSA-NPs)被标记上正电子发射剂18F(图1a)。
通过动态光散射监测纳米颗粒在制备过程中的水动力半径和表面电荷。结果显示,在每个功能化步骤中,由于在其表面添加分子而导致的轻微尺寸变化。Zeta电位的变化符合预期,最终达到-34.5 ± 1.3 mV。透射电子显微镜进一步确认了AuNPs在纳米机器人表面的分布(图1b)。
通过在PBS溶液中加入纳米机器人并观察其在有或无300mM尿素的情况下的动态行为,研究了纳米机器人的运动动力学。在有尿素的情况下,纳米机器人形成了活跃和有力的前沿和三维涡旋,而在无尿素的情况下,它们沉积在添加点附近,呈现出典型的二维分散模式。通过量化集体行为,研究者证明了纳米机器人在有尿素的情况下的不均匀分布和三维动力学,这符合纳米机器人集群行为的预期效果,有助于克服现有膀胱癌治疗的限制。最后,通过追踪初始均匀分散在PBS或300mM尿素中的2微米示踪粒子,研究者展示了纳米机器人对质量传输的影响。在PBS中,集群通过被动扩散略微扩展,而在尿素中,纳米机器人显著增加了示踪粒子的位移,表现为轨迹模式和均方位移分析中的复杂3D轨迹(图1c)。
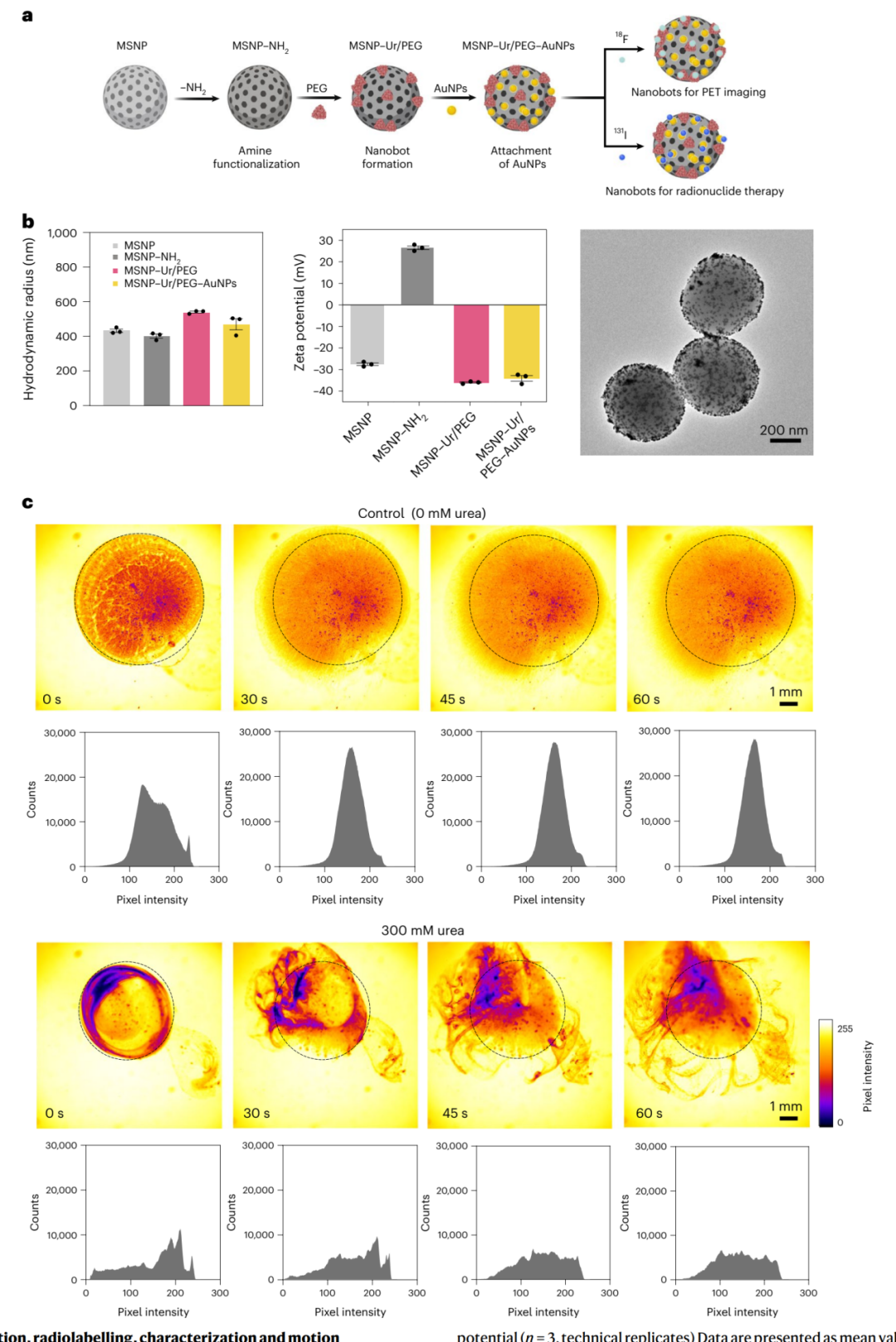
图1 | 脲酶动力学纳米机器人的制备、放射标记、表征和运动动力学。
【纳米机器人在膀胱癌原位小鼠模型的体内积聚】
使用原位同基因小鼠模型来评估纳米机器人达到肿瘤部位的能力。该模型广泛应用于治疗实验中,允许肿瘤在解剖学上代表性的组织微环境中生长。通过在细胞植入后的第7天和第14天使用MRI监测肿瘤体积,DW-MRI图像清晰显示了膀胱上部的肿瘤(图2a)。小鼠根据肿瘤体积随机分为四组。通过PET成像后使用hematoxylin-eosin染色对肿瘤进行了组织病理学评估,确认了肿瘤存在于肿瘤小鼠的lamina propria下,并向膀胱腔内生长。对于组间的差异未观察到明显变化(图2b)。2D DW-MRI通过膀胱显示肿瘤呈高信号(图2c)。
通过PET成像结合CT进行解剖学参考,研究了纳米机器人在膀胱肿瘤中的积聚情况。PET分析显示,非肿瘤小鼠中纳米机器人的放射性信号极低,而在肿瘤小鼠中,放射性信号与MRI确定的肿瘤位置相对应。仅在纳米机器人和300mM尿素注射的动物中,PET图像显示大量的放射性示踪剂在肿瘤中积聚。相对于对照组和其他组,尿素中注射的18F-纳米机器人显示更高的积聚(图2d,e)。通过将放射性信号积聚标准化为肿瘤体积,证实了在尿素中注射的18F-纳米机器人(组4)相对于其他组(组1、2和3)具有显著更高的肿瘤摄取量。结果表明,主动运动对于肿瘤积聚具有益处(图2f)。
通过对从肿瘤动物提取的尿液进行稳定性研究,证明了标记纳米机器人的放射性纯度在1小时后接近60%,而在超纯水和尿素溶液中的稳定性则在1小时后超过90%。通过进行体外电感耦合等离子体质谱(ICP-MS)分析来确定金的浓度,以确认PET信号是由颗粒而不是放射性同位素的分离引起的。PET和ICP-MS之间的相关性证实了在纯尿液中(体内)纳米机器人的部分放射性标记分离并不影响对肿瘤积聚的确定(图2g)。
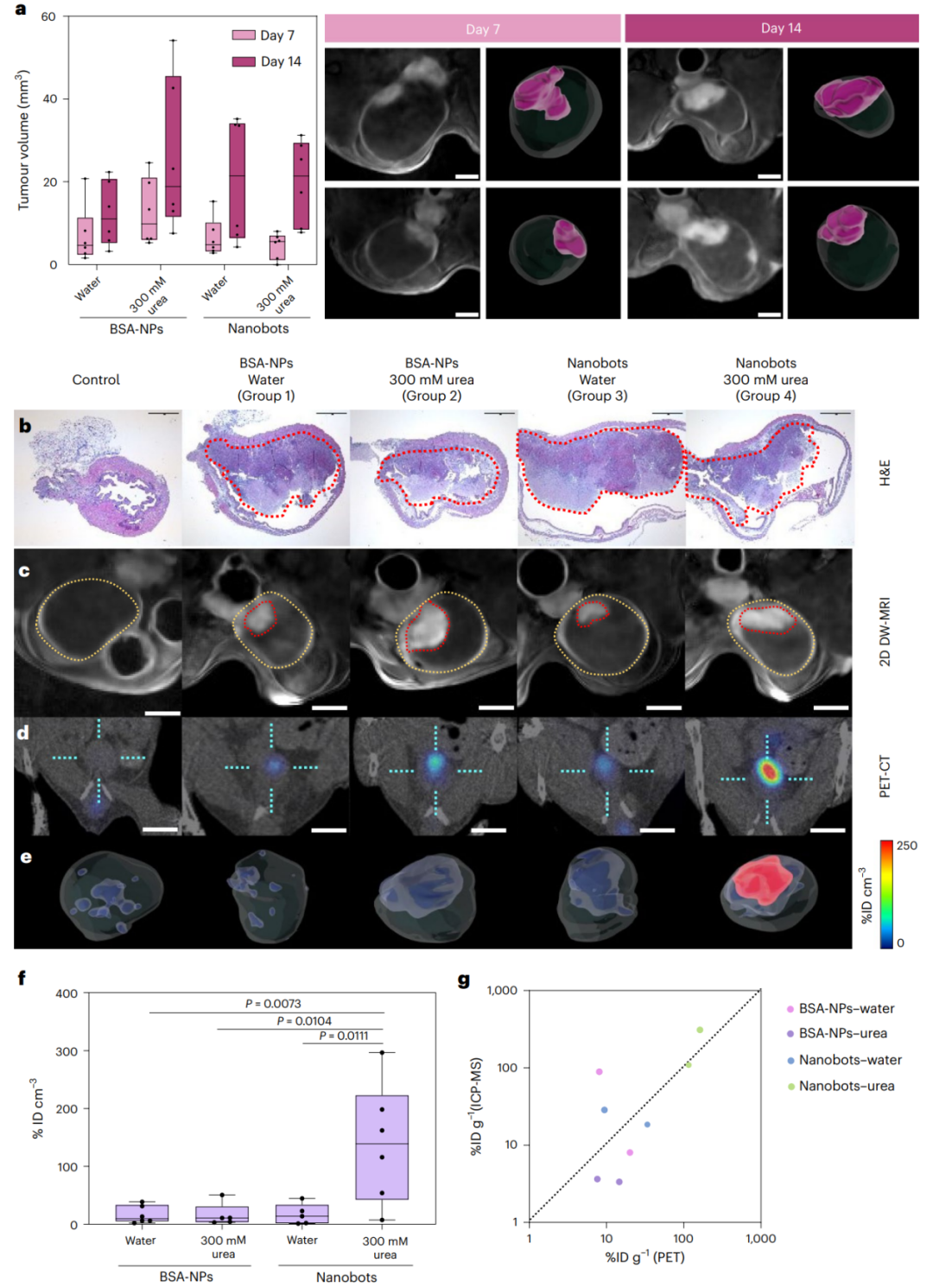
图2 | 纳米机器人在膀胱癌原位小鼠模型中的体内积聚研究。
【散射光片显微镜在体外定位纳米机器人】
使用散射光片显微镜技术(sLS)在体外定位纳米机器人的位置。为了超越PET的已知限制,我们采用光学显微技术来确定纳米机器人在膀胱中的位置并评估其对肿瘤的穿透能力。传统的共聚焦显微镜成像无法用于纳米机器人的检测,因为膀胱组织和肿瘤的自发荧光水平非常高,会淹没纳米机器人的内在荧光和二次荧光标记。因此,我们假设通过弹性散射可以检测到纳米机器人,并通过散射光片显微镜(sLS)来观察镀金纳米机器人,这是一种新兴的无标记成像方法(图3)。我们使用自定义的光片显微镜进行整个器官的成像,结合组织透明技术,可以克服组织切片的限制,以三维方式分析纳米机器人在肿瘤中的穿透情况。
接下来,我们应用了无标记的sLS技术,以高空间特异性检测和定位纳米机器人,并量化其在肿瘤中的穿透情况。结果显示,纳米机器人在肿瘤表面积聚更为明显,数量约为在健康尿道上皮的四倍(图3f-k)。尽管纳米机器人的强度随着深度的增加而减少,但穿透能力仍然显著,纳米机器人在肿瘤中的穿透深度和占有率明显高于健康的尿道上皮(图3g)。整体而言,这些结果证实了纳米机器人在肿瘤中的积聚和穿透,为对其在膀胱癌治疗中的潜在应用提供了支持。
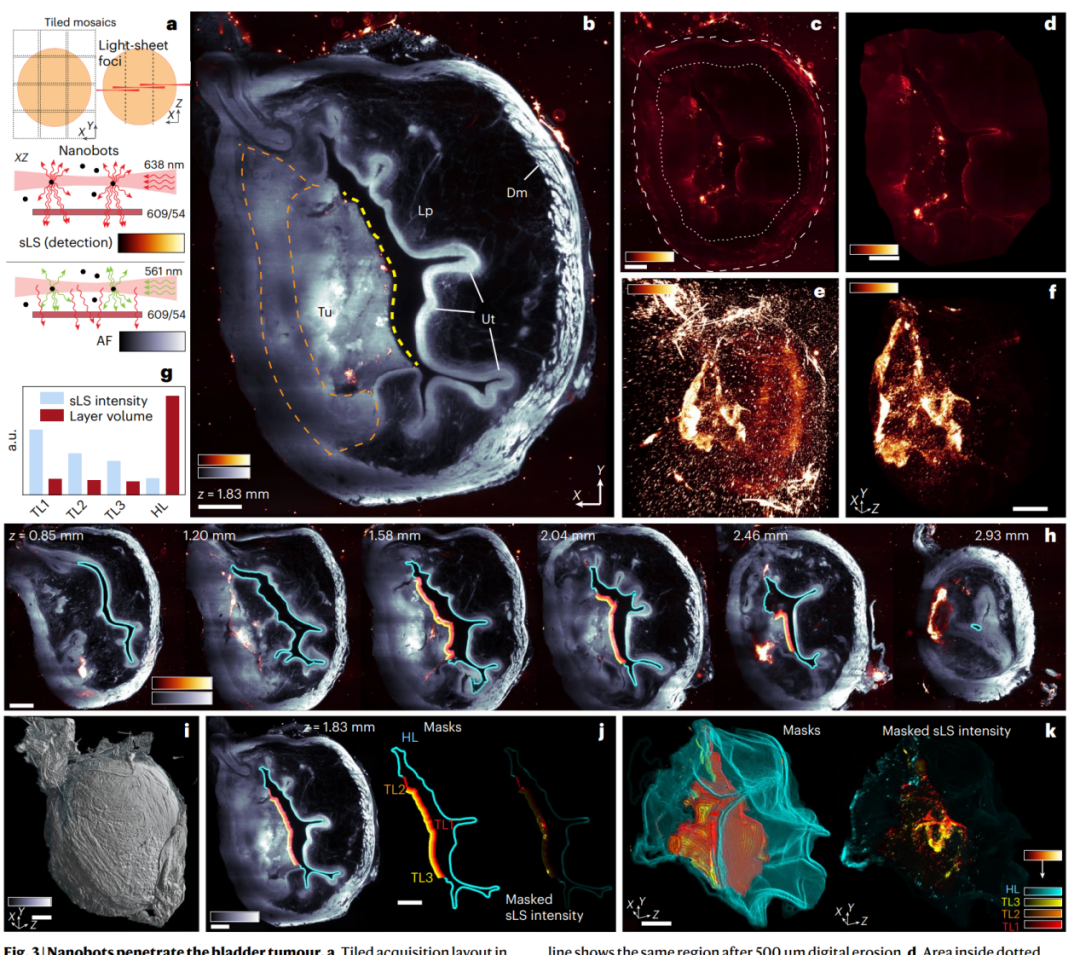
图3 | 纳米机器人穿透膀胱肿瘤。
为了验证我们对PET-CT和MRI图像的解释,我们分析了清晰膀胱中的五种条件下sLS信号:(1)有肿瘤和尿素中的纳米机器人(图4a,b),(2)有肿瘤和水中的纳米机器人(图4c,d),(3)有肿瘤而无纳米机器人(图4e,f),(4)无肿瘤但有尿素中的纳米机器人(图4g,h),以及(5)既无肿瘤又无纳米机器人(图4i,j)。对膀胱内部组织中总的3D强度的比较(图4k,l)清楚地显示了当纳米机器人存在且在尿素中时(条件1和4),sLS信号明显。在没有纳米机器人或在水中有纳米机器人的情况下(条件2,3和5),信号强度同样很低,因此被识别为背景。结果证实,与水中的纳米机器人不同,尿素中的纳米机器人能够在小鼠膀胱内成功自行推进,到达肿瘤部位并大量积聚和穿透肿瘤组织。
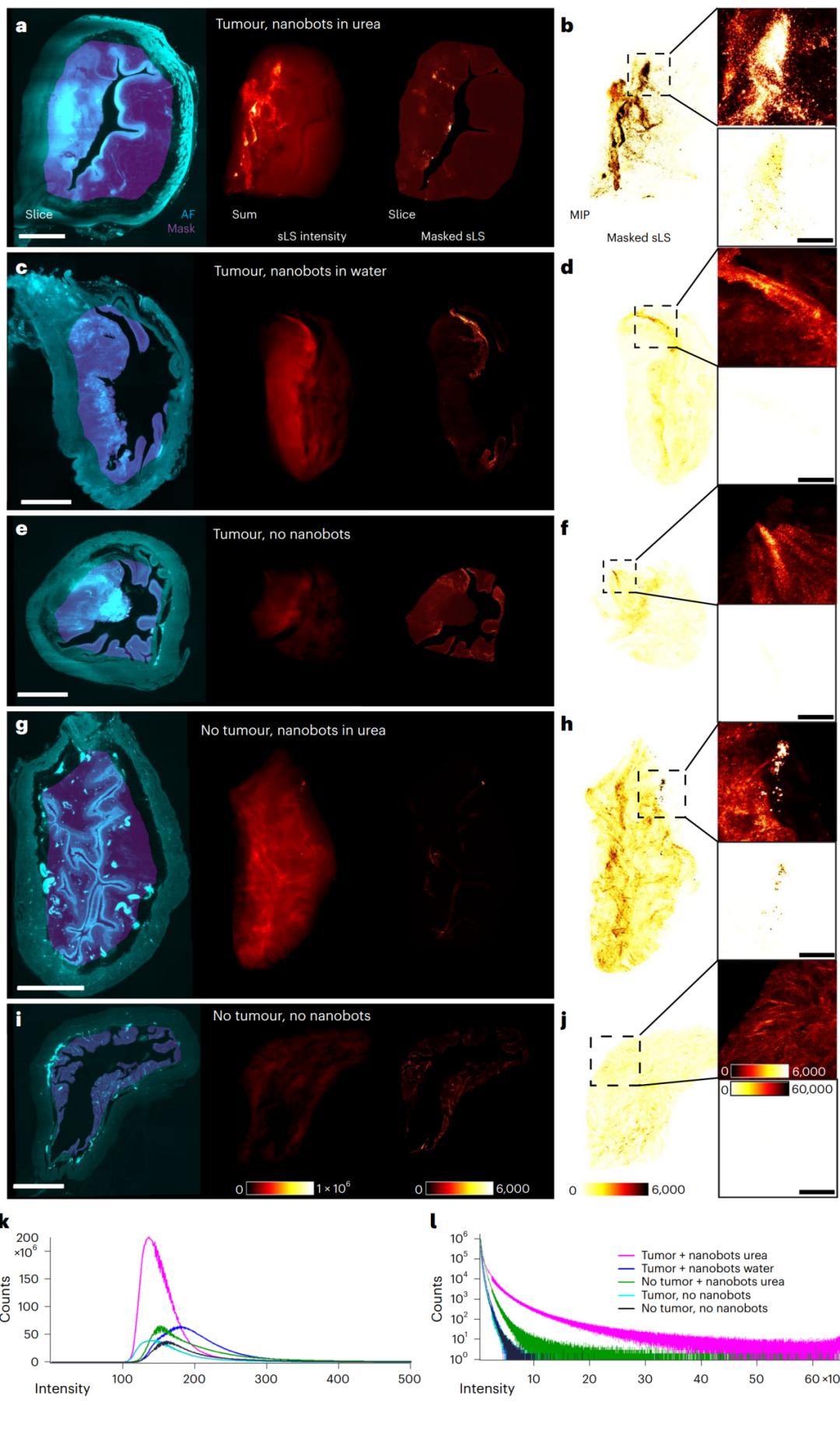
图4 | 比较膀胱组织中带有肿瘤的纳米机器人滞留。
【使用131I-纳米机器人进行放射性同位素疗法】
最后,我们利用纳米机器人的肿瘤积聚特性来评估它们的治疗效果。碘-131(131I)是放射性同位素疗法(RNT)中最常见的放射性同位素之一,具有良好的性质:长半衰期(8.01天)和发射β粒子(最大能量0.61MeV),在组织中的穿透范围为0.8mm。我们成功实现了131I放射标记(图1a),具有高放射化学产率(73±10%)和极好的放射化学纯度(≥99%)。标记的纳米机器人在37°C的水和300mM尿素中稳定1小时,且没有酶活性的下降。
为了评估RNT的疗效,我们采用相同的小鼠模型和MRI方案,将动物分为实验组进行尿道内注射纳米机器人(图5a)。所有组的动物都接受了相应治疗物的膀胱内注射,使纳米机器人含有的溶液在膀胱内孵育1小时。然后,排空膀胱,并让动物从麻醉中恢复。在治疗后的一周内,没有动物表现出任何明显的与辐射有关的副作用或明显的体重变化(图5b)。治疗前获取的MRI图像显示膀胱的上部存在肿瘤(图5c)。在高剂量下,尿素中和水中的131I-纳米机器人治疗后,肿瘤大小显著减小(分别约为0.54和0.27NTV)(图5d)。在尿素中注射高剂量的131I-纳米机器人的RNT效果更为显著,肿瘤体积减少近90%(图5e)。
总之,即使使用低剂量的131I标记的纳米机器人也能够净化肿瘤体积,因为它们的主动运动导致肿瘤积聚更多(图5d)。低剂量下的这种疗效应有助于将具有治疗性放射性同位素的纳米机器人转化为临床应用。高剂量的131I-纳米机器人导致肿瘤体积更显著的减小,动物能够保持其体重在标准范围内,表明没有严重的不良影响。
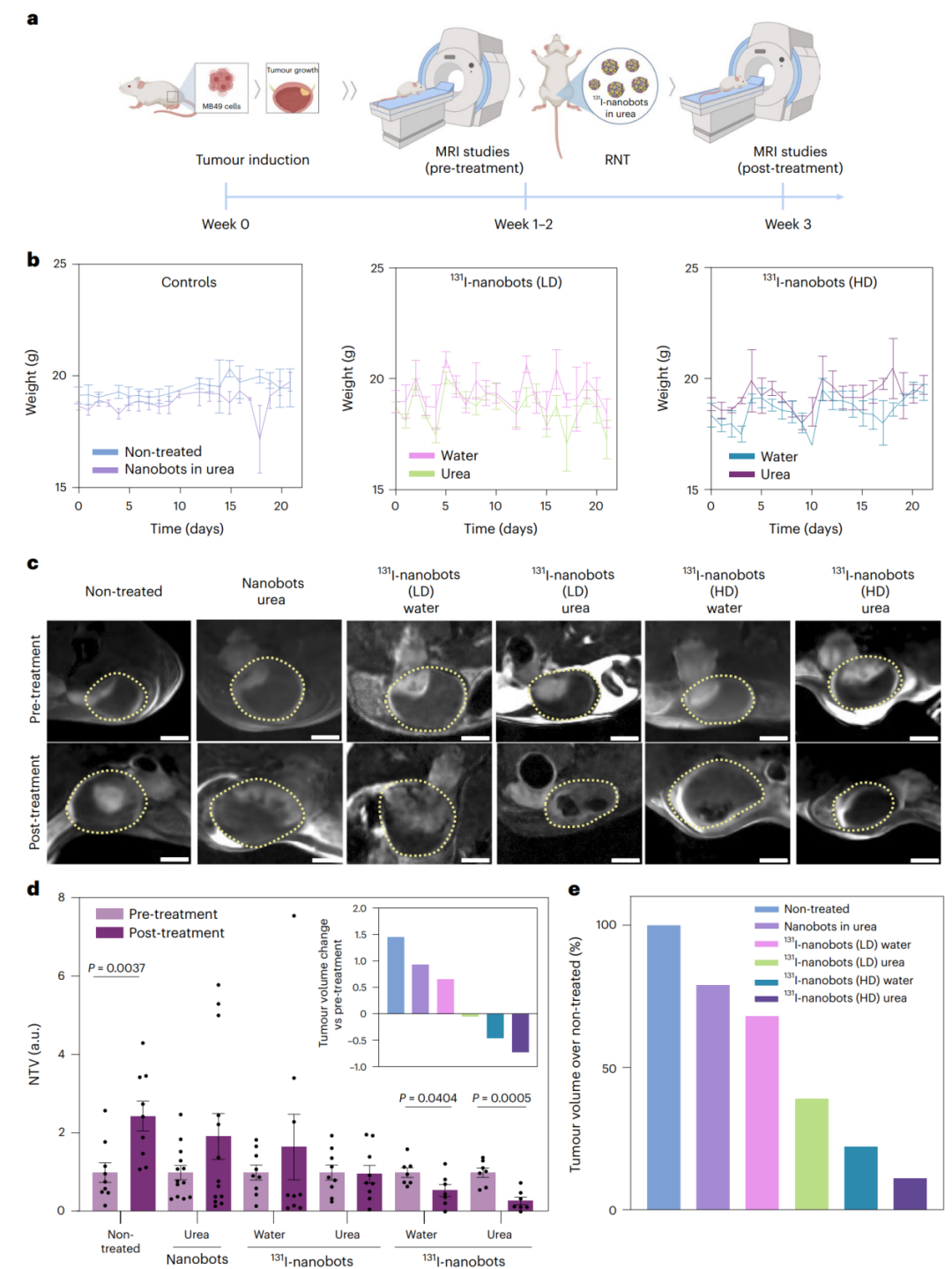
图5 | 利用131I-纳米机器人进行放射核素治疗的膀胱癌原位小鼠模型研究。
【小结】
在本研究中,我们通过在膀胱癌原位小鼠模型中进行膀胱内注射,成功地展示了脲酶动力纳米机器人在肿瘤部位的有效积聚。通过采用多种成像技术,包括PET结合MRI、ICP-MS和sLS成像,我们详细研究了这些纳米机器人的运动特性和在肿瘤组织中的分布。结果表明,具有自主推进能力的纳米机器人在肿瘤内显示出显著的积聚,而其优越的运动能力使得放射性标记的纳米机器人在低剂量下即可产生肿瘤治疗效果。这为膀胱癌治疗提供了一种新的、高效的载体,具有潜在的临床应用前景。这项研究的结果为进一步开发和实际应用脲酶动力纳米机器人在膀胱癌治疗中提供了坚实的基础。
原文链接:
https://doi.org/10.1038/s41565-023-01577-y


