【Haematologica】安刚/邱录贵团队证实NDMM中MAF易位仍是强有力的预后因素
时间:2024-01-26 19:19:06 热度:37.1℃ 作者:网络
NDMM中MAF易位
多发性骨髓瘤(MM)治疗已取得显著进展,从而提高了总生存期,但高危患者获益有限,仍存在未满足的医疗需求。新诊断 MM患者中约6%携带t(14;16)和t(14;20),分别可导致 cMAF和 MAFB原癌基因上调。t(14;16)已作为高危染色体异常(HRCA)纳入修订版国际分期系统(R-ISS),但由于其罕见性和与其他染色体异常的频繁共存,其不良预后意义受到质疑。此外,国际分期系统的第二次修订(R2-ISS)未将t(14;16)归为高危的独立标志物。此外,虽然缺乏大型数据库,但现有研究支持t(14;20)作为不良因素,且其预后意义与t(14;16)相同。阿肯色大学工作组发现,包括t(14;16)和t(14;20)在内的 MAF易位组(定义为 MF组)可导致共同的下游靶点失调,并与早期复发相关。
为评估t(14;16)/t(14;20)的预后价值,并探索其与其他染色体异常的相关性,中国医学科学院血液病医院(中国医学科学院血液学研究所)安刚/邱录贵教授团队开展一项回顾性分析,基于中国首个前瞻纵向血液病队列的830例新诊断多发性骨髓瘤(NDMM)患者,研究结果近日发表于《Haematologica》。

研究结果
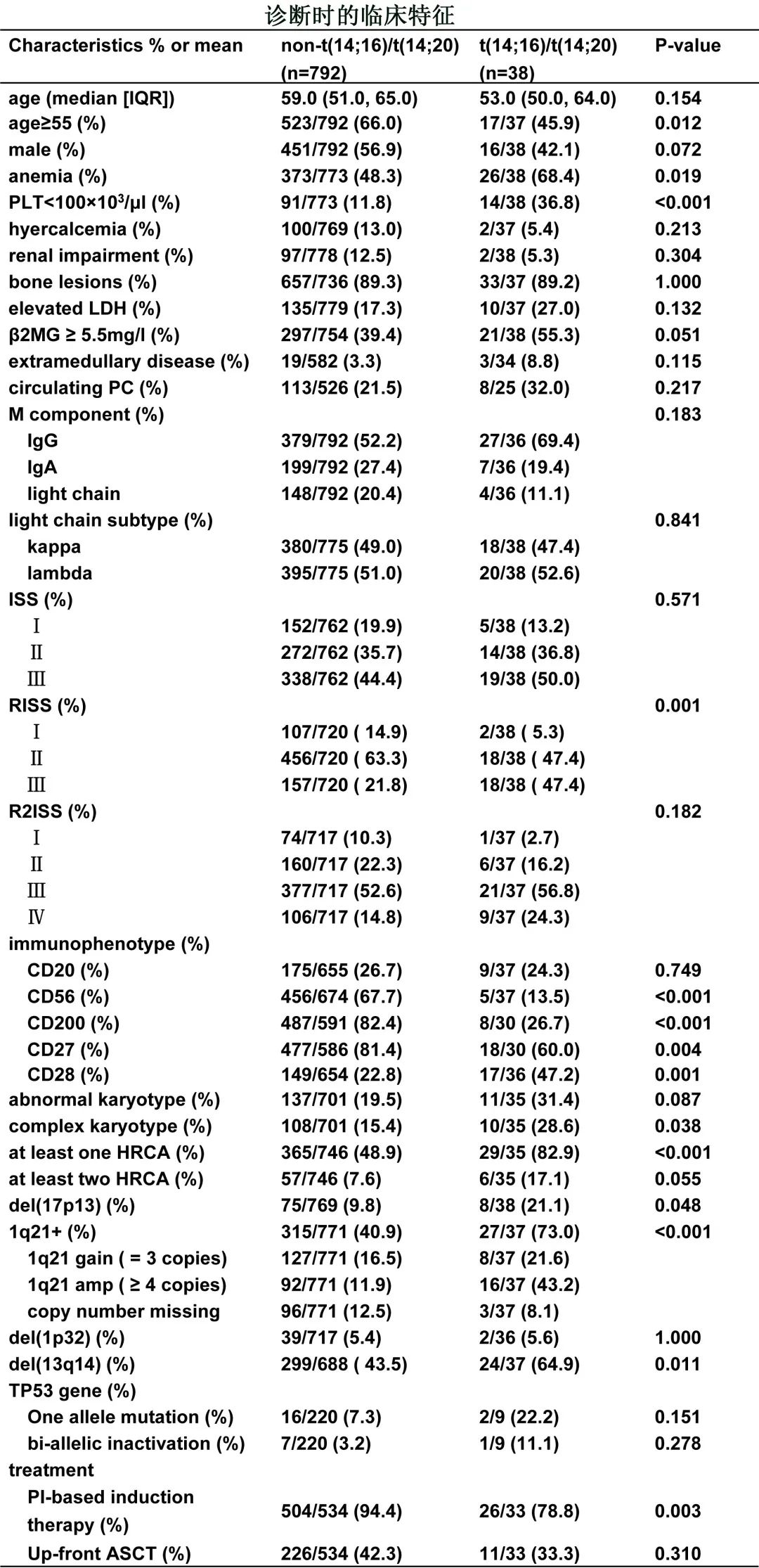
研究纳入国家血液学疾病纵向队列(NICHE,NCT04645199)的 MM数据库2013.1-2021.6期间共830例NDMM患者,其中包括34例t(14;16)患者、4例t(14;20)和792无t(14;16)或t(14;20)。
82.9%(29/35)的t(14;16)/t(14;20)阳性患者在诊断时携带至少一种其他HRCA,包括gain/amp(1q21)(t[14;16]/t[14;20]阳性患者中73.0%vs阴性患者40.9%,p<0.001)、del(17p)(21.1%vs 9.8%,p=0.048)、del(1p32)(5.6%vs 5.4%,p=1.000)。值得注意的是,在t(14;16)/t(14;20)患者中,合并存在1q21+的患者更多为拷贝数≥4(43.2%vs 11.9%)。此外,阳性组的 TP53突变比例略高(22.2%vs 7.3%,p=0.151),TP53双等位基因失活的发生率也较高(11.1%vs. 3.2%,p = 0.278),但样本量较小(下表)。
关于t(14;16)/t(14;20)阳性 MM细胞的特异性免疫表型特征。在阳性组中,37例患者中仅5例(13.5%)为CD56阳性表达,显著低于阴性组(p<0.001)。据报道,浆细胞白血病和髓外病变中CD56缺失的发生率较高。这些数据表明,MAF可能会赋予 MM细胞更强的侵袭性生物学,或可解释本研究中外周血浆细胞和髓外病变的比例略高。事实上据报告,髓外复发似乎更常见于 t(14;16)患者。
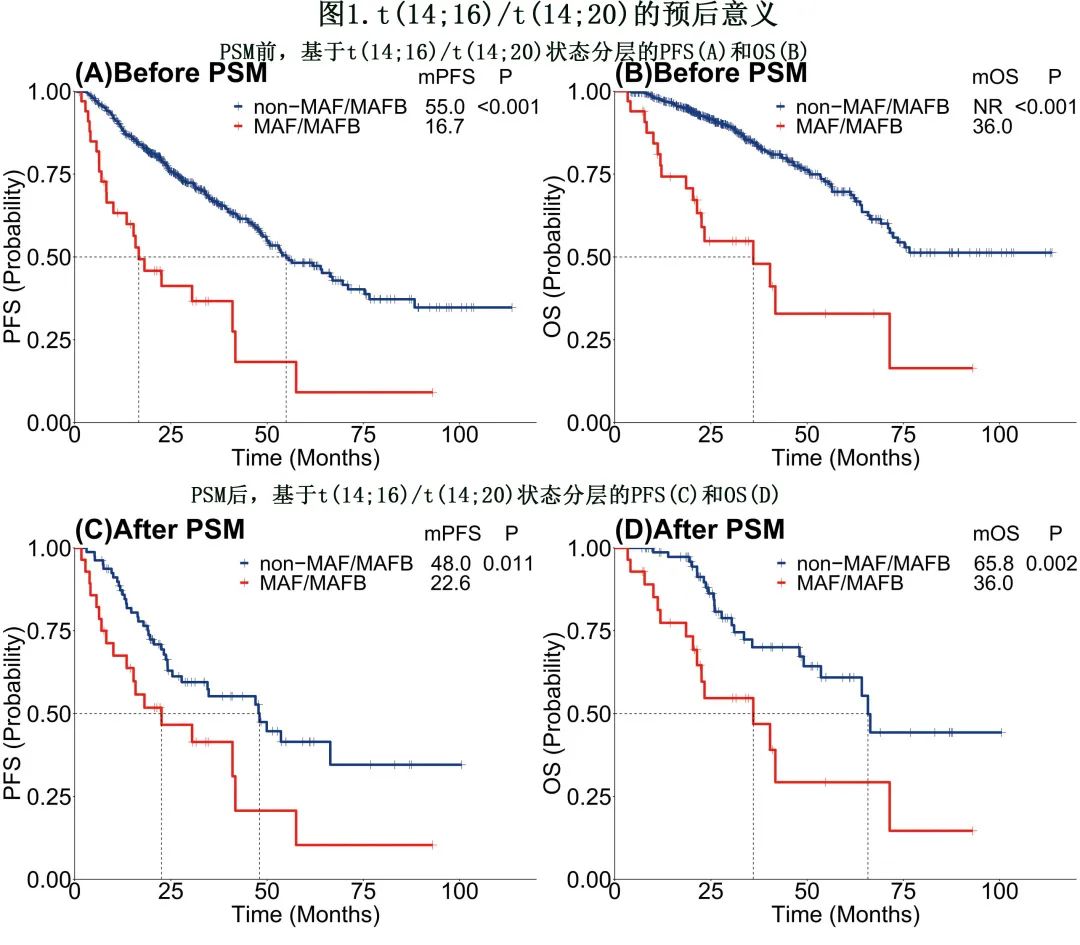
对接受标准治疗且随访状态可用的567例患者进行生存分析。中位随访29.5个月,t(14;16)/t(14;20)患者的中位无进展生存期(PFS)(16.7个月vs. 55.0个月,p<0.001)和总生存期(OS)(36.0个月vs.未达到,p<0.001)劣于无t(14;16)/t(14;20)的患者(图1A,B)。
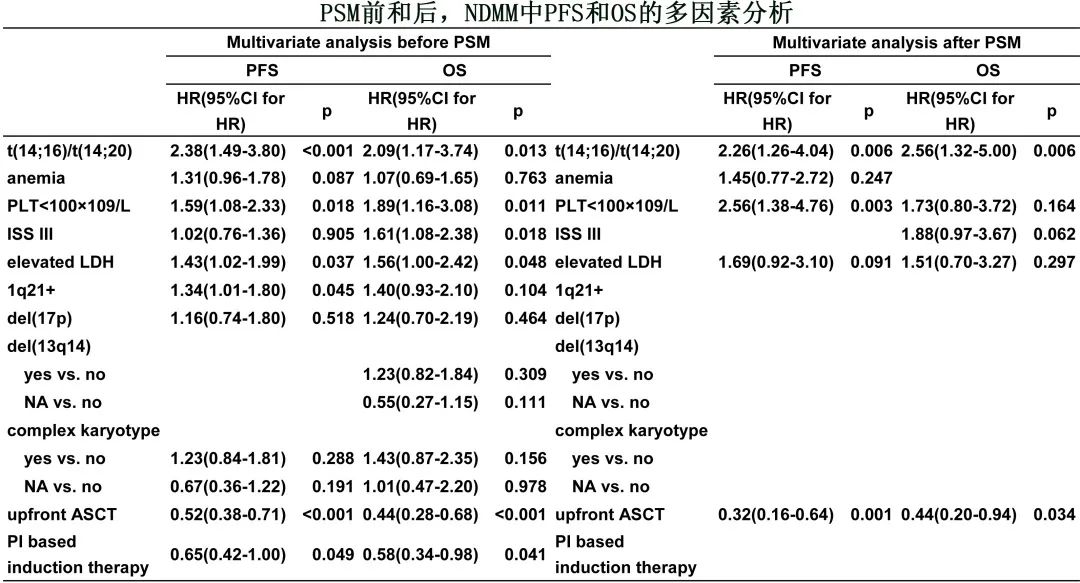
多变量分析后,t(14;16)/t(14;20)仍是PFS(风险比 [HR]=2.38,p<0.001)和OS(HR=2.09,p=0.013)的独立不良预后因素(下表)。进行倾向评分匹配(PSM)以实现两组的平衡。采用多因素 logistic回归模型估计每例患者的倾向性评分,采用最近邻匹配法进行1:4匹配,PSM后的多变量分析也得出相似结论。
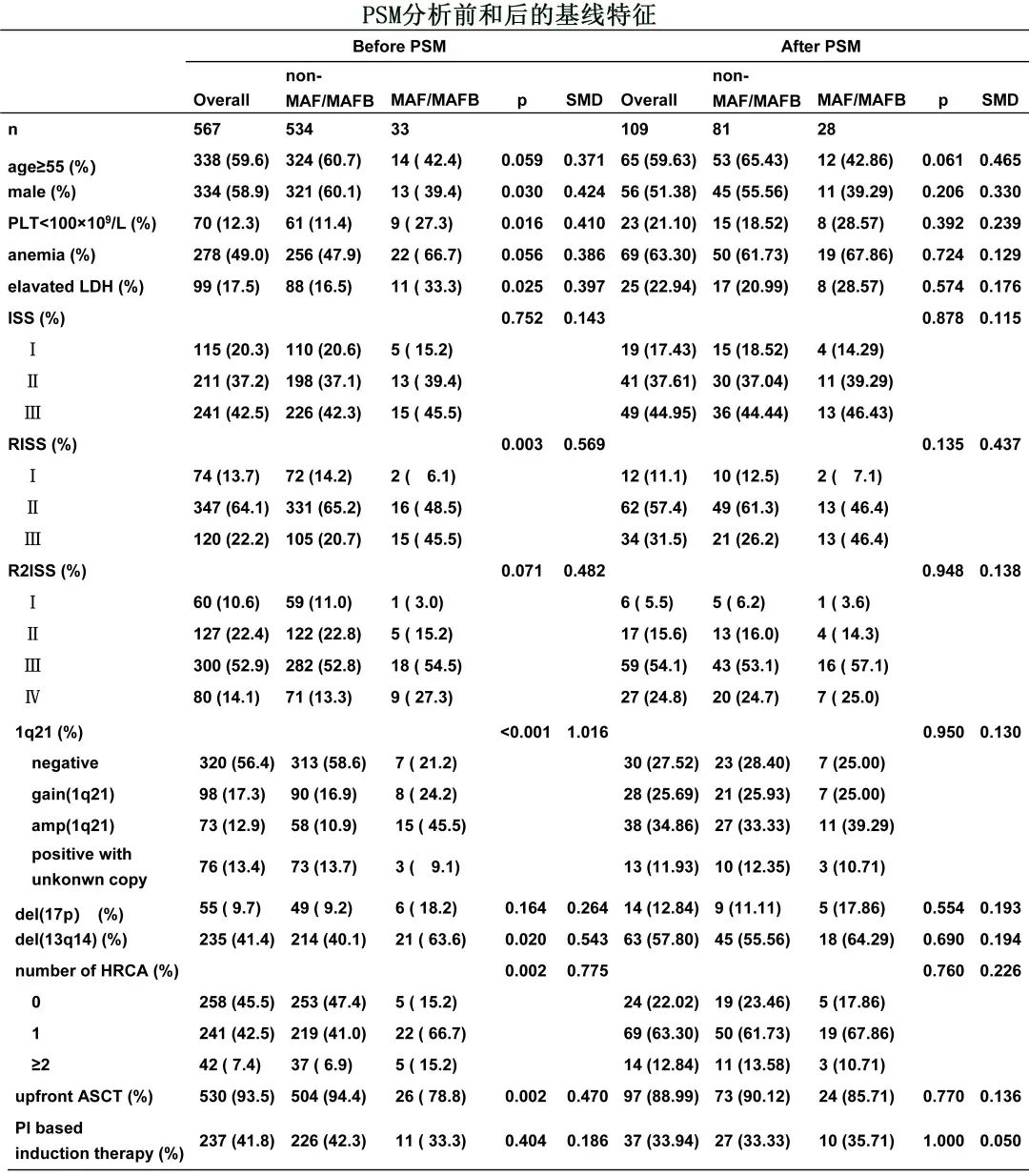
PSM后匹配109例患者(28例携带t(14;16)/t(14;20),81例不携带)。所有这些特征在两组之间平衡且相当(所有p>0.050)。正如下表所示,匹配队列为高危 MM人群。
PSM后,与非t(14;16)/t(14;20)组相比,t(14;16)/t(14;20)阳性组仍显示中位PFS(22.6个月vs. 48.0个月,p=0.011)和OS(36.0vs. 65.8个月,p=0.002)较差(图1C,D)。
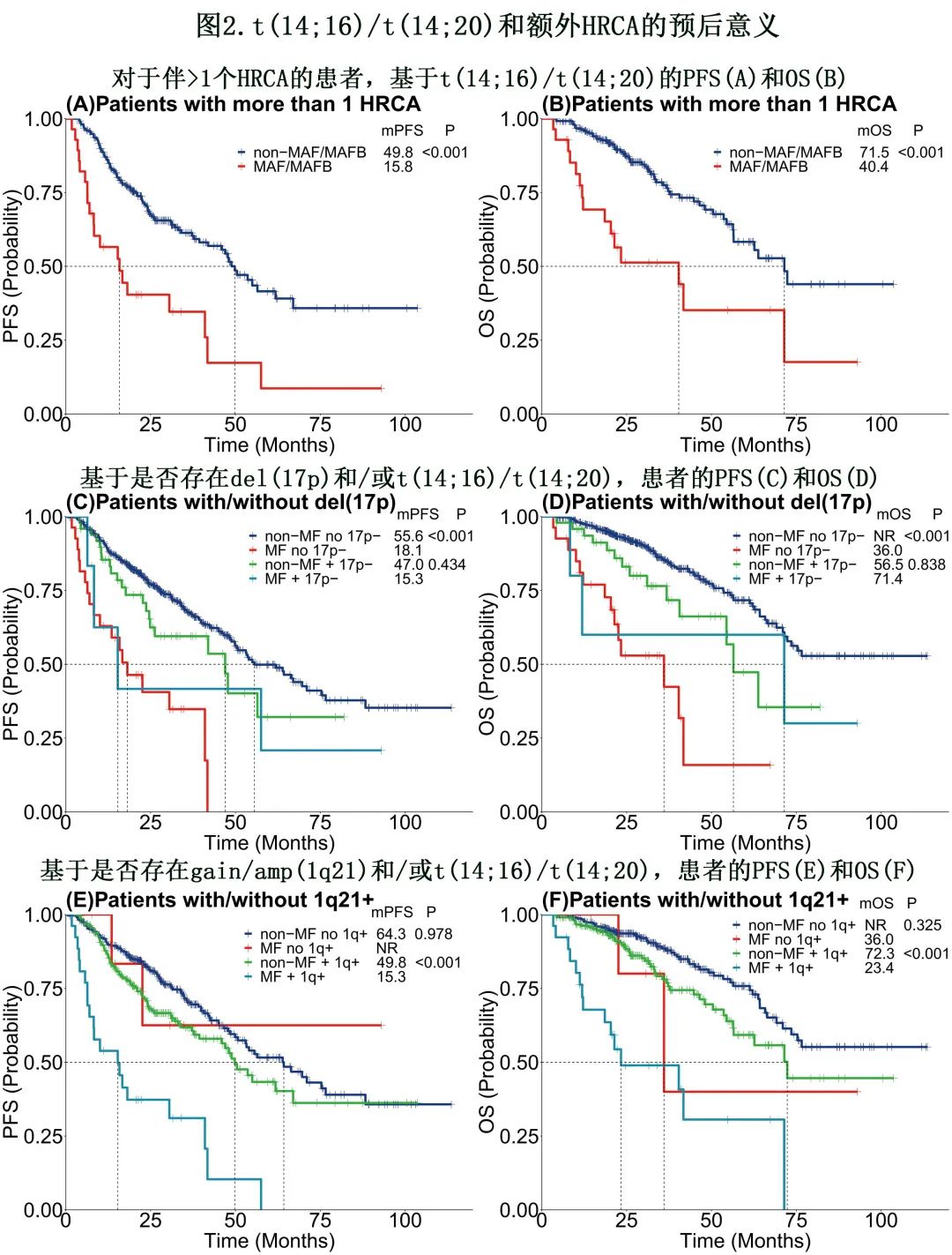
随后评估了t(14;16)/t(14;20)和额外 HRCA的预后意义。虽然无 HRCA队列中仅5例患者具有t(14;16)/t(14;20),但其 OS仍较低(未达到vs. 36.0个月,p = 0.003)。对于具有>1个 HRCA的患者(高危组),t(14;16)/t(14;20)可导致中位 PFS显著缩短(阳性组15.8vs.阴性组49.8个月;p<0.001)和中位 OS缩短(40.4个月vs. 71.5;p<0.001)(图2A,B)。即使对于伴>2个HRCA的患者,t(14;16)阳性患者(n=5)的中位 PFS(8.3vs. 47.0个月;p=0.031)和中位 OS(12.2vs. 54.4个月;p=0.240)也劣于阴性组(n=37)。对于 del(17p)患者,t(14;16)/t(14;20)的存在不会使 PFS和 OS恶化(p=0.434;p=0.838);但在gain/amp(1q21)阳性患者中,伴和不伴t(14;16)/t(14;20)患者的中位 PFS分别为15.3和49.8个月(p<0.001),中位 OS分别为23.4和72.3个月(p<0.001)(图2C-F)。
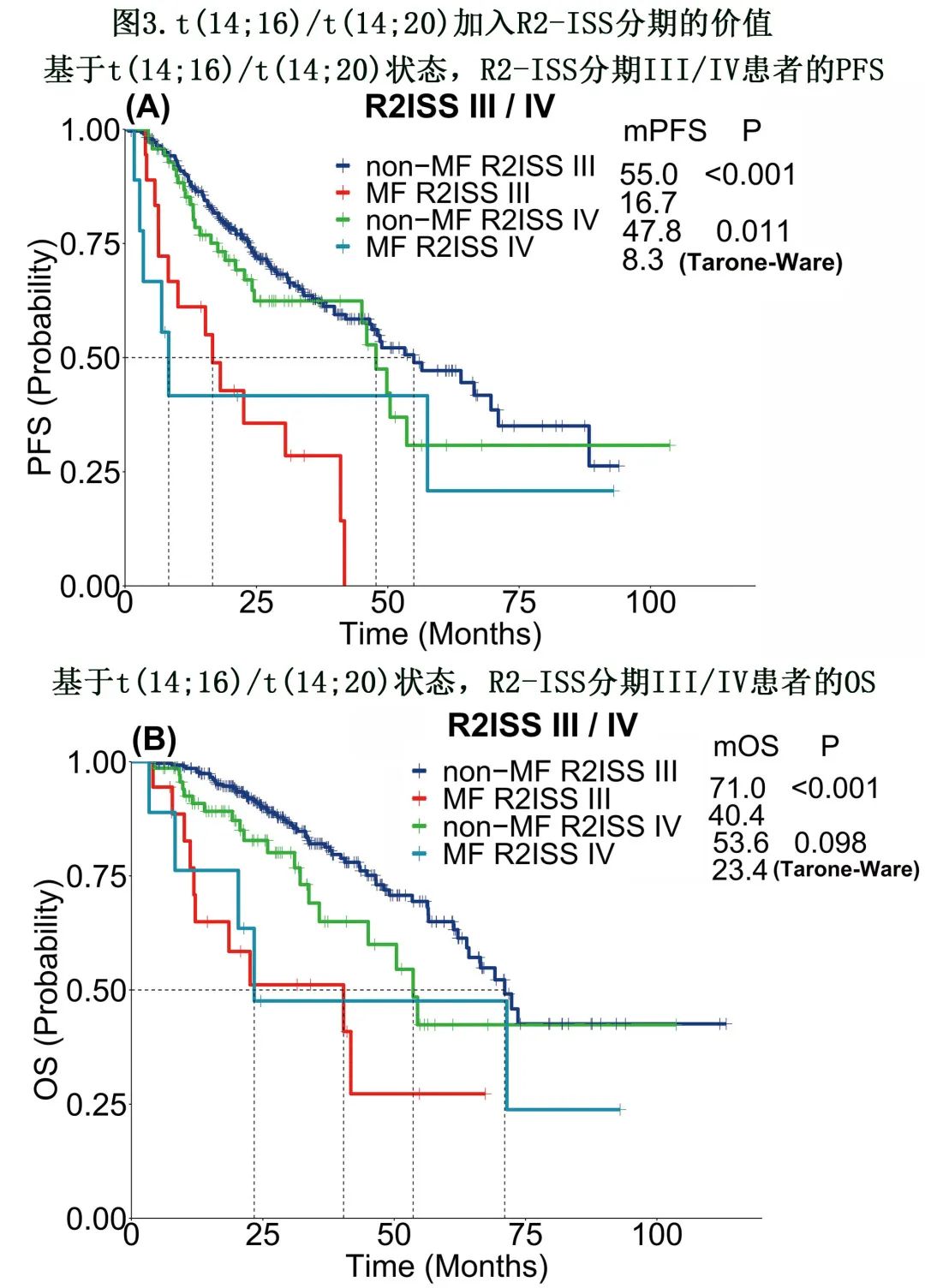
R2-ISS分期未纳入t(14;16),因为其罕见性和在多因素分析中对 PFS无显著性,但本研究显示,在 R2-ISS中纳入t(14;16)/t(14;20)能够实现更精确的风险分层,这可能利于随后的个性化治疗干预。特别是对于R2-ISS III期患者,存在t(14;16)/t(14;20)可导致 PFS和 OS的生存曲线分为两条显著不同的生存曲线(p<0.001)(图3)。
总结
该研究数据支持 MAF易位仍是NDMM中强有力的预后因素,即使常常合并其他染色体异常出现,从而强调了将其纳入风险分层系统的重要性。最近的一项研究在5141例患者中确定了169例伴t(14;16)的 NDMM患者,并强调t(14;16)的存在会恶化del(17p)或 gain/amp1q患者的预后,证实其在其他高危患者中增强疾病侵袭性的作用。
MAF易位患者可能代表超高危人群,疾病的快速进展可能影响患者随后接受新治疗方案,需要考虑高效治疗方案以延长疾病缓解。
参考文献
Liu Y, Lv R, Yan W, Xu J, Fan H, Li L, Cui J, Du C, Deng S, Sui W, Zou D, Xu Y, Qiu L, An G. MAF translocation remains a strong prognostic factor despite concurrent chromosomal abnormalities. Haematologica; https://doi.org/10.3324/haematol.2023.284666


