精准打击!帕米帕利+贝伐珠单抗破解RAD50突变晚期卵巢透明细胞癌治疗难题
时间:2023-12-11 10:36:58 热度:37.1℃ 作者:网络
卵巢透明细胞癌(OCCC)是一种相对罕见的上皮性卵巢恶性肿瘤,具有独特的临床、组织病理学和遗传特征。晚期OCCC患者的预后较差,并且对标准化疗耐药。靶向治疗为OCCC提供了一种新的治疗方法。本文报道了一名 45 岁晚期OCCC女性患者病例,该患者在标准治疗后出现复发。通过基因检测发现同源重组修复相关基因RAD50(RAD50-p.I371Ffs*8)发生移码突变。随后患者接受了PARP抑制剂帕米帕利联合贝伐珠单抗治疗,取得了部分缓解(PR)。与接受联合治疗前相比,患者的症状明显改善。截至目前,患者已随访半年多,生存良好,生活质量较高。该病例报告表明,帕米帕利靶向治疗是携带RAD50突变的晚期OCCC患者可行的治疗选择。
背 景
卵巢上皮癌(EOC)是死亡率最高的妇科恶性肿瘤。全球每年约有 230,000 例新病例和 15,000 例死亡。EOC的基因谱具有明显的异质性。EOC容易对标准化疗产生耐药性,复发率高。卵巢透明细胞癌(OCCC)最初被认为起源于中肾,直到 1973 年WHO才将OCCC认定为EOC的一个独特组织学亚型。OCCC是一种相对罕见的上皮性卵巢恶性肿瘤,具有独特的临床、组织病理学和遗传特征。尽管I期OCCC的总体预后良好,但晚期OCCC患者的预后非常差,这与对标准化疗的耐药性有关。靶向治疗为该罕见肿瘤提供了新的治疗选择——有研究报道称OCCC患者可以从靶向治疗中获益。在本文中,描述了一名复发性OCCC患者,通过基因检测发现同源重组修复(HRR)相关基因RAD50(RAD50-p.I371Ffs*8)发生移码突变。经过PARP抑制剂帕米帕利靶向治疗后,患者取得部分缓解(PR),临床症状明显改善。
病 例
患者女,45 岁,于 2020 年 11 月 1 日被诊断为OCCC(图1a)。患者否认家族史,2 年前确诊为慢性乙型肝炎,并接受恩替卡韦治疗。随后,患者于 2020 年 11 月 12 日在全身麻醉下接受了腹部卵巢癌根治手术。2020 年 11 月 23 日至 2021 年 4 月 14 日接受了标准辅助化疗,具体为 6 个周期的静脉输注白蛋白结合紫杉醇+腹腔灌注顺铂化疗。3 个月后未观察到肿瘤复发的迹象(图1b,c)。但在 2021 年 8 月,患者无明显诱因反复出现腹胀,再次到医院就诊。2021 年 8 月 13 日,腹部增强MRI提示存在大量腹水,腹壁、腹膜、肠系膜、肝、脾内多发结节以及肿块样异常信号,考虑为肿瘤转移(图1d,e)。患者肾功能处于失代偿期。肾功能参数如下:尿素,18.7 mmol/L;肌酐,312.8 μmol/L;尿酸,696.3 μmol/L;白蛋白,28.5 g/L;肾功能不全,4级;身体状况评分,2-3 。肿瘤标志物CA125显著升高。此外,血常规检查显示血红蛋白水平较低(66 g/L)。ECOG体力状态评分为 2。
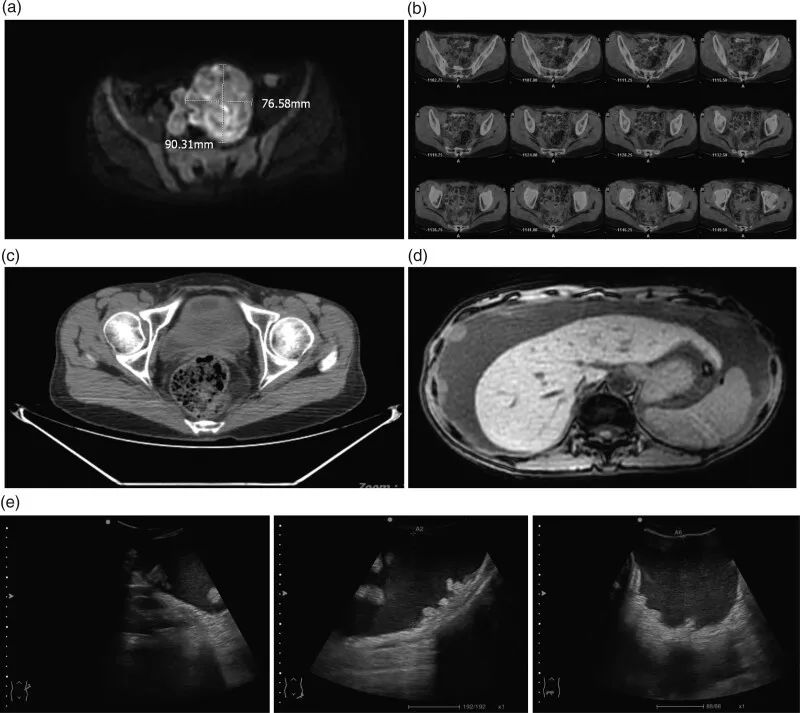
▲图1 影像学结果
(a)腹部MRI;(b)腹部PET-CT;(c)CT平扫;(d)复发后腹部CT;(e)复发后腹部超声
2021 年 8 月 24 日,对患者的腹水进行了基因检测。检测结果提示存在多种体系变异,包括PIK3CA p.H1047R和CTNNB1 p.d32Y,以及HRR相关基因RAD50移码突变(RAD50-p.I371Ffs*8)。肿瘤突变负荷(TMB)为 0.45 Muts/Mb。HLA 分型分析发现RAD50存在杂合突变,表明临床结果更好。然后,患者于 2021 年 8 月 25 日接受腹腔灌注化疗(PRAP抑制剂帕米帕利 20 mg po bid+抗血管生成药物贝伐珠单抗 300 mg ivgtt d1/q21d,以及5-FU 500 mg d1、d3、d5、d7 +贝伐珠单抗200 mg d7)。治疗一个周期后,腹水明显减少(图2)。肾功能指标较之前有所改善。ECOG体力状态为 1。2021 年 9 月 21 日至 2021 年 11 月 5 日继续第二至第四周期帕米帕利联合贝伐单抗治疗。四个周期治疗后,患者血常规恢复正常。ECOG体能状态为 0。随访至 2022 年 8 月 30 日,该患者身体状况良好(图3)。综上所述,PARP抑制剂帕米帕利联合抗血管生成治疗有助于治疗伴有广泛腹膜转移的晚期OCCC,患者的生活质量显著改善。
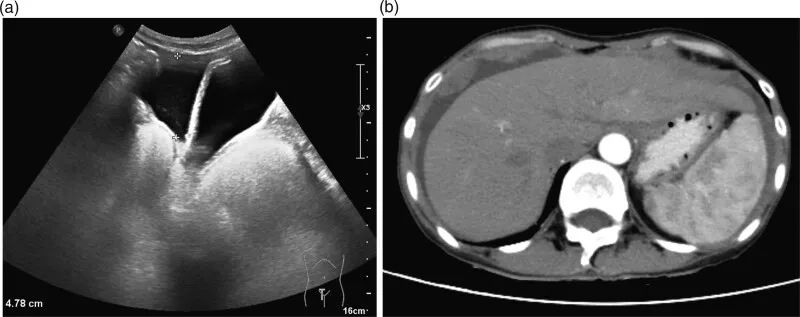
▲图2 靶向治疗后的影像学结果
(a)腹部超声;(b)腹部CT
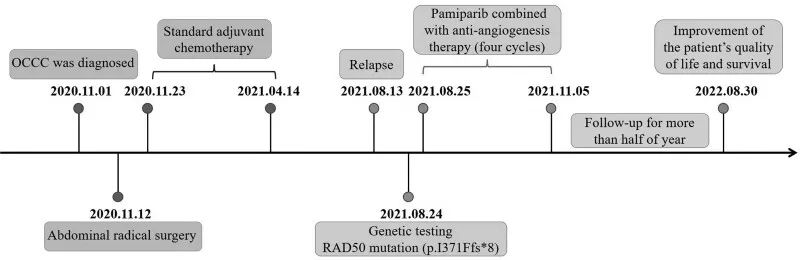
▲图3 治疗史
讨 论
OCCC是一种罕见的上皮恶性实体瘤,具有独特的临床、组织病理学和遗传特征。晚期OCCC患者的预后很差;因此,迫切需要研究有效的治疗策略。约 10% 的卵巢癌患者存在遗传风险,最早已知的易感基因是BRCA1和BRCA2。其它HRR通路相关基因(ATM、ATR、CDK12、FANCA、FANCD2 和 RAD50)也被发现在卵巢癌发病机制中发挥重要作用。由于对卵巢癌分子病因学的了解有限,如果仅检测BRCA1/2基因,将会漏检超过 5% 携带其它已知有害变异的患者。一项研究提示,同源重组相关基因与卵巢肿瘤对放疗和靶向药物的敏感性相关,可作为卵巢肿瘤个体化治疗的生物标志物。
基因检测揭示了有关药物靶点的大量信息,有助于精准治疗。RAD50参与DNA双链断裂修复,与MRE11和NBS1形成MRE11-RAD50-NBS1复合物。该复合物在DNA双链损伤修复、同源和非同源重组、检查点激活、端粒长度维持、确保DNA复制顺利和维持基因组稳定性等方面发挥着重要作用。RAD50基因被证明是卵巢癌的重要致病突变。2020 年,PARP抑制剂获批用于治疗包括RAD50在内的 14 个HRR相关基因突变的卵巢癌患者,这为治疗HRR突变的卵巢癌患者提供了潜在的治疗靶点和选择。
在本文病例报告中,OCCC复发后患者的ECOG评分为 2,并且由于标准化疗而导致肾功能严重受损。此时,患者面临着两难的境地:如果患者继续接受先前的化疗,可能无法耐受毒副作用;如果不进行化疗,生存时间可能会显著缩短,甚至死亡。在没有更好的解决方案的情况下,研究人员经过严格讨论,决定进行基因检测,希望能找到有价值的药物靶点。幸运的是,发现了RAD50突变,这是一种与DNA双链断裂修复密切相关的致病突变。随后应用了RAD50抑制剂帕米帕利与血管生成抑制剂贝伐珠单抗。患者取得显著的临床缓解,ECOG评分恢复正常,腹水量减少,肿瘤体积缩小,存活时间已超过半年。本文病例为复发性OCCC提供了可行的治疗策略。靶向药物基因检测为癌症患者带来了长期生存的希望。
HRR相关基因RAD50突变(RAD50-p.I371Ffs*8)是OCCC中的一种罕见突变,在接受帕米帕利联合贝伐珠单抗治疗后,患者的临床症状显著缓解。总体而言,基于基因检测的结果并结合匹配的靶向治疗是晚期或复发性OCCC的可选方案。
参考文献:
Huang X, He X, Li D, Chen X, Chen X. Advanced ovarian clear cell carcinoma with RAD50 mutation treated by PARP inhibitor pamiparib combined with anti-angiogenesis therapy: a case report. Anticancer Drugs. 2023 Feb 1;34(2):290-293. doi: 10.1097/CAD.0000000000001412. Epub 2022 Nov 15. PMID: 36729997; PMCID: PMC9815817.



