Nat Commun 雷鸣/谭晓秋/寿伟年团队合作原创发现Dbh+儿茶酚胺能心肌细胞
时间:2023-12-10 22:36:41 热度:37.1℃ 作者:网络
功能性心肌细胞的异质性在心脏发育过程中出现,这对于复杂且高度协调的心脏生理功能至关重要。通常认为我们对于心肌细胞的异质性已经有了比较全面的认识,然而最新的研究表明某些特殊的心肌细胞群的生物学和生理学特性以及它们起源尚未被完全理解。
2023年11月28日,由雷鸣、谭晓秋、寿伟年分别领导的牛津大学、西南医科大学及印第安纳大学团队合作在Nature Communications发表题为“Dbh+ catecholaminergic cardiomyocytes contribute to the structure and function of the cardiac conduction system in murine heart”的原创研究论文,该研究首次报道在小鼠心脏中发现了一类未被认识的具有表达编码多巴胺β-羟化酶的基因Dbh的心肌细胞群,命名为“Dbh+儿茶酚胺能心肌细胞(Dbh+ catecholaminergic cardiomyocytes, Dbh+-CMs)”。该研究同时揭示了Dbh+-CMs 主要分布在心脏传导系统,在形成心脏传导系统过程中与交感神经支配有密切关系,为哺乳动物心脏传导系统的发育和细胞异质性及心肌细胞的潜在儿茶酚胺能内分泌功能及其与自主神经支配之间的动态相互作用提供了新的见解。

研究背景
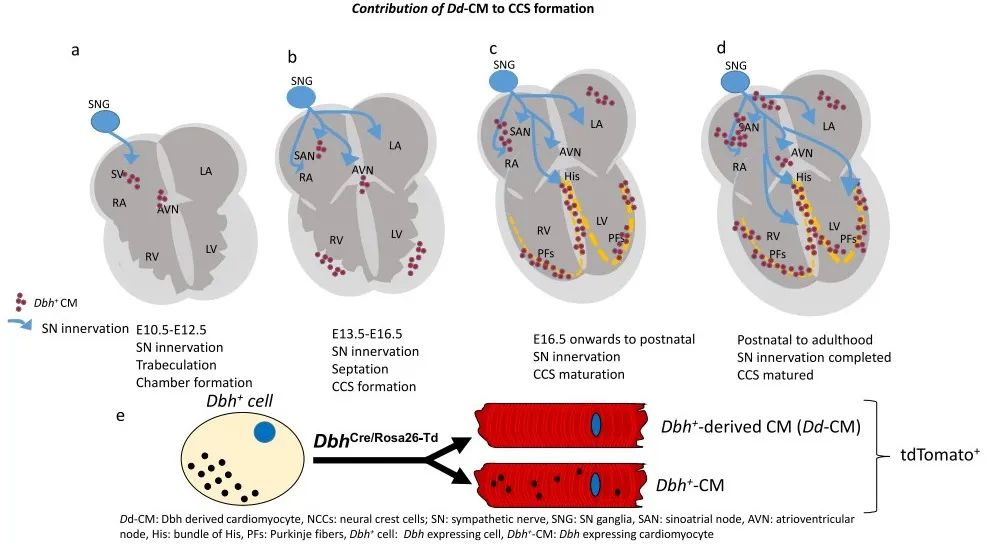
心脏传导系统(CCS)通过启动和协调心脏收缩,在心脏生理功能中发挥着重要作用。 CCS由一组独特且专门功能的心肌细胞组成,包括起搏组织窦房结(SAN)、房室结(AVN)和快速传导心室希氏-浦肯野系统。如果心脏传导系统发育出现问题会导致心律失常的发生,如Wolff-Parkinson-White综合征和缓慢的心律失常(房室传导阻滞和病态窦房结综合征)。深入理解心脏发育过程中传导系统的形态发生和成熟以及细胞类型异质性的生理学对于了解这些节律障碍性疾病的发病机制至关重要。然而,我们对不同心肌细胞类型起源,何时以及如何形成心脏传导系统不同组成部分的理解仍然十分有限。
文章主要发现
1. 单细胞和空间转录组分析确定了小鼠心脏中的Dbh+心肌细胞存在和其空间分布特征
首先,研究者对第8.5天(E8.5)、10.5天(E10.5)的胚胎和第12.5天(E12.5)、14.5天(E14.5)、16.5天(E16.5)、出生后第3天(P3)的全心进行单细胞RNA测序(scRNA-Seq),通过心肌细胞谱系追踪发现了先前未报道的Dbh+-CMs。Dbh+-CMs的主要类型为心房肌、心室肌、早期和更成熟的心室小梁、窦房结、房室结、心房传导系统和浦肯野纤维(PKJ),且在不同类型心肌细胞中Dbh+-CMs的比例存在差异。
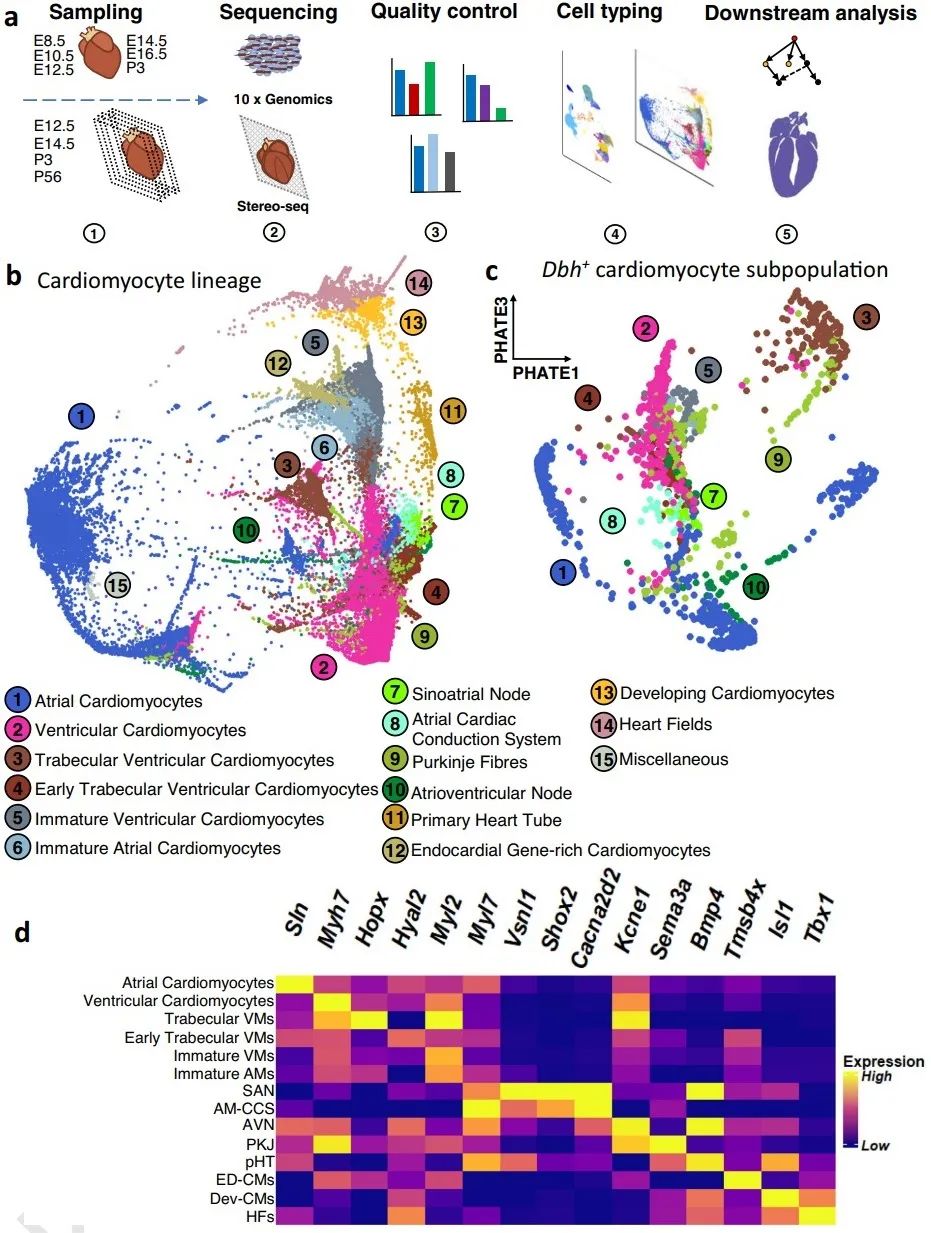
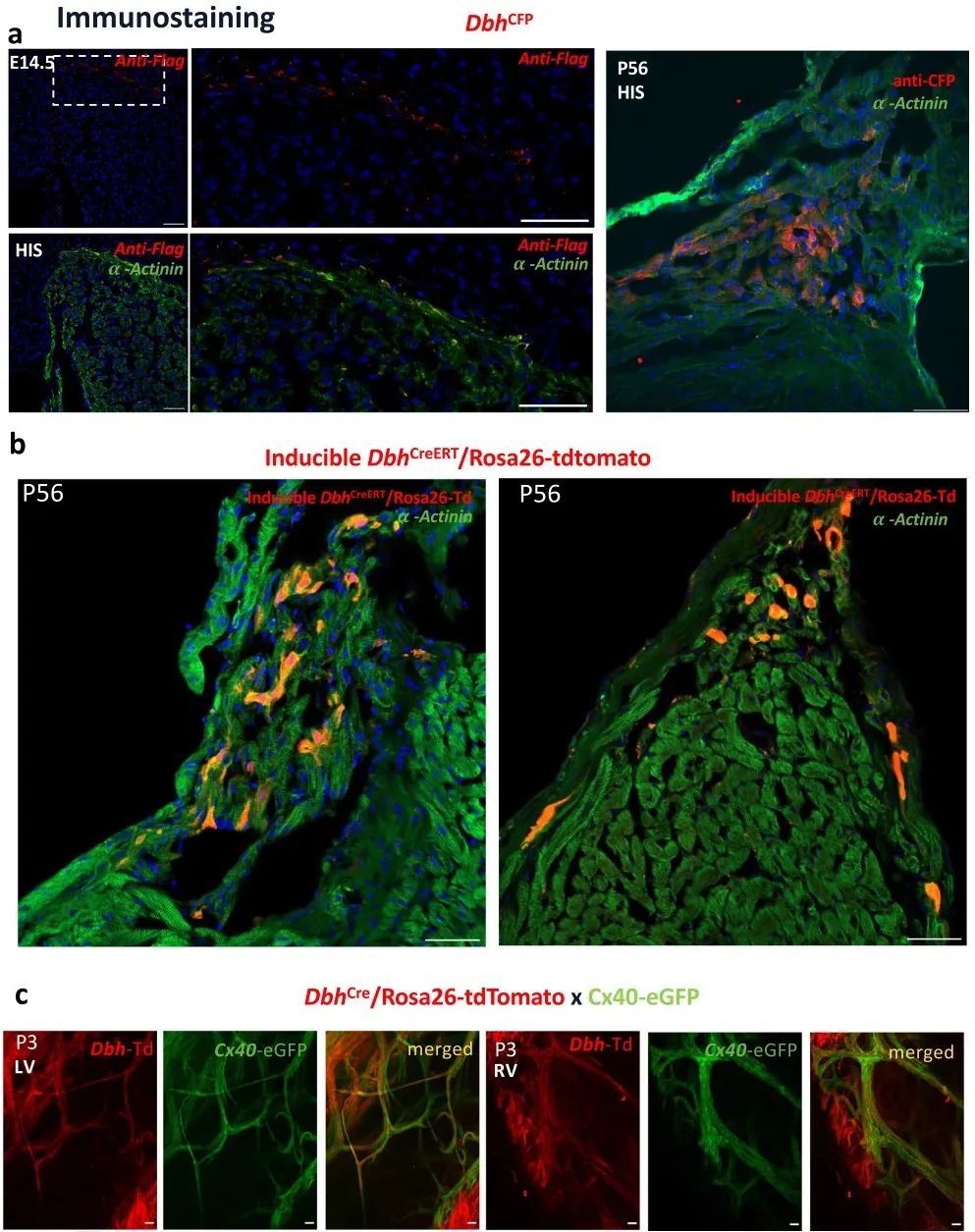
2. 谱系追踪遗传命运图谱和多重核酸原位杂交确定Dbh+心肌细胞参与心脏传导系统发育形成
为了验证Dbh+-CMs,研究者建立了DbhCre/Rosa26-tdTomato示踪小鼠模型,并采用纳米级分辨率空间转录组学技术(Stereo-seq)研究心脏中Dbh和Wpre (tdTomato衍生的转录物)的表达和空间分布,结果进一步证明Dbh在工作和非工作心肌细胞类型中都有表达,与CCS标记基因存在共定位,在心室中的CCS表达特别丰富。
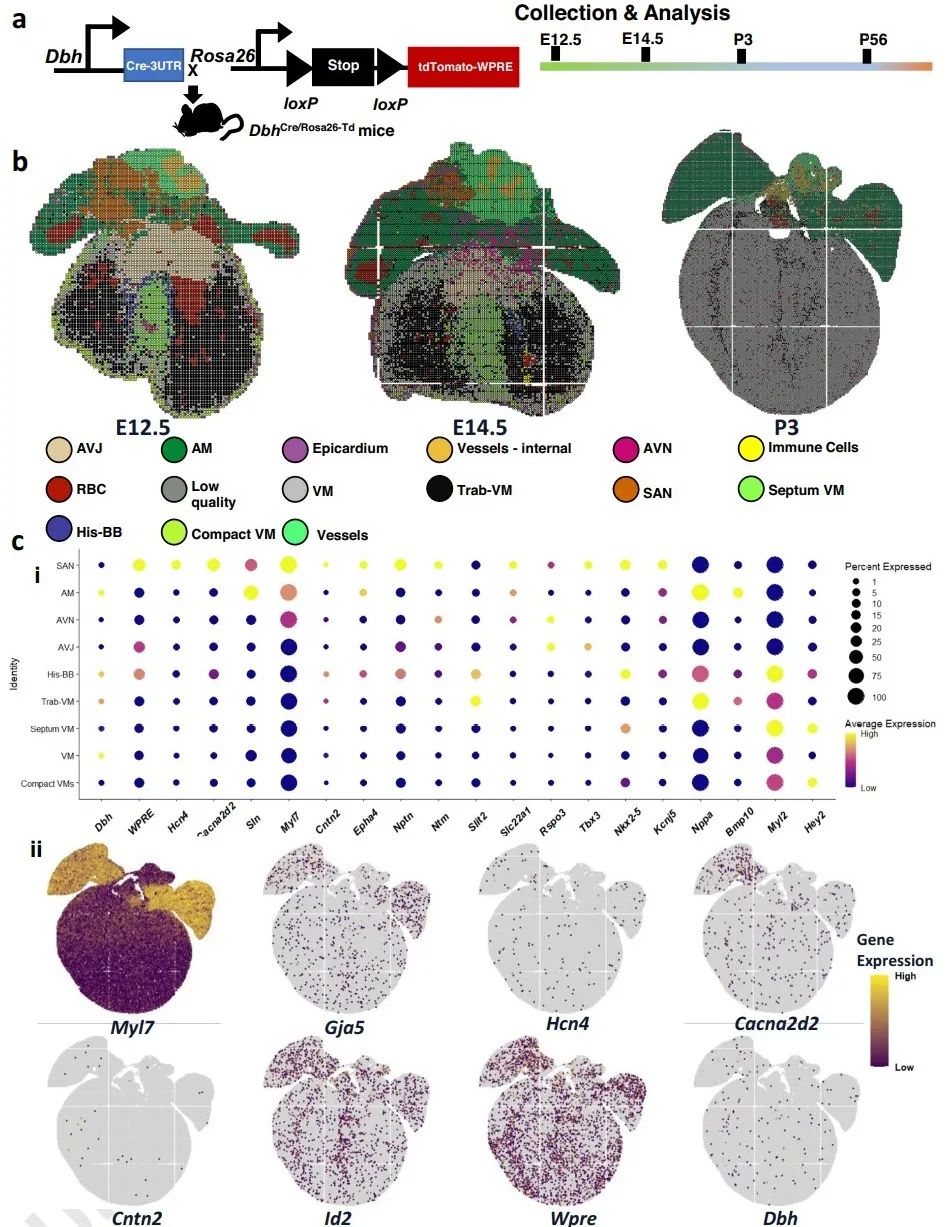
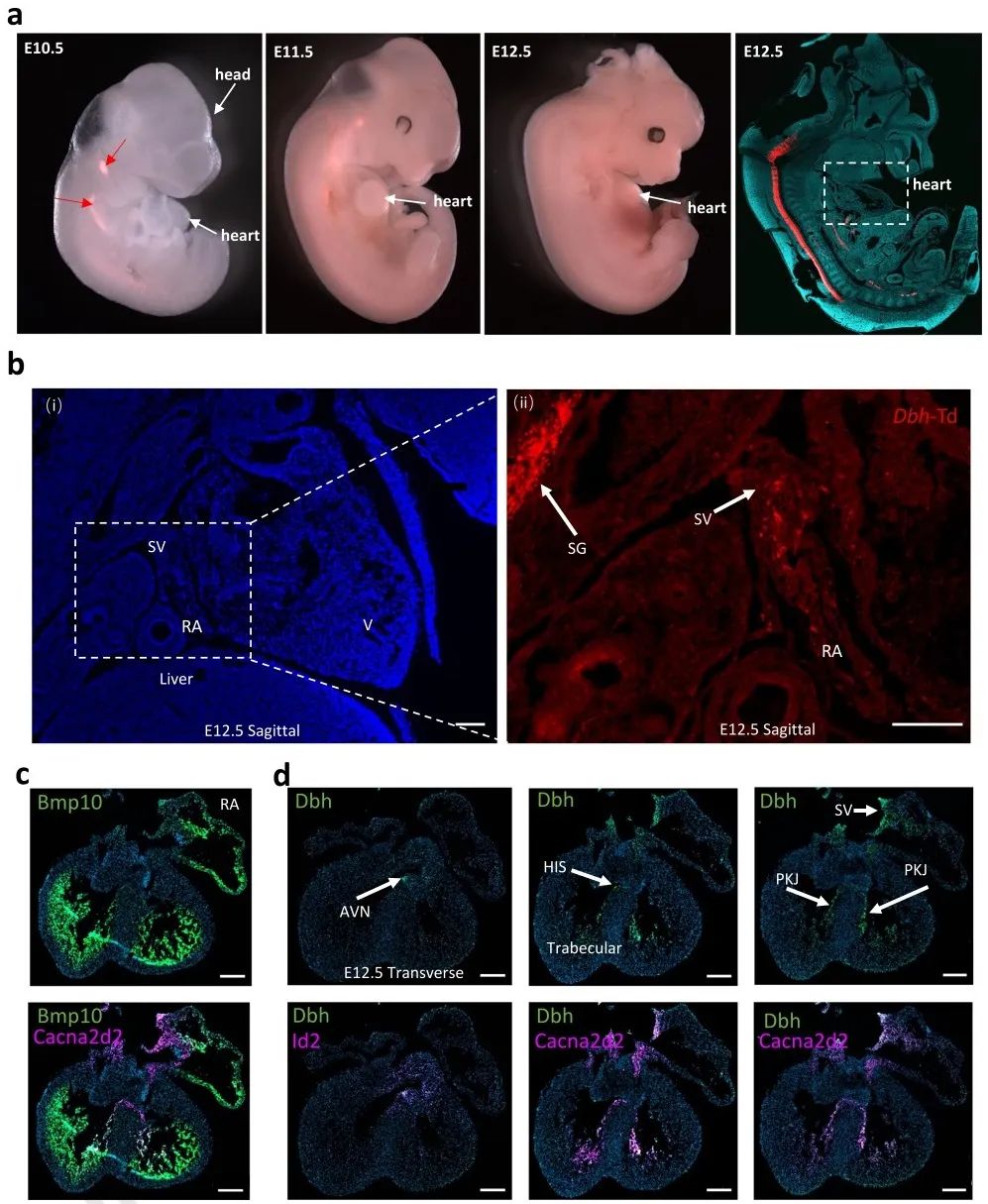
为了研究发育过程和成年小鼠心脏中Dbh+-CMs的空间分布,研究者采用多重核酸原位杂交(RNAscope)、免疫组织学染色和共聚焦显微镜成像进行分析。结果发现,Dbh+-表达细胞在E10.5时首先出现在背神经管,E12.5时经咽弓迁移至静脉窦(SV)和右心房。RNAscope共染可见,Dbh信号在SV、HIS束、PKJ中含量丰富并与Cacna2d2信号重叠,在AVN区域与Id2信号重叠。这些实验证明了Dbh+-表达细胞和CCS的关系。
免疫荧光染色结果显示,在E14.5、P3、P56阶段,表达Dbh-td-Tomato的细胞在心室小梁区域和CCS (AVN和HIS束)富集,且这些细胞表达α-actinin。3D图像重建结果显示,Dbh+-CMs的空间分布与早期的Stereo-seq分析结果一致。
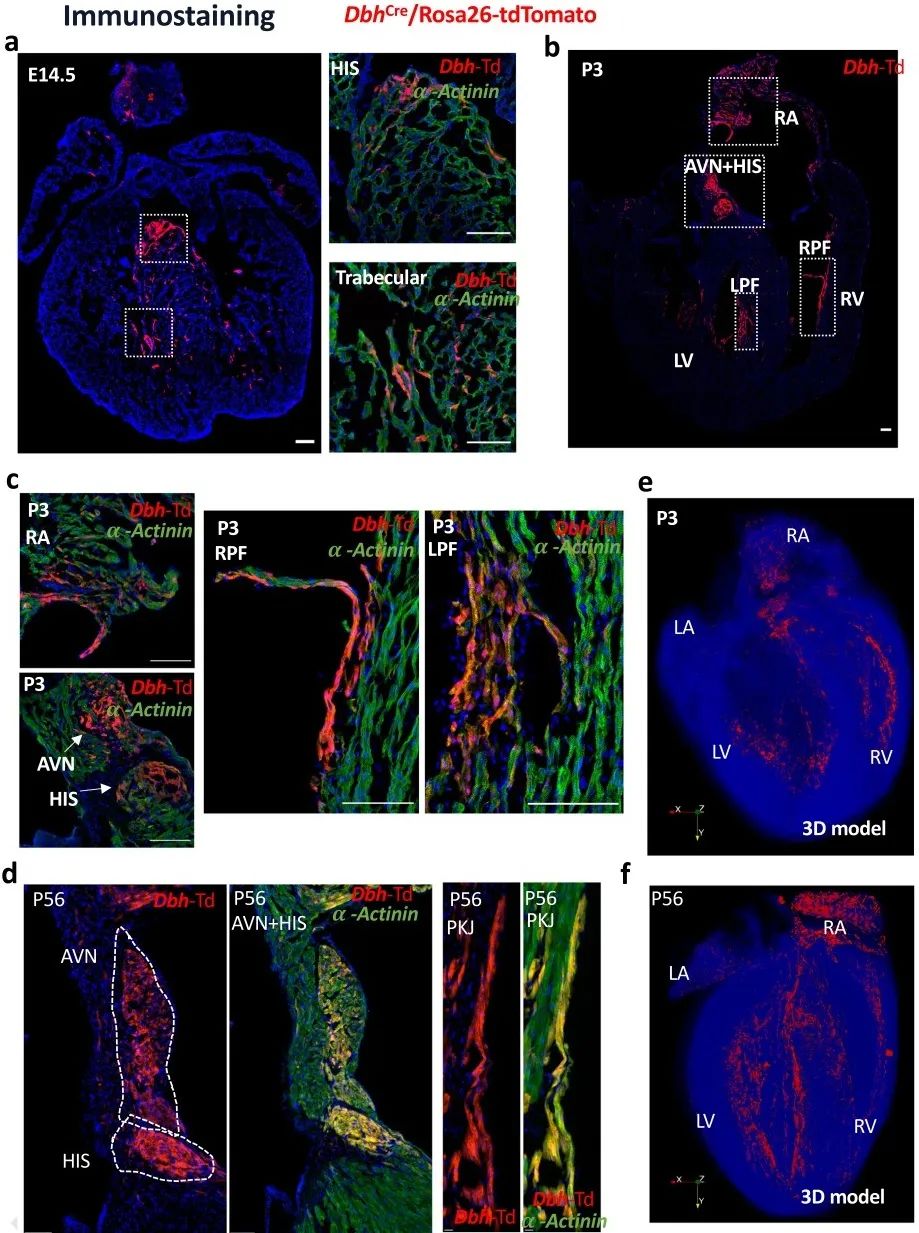
为进一步研究Dbh+-CMs在发育中和成年心脏中的表达和定位,研究者建立了DbhCFP系小鼠模型,并使用抗Flag或抗CFP抗体来增强CFP信号。结果发现,Dbh+-CMs在E14.5和P56时主要分布在AVN和心室CCS。研究者进一步建立了DbhCreERT/Rosa26-tdTomato诱导型示踪小鼠,在时间控制下定位Dbh+-CMs,发现tdTomato荧光主要集中在CCS的AVN和HIS区域。为了确认Dbh+-CMs是否参与形成PKJ网,研究者建立DbhCre/Rosa26-tdTomato/Cx40-eGFP小鼠,发现Dbh+-tdTomato和Cx40-eGFP信号在左心室和右心室PKJ网中存在明确的共定位,确定了Dbh+-CMs在心室CCS定位。
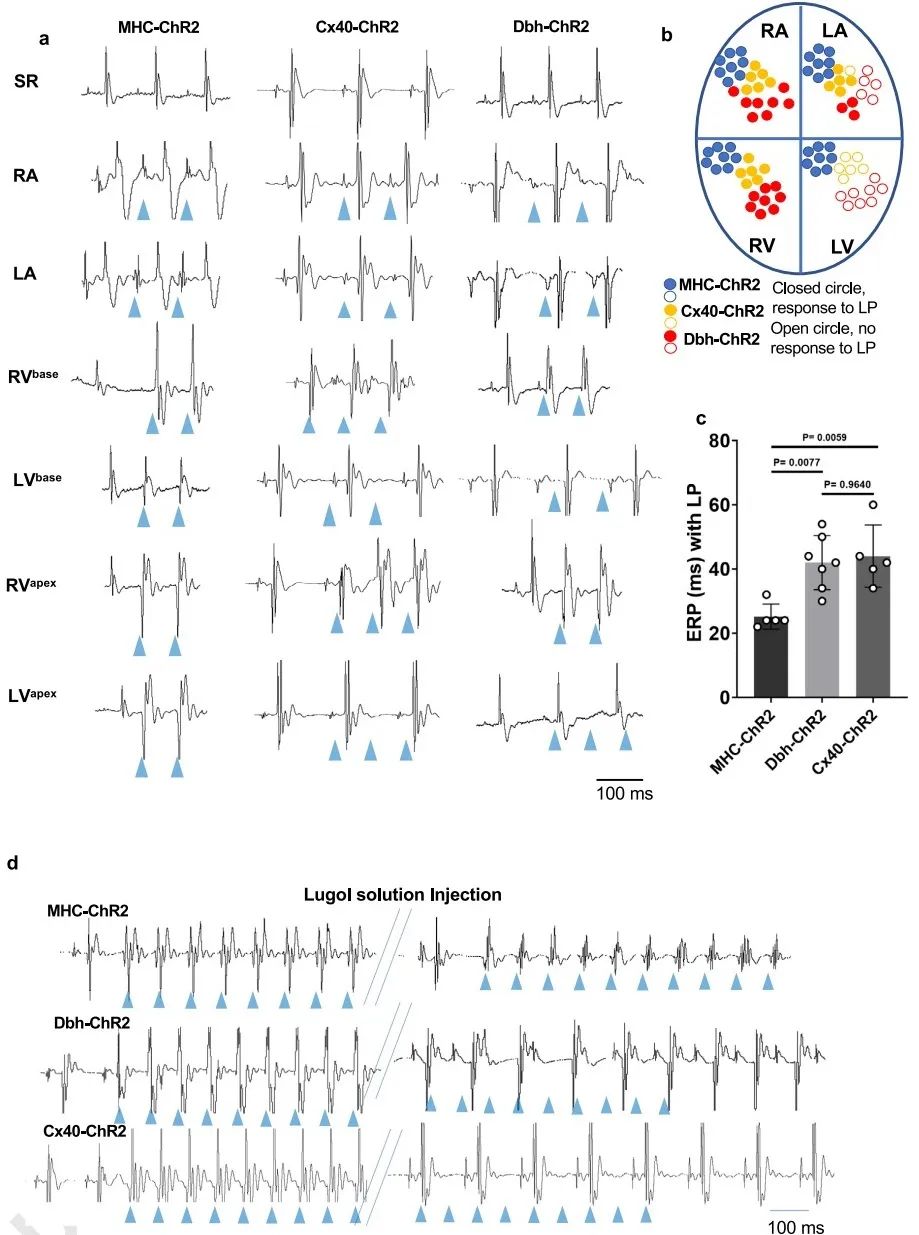
3. Dbh+心肌细胞和Dbh+-衍生心肌细胞的电生理学特征表明它们构成心脏传导系统的功能部分
为了阐明Dbh+-CMs的生理功能,研究者采用光遗传鼠模型研究DbhCre/ChR2-tdTomato (Dbh-ChR2)、Cx40-CreERT/ChR2-Tomato (Cx40-ChR2)和MHC-Cre/ChR2-tdTomato (MHC-ChR2)小鼠的心脏电生理特性。结果发现,光刺激Dbh-ChR2小鼠心脏右心室(RV)诱发的QRS波形特征与Cx40-ChR2小鼠心脏相似。同时,Dbh-ChR2和Cx40-ChR2小鼠心脏RV的有效不应期(ERPs)均显著长于MHC-ChR2小鼠心脏,表明Dbh+-CMs和Cx40+衍生的心肌细胞与RV中的PKJ有部分重合。为了进一步探讨Dbh+-CMs与RV中的PKJ网的特殊关联,研究者应用Lugol's溶液消融LV的PKJ细胞后,心电图结果显示Dbh-ChR2和Cx40-ChR2小鼠心脏的QRS波群延长,且无论后续多强的刺激都无法经RV起搏心脏。以上结果说明,Dbh-ChR2和Cx40-ChR2小鼠心脏对光刺激诱发的电生理特性基本相似。
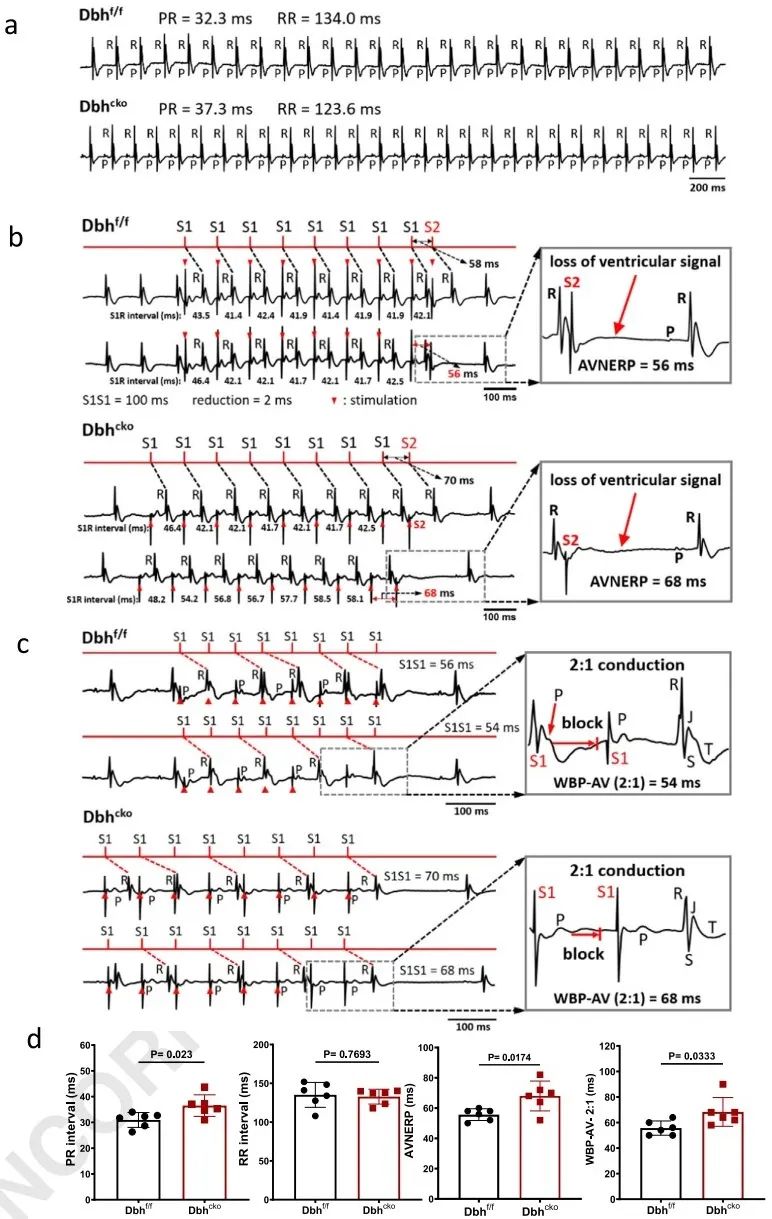
为进一步了解Dbh+-CMs在心脏中的电生理机制,研究者建立了Dbhf/f和Dbhcko小鼠模型。通过分析离体Langendorff灌注心脏的心电图发现,与Dbhf/f心脏相比,Dbhcko心脏具有更长的P-R间期、AVN有效不应期(AVNERP)和心房-心室(A-V)传导Wenckebach阻滞期。该结果首次证明心肌细胞特异性缺失Dbh基因会影响CCS的电生理特性。
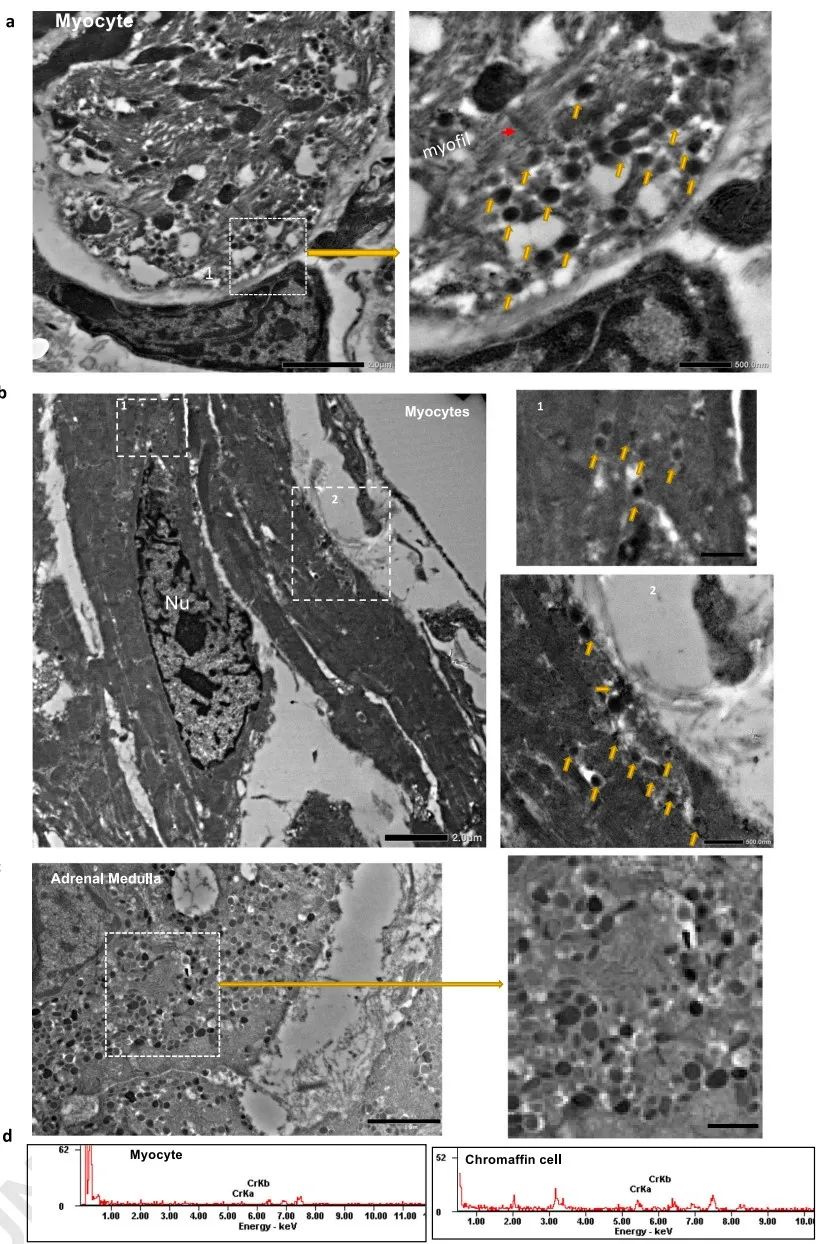
4.Dbh+心肌细胞儿茶酚胺能特性的表征
为了确定Dbh+-CMs中的Dbh表达是否参与心脏的功能,研究者将DbhCre/R26-tdTomato小鼠心脏中富含Dbh+-CMs的房室结区和肾上腺髓质组织固定并用铬染色剂染色进行透射电子显微镜(TEM)成像和能量色散X射线光谱(EDS)分析。结果发现Dbh+-CMs中含有与嗜铬细胞相同的囊泡,虽然数量较少、信号较弱。
综上所述,该研究揭示了Dbh+儿茶酚胺能心肌细胞在CCS形成过程中与交感神经支配的密切关系。因此,该研究通过揭示一类具有潜在儿茶酚胺能内分泌功能的新心肌细胞亚群,为哺乳动物CCS的发育和细胞异质性及Dbh+儿茶酚胺能传导心肌细胞的潜在内分泌功能及和自主神经支配之间的动态相互作用提供了新的见解。
雷鸣、谭晓秋和寿伟年为本文共同通讯作者,牛津大学孙天依博士、Alexander Grassam-Rowe博士和西南医科大学蒲昭利硕士为共同第一作者。西南医大心血管研究所团队成员欧贤红、陈唐葶、范学慧为共同作者,该研究获得了国家自然科学基金委、四川省科技厅、英国心脏基金会、医学研究委员会和美国NIH项目基金支持。
原文链接:
https://doi.org/10.1038/s41467-023-42658-9


