【Lancet Haematol】综述:CAR T作为LBCL二线治疗的几个关键问题
时间:2023-12-10 17:38:31 热度:37.1℃ 作者:网络
LBCL的CAR T挽救治疗
CD19 CAR T 细胞疗法已获得FDA批准作为高危大 B 细胞淋巴瘤 (LBCL) 的二线治疗,极大地影响了该疾病的挽救方案,可能会改善复发难治性(R/R) LBCL 的病程。尽管 CAR T 细胞在患者中的主要适应症已明确定义,但仍需要考虑关于该治疗实际实施中的几个问题:适合的组织学亚型;年龄、合并症和肿瘤生物学限制;处理极具侵袭性的肿瘤行为;Holding治疗和桥接治疗。
《The Lancet Haematology》近日发表的一篇综述中,作者针对这些关键问题提出了管理策略,从而为在 LBCL 二线治疗中使用市售 CD19 CAR T 细胞的合理路径提供了指导。现翻译全文供参考。

该指导性文章是以结构化的方式制定的,每个问题都包括临床问题的描述、证据总结、实际管理方法的基本原理和建议,对于决定考虑接受二线 CAR T 细胞治疗的R/R LBCL 患者,有助于确定最佳管理策略。Panel中总结了所有建议。下文进行详述。

适合的组织学亚型
临床问题
Axi-cel 已获批用于弥漫性大 B 细胞淋巴瘤 (DLBCL) 或高级别 B 细胞淋巴瘤 (HGBCL) 的二线治疗,也就是用于治疗原发难治性疾病或一线治疗后12个月内复发的患者,但尚未正式获批用于其他临床相关LBCL。Liso-cel已获得类似批准,但其还包括原发性纵隔 B 细胞淋巴瘤 (PMBCL) 和滤泡性淋巴瘤 3B 级(根据2022年 WHO 分类,现称为滤泡性大 B 细胞淋巴瘤 [FLBL])。然而,在 TRANSFORM 研究中接受 CAR T 细胞治疗的患者中,392例患者中仅7例 (8%) 为PMBCL,92例患者中1例 (1%) 为FLBL,且ZUMA-7 研究排除了两种淋巴瘤亚型。因此,二线 CAR T 细胞治疗PMBCL、FLBL和转化型惰性淋巴瘤的获益记录不多。
证据
当前临床实践中,转化型淋巴瘤、PMBCL和 FLBL 在很大程度上遵循与DLBCL 相同的治疗指征,尽管这些组织学亚型在CAR T二线研究和二线以上关键研究中的代表性较差,但在一项大型真实世界研究使用二线以上 CAR T 细胞治疗,与 DLBCL 相比,转化型滤泡性淋巴瘤和 PMBCL 患者的结局并不劣于 DLBCL 患者;转化型滤泡性淋巴瘤和 PMBCL 的早期治疗失败风险显著降低。与此一致,一项登记研究中33例 PMBCL 患者接受 axi-cel 治疗,12个月无进展生存率为64%,表明 CAR T 细胞在该淋巴瘤亚型中具有良好疗效。2023年的对照性真实研究表明,axi-cel治疗后 PMBCL 的结局可能优于DLBCL,非特指型(DLBCL-NOS)。
原理
尽管证据很少且仅限于接受二线以上治疗的患者,但现有信息一致表明,转化型滤泡性淋巴瘤或 PMBCL 患者从 axi-cel 治疗中获益的程度至少与 DLBCL 患者相同。CAR T细胞疗法的获益也可能扩展到罕见疾病亚群,如FLBL 和由其他惰性淋巴瘤转化的DLBCL,因为它们与 DLBCL-NOS 具有密切的生物学和临床相似性。但罕见 DLBCL 和富 T 细胞/富组织细胞 LBCL 等孤儿淋巴瘤亚型的情况不太清楚,也不清楚关键研究中明确排除的相关淋巴瘤亚型,尤其是原发性 CNS 淋巴瘤 (PCNSL) 和由慢性淋巴细胞白血病转化的DLBCL(Richter转化),后者中 CAR T 细胞的疗效可能受到基础慢性淋巴细胞白血病克隆的免疫抑制特性的影响。与之相反,越来越多的证据表明系统性 DLBCL 的继发性 CNS 受累不影响 CAR T 细胞治疗的结果。最后应记住,研究的合格性和批准均是依赖于2016版 WHO 疾病分类。
建议
除 DLBCL-NOS 和 HGBCL 外,使用CD19 CAR T 细胞治疗作为以下二线标准治疗似乎也适用于PMBCL、惰性淋巴瘤转化型DLBCL、FLBL和伴继发性 CNS 受累的DLBCL。相比之下,PCNSL、Richter转化和富 T 细胞/富组织细胞LBCL 的二线 CAR T 细胞治疗最好仅在临床试验中给药。
年龄和合并症限制及不适合移植
临床问题
ZUMA-7 和 TRANSFORM 研究仅纳入了医生认为适合自体造血细胞移植 (HCT) 的患者,尽管未进一步定义该标准,但心脏、肾脏、肝脏、脑或重度肺功能障碍患者不适合入组。ZUMA-7中未使用年龄上限,入组了年龄不超过80岁的患者,而 TRANSFORM 中设定的年龄上限为75岁。因此,可能会质疑患有一种或多种上述合并症、年龄较大或通常认为无法耐受自体 HCT 的患者是否应常规使用 CAR T 细胞作为二线治疗。
证据
由于 DLBCL 诊断时的中位年龄为66岁,并且几乎30%的患者在≥75岁时确诊,因此年龄相容性是旨在改变疾病自然史的治疗手段的重要要求。ZUMA-7中28%(n=51/180) 的患者和 TRANSFORM 中39%(n=36/92) 的患者年龄≥65岁,但年龄大于65岁不影响 CAR T 细胞组的无事件生存获益。
毒性是老年患者的主要问题。关于二线治疗以外的情况,在108例患者(重点关注年龄效应)中进行的 ZUMA-1 研究的亚组分析发现,≥65岁患者的3-4级免疫效应细胞相关神经毒性综合征的发生率 (44%;n=12/27) 高于年轻患者 (28%;n=23/81)。此外,在真实生活中,与年轻患者相比,≥65岁患者接受 axi-cel 或 tisa-cel 治疗后免疫效应细胞相关神经毒性综合征、重度细胞因子释放综合征和感染的发生率更高,意味着该年龄组的非复发死亡率增加。尽管存在这一缺点,接受CD19 CAR T 细胞治疗的老年患者的生存结局至少与年轻患者相似。该结果与患者选择明显相关,但需要提醒的是,目前尚无法确定 LBCL 中 CD19 CAR T 细胞治疗的年龄上限。
关于合并症,常见的临床挑战是存在肾功能不全。一项2022研究中166例患者接受 axi-cel 或 tisa-cel 治疗,其中17例肾功能不全(定义为估计的肾小球滤过率<60 mL/min/1.73 m²;包括2例接受透析的患者),149例肾功能正常。两组的无进展生存期或总生存期无显著差异;然而,输注后发生急性肾损伤的患者结局均较差,无论其基线肾功能如何。Ahmed及其同事的回顾性单中心研究得出了类似的结论。此外,CAR T细胞疗法甚至可能在肾移植受者中可行。与之相反,对从国际血液和骨髓移植研究中心的数据登记处1297例接受 axi-cel 作为 LBCL 二线治疗的患者进行的分析显示,中度至重度肾脏合并症(定义为血清肌酐>2 mg/dL、正在接受透析或既往接受过肾移植)与总死亡率风险显著增加相关(风险比 [HR]=2.1);与死亡率过高显著相关的其他合并症包括肝脏疾病(定义为肝硬化、胆红素>1.5×正常值上限或天冬氨酸转氨酶/丙氨酸转氨酶比值>2.5×正常值上限;HR 2.7)、心脏疾病(定义为任何冠状动脉疾病、充血性心力衰竭或心肌梗死病史,或射血分数≤50%;HR=1.4)和东部肿瘤协作组体能状态量表评分≥2;而肺部合并症和年龄没有影响。值得注意的是,2022年的一项类似分析(包括968例二线以上接受tisa-cel治疗的患者)未显示合并症对死亡率有影响。
关于自体 HCT 的合格性,前瞻性 ALYCANTE和 PILOT 研究提供了初步证据,它们将 axi-cel(ALYCANTE) 和 liso-cel(PILOT) 作为不适合移植的 LBCL 患者的二线治疗。缓解率和毒性与 ZUMA-7 和 TRANSFORM 研究中 CAR T 细胞组观察到的结果相似,liso-cel组的高级别神经毒性(PILOT为5%,ALYCANTE为20%)和非复发死亡(PILOT为7%,ALYCANTE为12%)少于 axi-cel 组。尽管无法得出明确结论,但结果表明,在该易感患者人群中可给予二线 CD19 CAR T 细胞治疗,且疗效-毒性可接受。
原理
移植合格性很难定义,可能与 axi-cel 合格性不同(反过来,可能与liso-cel 合格性不同)。因此,axi-cel 或 liso-cel 治疗的合格性(而非移植)应基于LBCL二线 CAR T 细胞治疗的指征。尽管现有证据不支持二线 CAR T 细胞治疗的年龄上限有差异,但一些数据表明,复发难治性 LBCL 患者接受 axi-cel 治疗后,特定合并症对结局具有不利影响。
建议
实足年龄较高本身不应成为 LBCL 患者二线 CAR T 细胞治疗的排除标准。相比之下,肾脏、肝脏和心血管合并症可能会影响死亡风险,因此应与其他已知会影响结局的变量一起考虑,包括体能状态、肿瘤参数、老年评估和经验证的生物标志物评分(如 HAEMATOTOX 和Endothelial Activation and Stress Index)。在任何情况下,均应充分告知患者及其亲属其个体风险-获益特征,并应参与最终决策过程。
是否应在二线 CAR T 细胞治疗前使用holding治疗和桥接或挽救治疗?
Holding治疗、桥接治疗和挽救治疗的详细描述见表1。暂留和桥接可定义为,在组织生产槽和白细胞单采(holding)以及制备 CAR T 细胞产品(桥接)所需时间内保持患者稳定的治疗干预。保持稳定意味着维持对肿瘤相关症状的控制,并预防可能危及 CAR T 细胞治疗可行性或结局的肿瘤相关体能状态和器官功能影响。在大包块患者中,准备白细胞单采和制备 CAR T 细胞所需的时间也可用于降低肿瘤负荷,进而降低重度毒性风险并提高 CAR T 细胞治疗的成功率。但是,所有holding和桥接治疗的应用,均应避免延长治疗指征至白细胞单采(indication-to-leukapheresis)和白细胞单采至产品输注(leukapheresis-to-product-infusion)的时间。
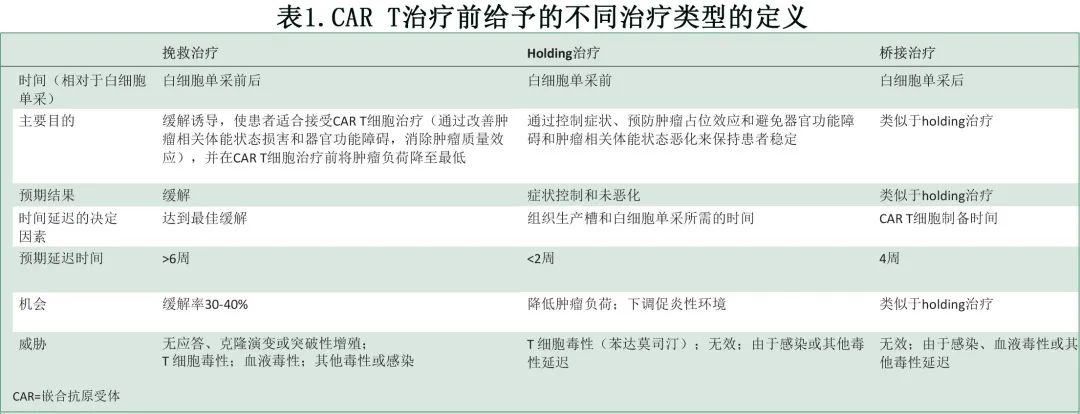
相比之下,挽救治疗的主要目标是诱导缓解,旨在在 CAR T 细胞治疗前最大限度地降低肿瘤负荷和相关促炎环境,通过改善肿瘤相关体能状态损害和器官功能障碍使患者适合接受 CAR T 细胞治疗,并消除肿瘤的占位效应。挽救治疗可在白细胞单采前后给药,可能需要多个周期,甚至多个方案,并可能导致治疗指征至白细胞单采和白细胞单采至产品输注的时间显著延长。
挽救治疗
临床问题
与复发难治性 LBCL 患者使用的其他细胞疗法(如自体或异基因HCT)相似,诱导缓解状态或最大程度降低干预前肿瘤负荷可能与二线 CAR T 细胞疗法的结局改善相关。
证据
尽管单个肿瘤活性或体积指标(如乳酸脱氢酶 [LDH] 血清浓度和产品直径总和)在 ZUMA-7 研究的 axi-cel 组中对无进展生存期无显著影响,但高代谢性肿瘤体积作为肿瘤负荷和增殖的更全面集合,可预测该组的结局较差。在 TRANSFORM 研究中,未发现治疗组与 LDH 浓度或产品直径总和在无事件生存期主要终点方面存在相互作用,但无法分析这些参数在 liso-cel 组中的影响。间接证据来自二线以外市售 CD19 CAR T 细胞治疗的真实世界研究,报告的结果一致,即清淋时的活动性疾病对结局有不利影响。
原理
尽管数据相互矛盾,但有证据(尽管较弱)及合理性证实在二线 CAR T 细胞治疗前控制淋巴瘤可能有获益。但是,这些考虑并不意味着在这种情况下,尝试达到疾病控制状态是合理的治疗目标。尚不清楚通过挽救治疗成功进行的肿瘤减灭术本身是否有助于获得有利的 CAR T 细胞治疗结局,或仅是侵袭性较低肿瘤生物学的替代标志物。此外,来自二线以上 CAR T 细胞治疗的数据、来自三项 III 期二线批准试验的标准治疗组的数据和在二线自体 HCT 前探索挽救治疗的早期研究的数据表明,仅少数患者成功实现了诱导缓解——这意味着至少在三分之二的患者中,挽救治疗提供的只是毒性和肿瘤耐药性的潜在演变。因此,挽救的风险可能大大超过其理论获益。BELINDA研究 tisa-cel 组的结果令人失望,与 ZUMA-7 和 TRANSFORM 相比该研究进行了最密集的桥接工作,且白细胞单采至产品输注的时间最长,这与该假设一致。
建议
如果挽救治疗会延迟 CAR T 细胞输注或可能危及 CAR T 细胞治疗的可行性(例如诱导感染或造血细胞毒性),则LBCL 的预期二线 CAR T 细胞治疗前不应使用(旨在最大程度降低肿瘤负荷或活性的)挽救治疗策略。
Holding治疗和桥接治疗
临床问题
在许多患者中,淋巴瘤增殖引起的症状或即将发生的并发症需要充分管理,以在 CAR T 细胞制备期间保持患者稳定。
证据
尽管对于接受二线以上 CAR T 细胞治疗的复发难治性 LBCL 患者,部分回顾性研究中既往无桥接治疗似乎具有有利结果,但这些结果可能只是反映了更有利的肿瘤生物学、更低的肿瘤负荷或两者兼有。尚未获得比较 LBCL 中 CAR T 细胞治疗前桥接对比非桥接策略的前瞻性研究。TRANSFORM研究中 CAR T 组的患者(63%[ 58/92] 接受桥接治疗)倾向于表现出比 ZUMA-7 研究患者获得更高的完全缓解率以及更好的无事件和总生存结局,尽管两项研究的风险特征相似。TRANSFORM的 liso-cel 组的亚组分析未表明接受桥接治疗的患者结局较差:桥接后 PET 阳性患者的18个月无事件生存率为54%,桥接后 PET 阴性患者的18个月无事件生存率为67%,而未接受桥接治疗的患者的18个月无事件生存率为47%。
原理
尽管未进行前瞻性比较,但 TRANSFORM 的 CAR T 细胞组的结果未提示单周期铂类桥接治疗的有害作用—相反,桥接可能有助于缓解淋巴瘤相关症状并稳定患者,使患者在更好的状态下开始 CAR T 细胞治疗,甚至在其他方面可能不合格的情况下开始 CAR T 细胞治疗。此外,桥接可能导致肿瘤负荷降低,从而增加成功实现 CAR T 细胞治疗在疗效和安全性方面结局的概率。出于同样的原因,在 CAR T 细胞制备延迟的情况下考虑holding治疗似乎是合理的,尽管证据很少。
建议
在准备白细胞单采和 CAR T 细胞制备期间,所有肿瘤动态生长或肿瘤体积较大的患者均应接受旨在控制症状、稳定患者或肿瘤减灭术的holding治疗和桥接治疗。
如何桥接治疗
临床问题
经典的铂类挽救免疫化疗可产生相当大的造血和器官毒性,且仅对少数R-CHOP耐药的 LBCL 患者有效。
证据
前瞻性研究表明,铂类为基础的免疫化疗——如R-DHAP(利妥昔单抗+地塞米松、大剂量阿糖胞苷和顺铂)、R-ICE(利妥昔单抗+异环磷酰胺、卡铂和依托泊苷)和R-GDP(利妥昔单抗+吉西他滨、地塞米松和顺铂),如果作为R-CHOP诱导不成功的患者二线治疗,可在30-50%的患者中诱导客观缓解。维泊妥珠单抗联合利妥昔单抗(联用或不联用苯达莫司汀)治疗复发难治性 LBCL 患者时报告了相似的结果(表2)。考虑到接受维泊妥珠单抗的患者年龄更大、国际预后指数评分倾向于高于接受含铂治疗的患者,并且大多在二线后接受研究治疗,维泊妥珠单抗为基础的桥接可能是含铂标准方案的合理替代方案。事实上,维泊妥珠单抗是德国和英国二线以外真实世界分析中最有效的桥接方案。然而关于holding治疗,应考虑在白细胞单采前使用苯达莫司汀作为维泊妥珠单抗标准联合治疗时的生产失败风险。

Tafasitamab 是一种人源化抗 CD19 单克隆抗体,获批与来那度胺联合治疗复发难治性DLBCL。虽然在纳入81例复发难治性 DLBCL 患者的观察中观察到有希望的缓解(总缓解率60%,完全缓解率43%),但初步的真实世界经验不太令人鼓舞。此外,由于 tafasitamab 具有与 CAR T 细胞相同的抗原靶点,因此这些治疗之间的潜在干扰是一个问题,尽管已经报告了成功序贯使用 tafasitamab 和 axi-cel 的个案病例。该问题也可能与 loncastuximab terisine 有关,即使其尚未获批用于二线治疗。
CD20 靶向 T 细胞结合抗体(如 epcoritamab 和glofitamab)被称为双特异性抗体,正在成为 LBCL 的一种新型免疫治疗方法。但尚未获批用于二线治疗,作为 CAR T 细胞治疗的桥梁给药可能是有害的,因为这两种方法均使用 T 细胞,可能导致疗效和免疫抑制不良反应方面的相互作用;但CAR T细胞治疗前使用CD20×CD3双特异性抗体的初步证据并不支持这些理论问题(反过来亦如此)。
伊布替尼单药治疗在部分 LBCL 亚型中显示出一定的活性,例如ABC DLBCL 和双表达淋巴瘤,因此有个案报道用于 CAR T 细胞治疗的超说明书桥接。尽管缓解不高且通常持续时间较短,但伊布替尼具有低毒性(尤其是血液毒性)以及通过改善 T 细胞功能增强 CAR T 细胞疗法疗效的理论优势。
最后,在局部肿瘤活动或肿瘤体积较大的情况下,放疗可能是holding和桥接治疗的一种方便有效的选择。
原理
目前的证据支持使用维泊妥珠单抗的桥接作为标准含铂方案的替代方案。但使用维泊妥珠单抗作为一线治疗的一部分是否会降低其在后续治疗线中的疗效仍有待确定。如果作为holding治疗使用,维泊妥珠单抗应在不使用苯达莫司汀的情况下给药;但可在白细胞单采后加用苯达莫司汀。在临床试验中应优先探索在holding和桥接治疗中使用双特异性抗体。尽管伊布替尼通常无效,但其起效快且毒性低,使其易于作为治疗选择进行探索,因此尽管尚未获得该适应症的许可,但仍可在个体情况下给药。
建议
含铂类药物的标准挽救治疗方案和含维泊妥珠单抗的联合治疗应是 LBCL 二线 CAR T 细胞治疗前用于桥接目的的首选治疗。但应避免使用 CD19 靶向药物。Holding治疗应具有低骨髓抑制活性和低 T 细胞毒性,不应包括苯达莫司汀。对于局部肿瘤活动的患者,放疗可作为Holding和桥接的有用替代方案。
在桥接治疗反应良好的情况下该怎么做
临床问题
对于化疗敏感性患者(即桥接治疗后达到完全或部分缓解,或转诊中心接受挽救治疗后产生缓解后转诊接受二线 CAR T 细胞治疗的患者),CAR T细胞治疗是否优于自体 HCT 尚不清楚。
证据
CAR T细胞治疗的3个关键3期研究并非为了回答这个重要问题。但TRANSFORM研究提供了旁证,其中 liso-cel 组的9例患者在1个周期的桥接治疗后达到完全代谢缓解,其结局非常好,18个月无进展生存率为67%,总生存率为78%;但这些数值未与标准治疗组挽救治疗反应的患者的生存结局进行比较。国际血液和骨髓移植研究中心的登记分析发现,接受 CAR T 细胞治疗的化疗敏感复发难治性 DLBCL 患者的复发风险高于接受自体 HCT 治疗的患者,但这两个队列的平衡性较差(CAR T细胞组从诊断至细胞治疗的时间更短、治疗前疾病更广泛、肿瘤负荷更高、体能状态更差、治疗期更近)而无法得出明确结论。最后,尽管尚无定论,但可从接受 axi-cel 或 tisa-cel 二线后治疗获得无可测量疾病的小系列患者中推导出一些证据,表明 CAR T 细胞扩增和疗效在这种情况下前景良好。
原理
尽管在二线挽救治疗有效的患者中 CAR T 细胞治疗优于自体 HCT 的证据不足,但也没有可靠的证据表明 axi-cel 或 liso-cel 劣效。根据注册登记分析,第一年内一线治疗失败且接受自体 HCT 治疗后疾病敏感的 DLBCL 患者的长期无进展生存期估计为35-45%。在所有风险特征方面,该值并不优于 ZUMA-7 研究中axi-cel 的长期无进展生存期。支持桥接治疗有效患者接受 CAR T 细胞巩固治疗的另一个论据为,ZUMA-7 和 TRANSFORM 研究中标准治疗组无事件患者的生活质量结局较差。此外,如果仅在桥接治疗反应确定后才决定给予的细胞治疗类型,则需要同时制备 CAR T 细胞治疗和自体HCT,因此大幅增加资源消耗和后勤工作。
建议
对桥接治疗有反应或对疾病有反应的患者,应继续进行预期的二线 CAR T 细胞治疗应而非转换为自体 HCT 策略。
极侵袭性疾病
临床问题
ZUMA-7 研究排除了“因肿瘤占位效应而需要紧急治疗”的患者;但该要求在高复发风险或难治性 LBCL 患者中相当常见。由于此类患者为高危人群,尚不清楚 ZUMA-7 的结果是否可外推至该人群。
证据
与 ZUMA-7 不同,TRANSFORM 研究中需要立即治疗不是排除标准,该研究中分配至 liso-cel 组的患者中63% (n=58/92) 在白细胞单采后接受含铂的挽救性免疫化疗。其中,40%(n=23) 因肿瘤快速生长而接受桥接治疗,48%(n=28) 因高肿瘤负荷而接受桥接治疗。,接受桥接治疗的患者(包括未产生缓解的患者)的总体结局与未接受桥接治疗但继续接受liso-cel治疗的患者相似,表明对紧急治疗的需求可能不妨碍成功的 CAR T 细胞治疗。该结果与 ZUMA-7 研究的随访数据一致,后者显示 LDH 血清浓度增高和肿瘤负荷(通过放射学产物直径之和测量)均未显著影响无事件生存期。
原理
将 TRANSFORM 研究的数据转换为 axi-cel 治疗似乎是合理的,这表明紧急治疗需求并不妨碍二线 CAR T 细胞治疗,除非疾病相关体能状态恶化或其他因素导致不太可能获得成功的结局。
建议
对治疗的迫切需求不应妨碍 LBCL 患者开始二线 CAR T 细胞治疗。
结论
CAR T 细胞疗法彻底改变了复发难治性 LBCL 和其他 B 细胞恶性肿瘤的治疗,但在二线治疗中 CAR T 细胞应用的最佳管理需要仔细考虑各种患者相关和治疗相关因素,这里给出的建议可能有帮助。尽管如此,由于 LBCL 的治疗正在快速进展(包括 CAR T 细胞和其他治疗),应不断纳入新的证据,使 LBCL 管理策略适应科学进展,从而改善该患者人群的结局。
参考文献
Dreger P,et al.CD19-directed CAR T cells as first salvage therapy for large B-cell lymphoma: towards a rational approach.Lancet Haematol . 2023 Dec;10(12):e1006-e1015. doi: 10.1016/S2352-3026(23)00307-1.


