病理干货 | 系统汇总MET基因变异检测方法及靶向治疗
时间:2023-12-10 13:36:23 热度:37.1℃ 作者:网络
01 关于MET基因
MET基因编码c-MET酪氨酸激酶受体,该受体的配体是肝细胞生长因子(HGF)。在正常细胞中,HGF与c-MET蛋白结合后,启动一系列的细胞内信号传导来介导胚胎发育、伤口愈合等过程。研究表明,MET信号通路的异常在肿瘤侵袭、血管生成、肿瘤转移中起到非常关键的作用。MET基因突变可以引起MET信号通路的异常,基因突变形式包括MET 14外显子跳读突变、MET激酶区点突变、MET基因扩增等多种类型[1]。
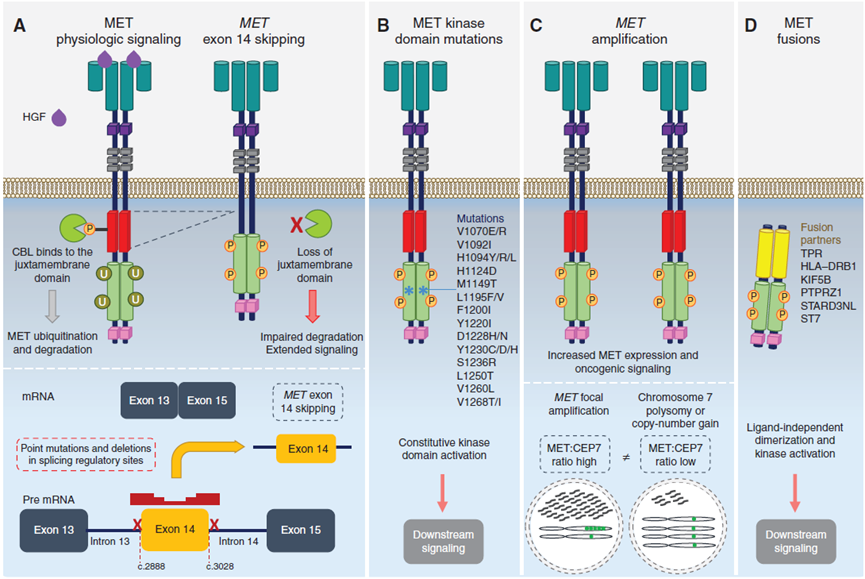
图1.MET基因变异类型
在非小细胞肺癌(NSCLC)患者中,MET 14外显子跳读的发生率约1%-4%,而在肺肉瘤样癌(PSC)患者中的发生率可高达22%(9–22%)[2-4]。2022版NCCN指南(NSCLC)指出MET 14外显子跳读突变在不吸烟的老年女性NSCLC中更常见。在NSCLC患者中,MET扩增的发生率约1-6%,其中高拷贝数扩增(GCN≥10)的发生率约2%。在三代EGFR-TKI抑制剂的耐药机制中,由于MET基因扩增导致的耐药的患者比例更高达15%-19%。因此MET基因扩增也成为肺癌治疗的新靶点[5]。
在多种实体瘤中都发现有原发MET扩增,根据肿瘤基因组计划(TCGA)和cBioPortal数据库提供的数据,胃癌中约1-10%;大约2-4%的结肠癌(CRCs),13%左右的I型肾乳头状癌(PRCCs)和3%左右的II型肾乳头状癌也检出MET扩增,但在食管癌和肝细胞癌中检出比例较低。
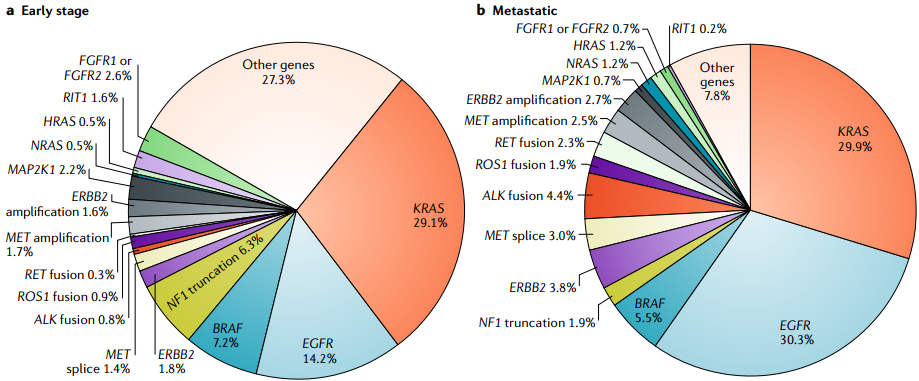
图2.不同分期NSCLC中驱动基因突变种类
02 关于MET靶向药物
MET激酶与其他蛋白激酶的结构类似,N端为5个β折叠和一个α螺旋(C-螺旋),C端为6个α螺旋,两端通过柔性的铰链区连接,该区域为ATP结合位点,活性loop区域通常有20-30个氨基酸残基组成,从保守的DFG序列(通常是Asp-Phe-Gly)开始,延伸到 APE序列(通常是Ala-Pro-Glu)。根据DFG构象,可分为激酶活性构象(DFG-in)和激酶非活性构象(DFG-out)。
根据作用机制,针对MET基因突变的TKI(MET-TKI)可分为3种类型(I型、II型和III型,见右下图)。I型抑制剂是指与激酶活性构象(DFG-in)结合,又根据是否与溶剂前沿残基G1163位点(类似于ALK的G1202和ROS1的G2032位点)结合进一步细分为Ia、Ib(区别在于Ib型TKI可以结合的位点较少,因此特异性较高);II型是指与激酶非活性构象(DFG-out)结合,是多靶点TKI,对产生二次突变的MET仍具有抑制作用,或许可以逆转由Y1230等突变引起的I型MET-TKI耐药。
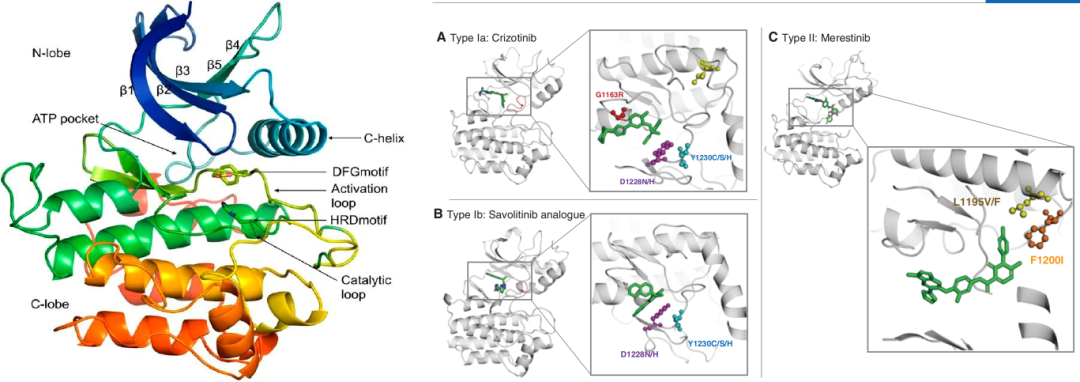
图3.典型蛋白激酶结构域[6]
图4.MET-TKI分型[7]
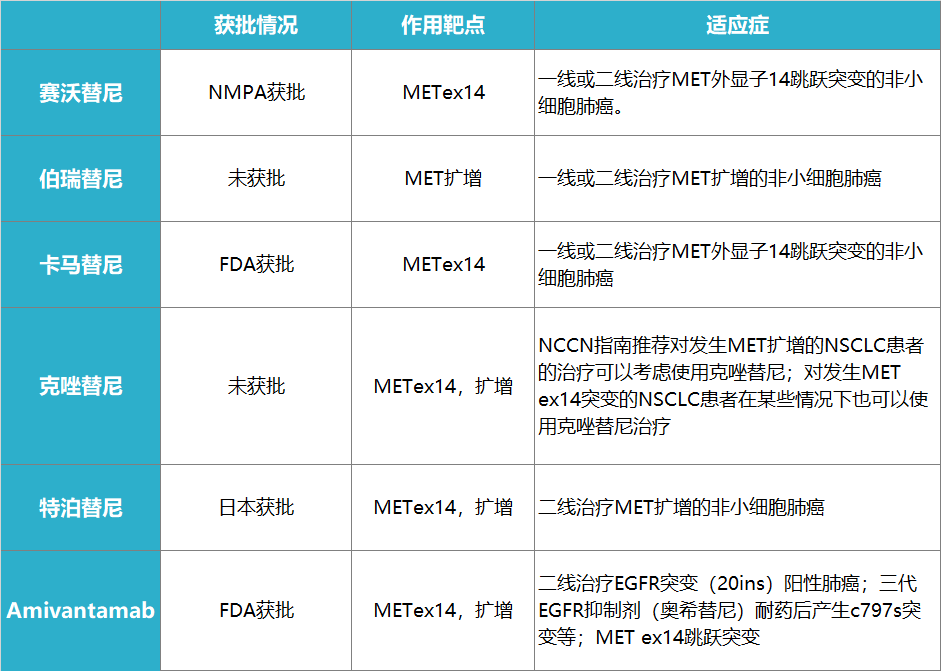
表1 肺癌MET靶向药物列表
而在其他实体瘤中研究发现MET扩增水平和MET抑制剂疗效呈正相关。PROFILE 1001研究是最早开展的关于MET抑制剂疗效和MET扩增程度相关性的研究,研究纳入肺癌,肾癌,结肠癌,胃食管癌,肝癌等实体瘤患者分别分为低度扩增组(MET / CEP7 ≥1.8 , ≤2.2),中度扩增组 (MET / CEP7>2.2 ,<5)和MET高度扩增组 (MET /CEP7 ≥5),结果提示高度扩增组的客观反应率(ORR)可达67%,低扩增组和中扩增组的客观反应率ORR分别为0%和17%。随后研究组将中度扩增组界定值调整为MET /CEP7值为2.2-4.0,高扩增组界定为MET /CEP7 ≥4.0,最终结果提示总体临床获益最显著的也是高度扩增组,其ORR为40%,中位无进展生存期(PFS)为6.7个月,而低度扩增组和中度扩增组的ORR分别为33%和14%,PFS分别为1.8个月和1.9个月[8]。
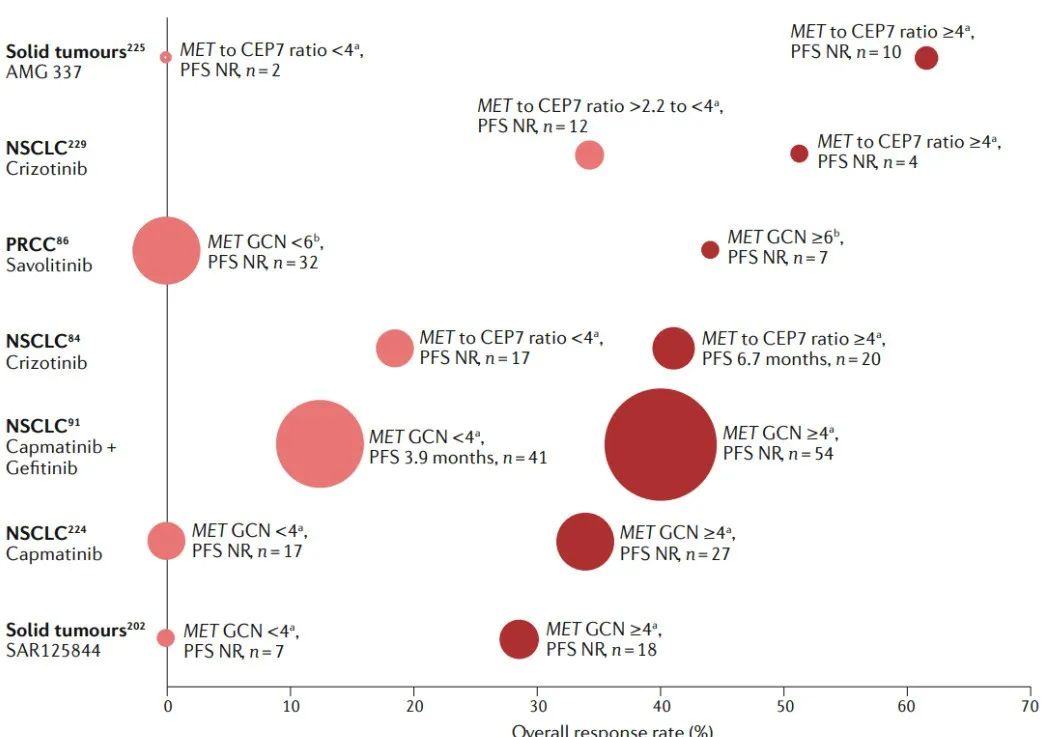
图5.MET扩增肿瘤患者的靶向治疗及其有效性
03 关于MET基因扩增
MET的扩增即基因局部扩增或者染色体倍增。相比染色体倍增,局部扩增使MET发生的扩增更易导致癌症的发生。常用荧光原位杂交(FISH),定量实时PCR(qRT-PCR)和二代测序(NGS)等方法进行检测。
检测方法:
FISH:MET扩增常用FISH检测,是业内公认的组织c-MET基因扩增检测的金标准。FISH即荧光原位杂交技术,以荧光探针标记MET基因和7号染色体着丝粒数,计算MET拷贝数及比例,可以直接观察到单个肿瘤细胞的MET扩增状态。
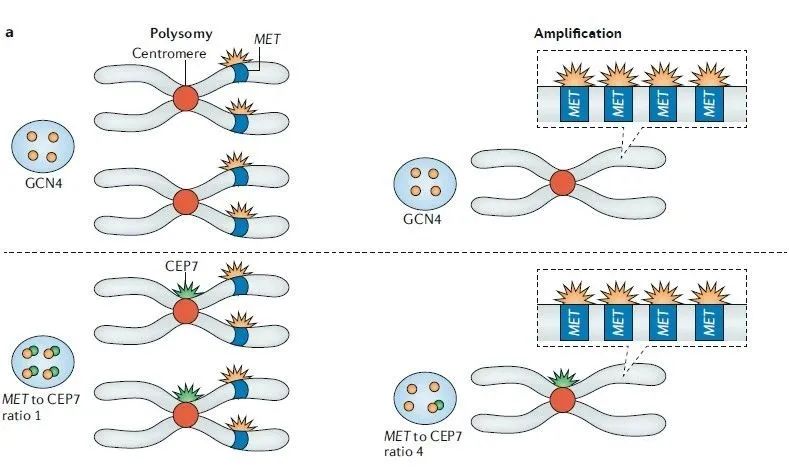
图6.MET扩增原理
目前按照MET/CEP7比值分层,如下:
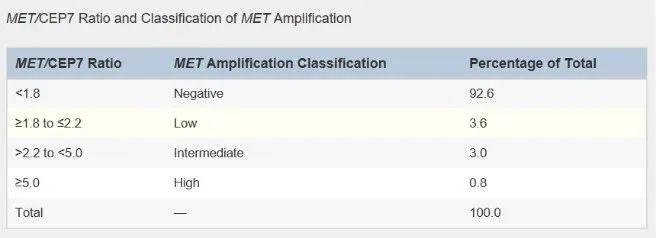
NGS方法:临床上使用了两种NGS的检测方法:基于扩增的NGS和基于杂交捕获的NGS。这些技术在DNA富集方法方面有所不同。简而言之,基于杂交捕获的NGS能够更准确地评估MET和其他基因中拷贝数的变化,可以对基因组更广泛区域进行检测,以及对重复序列的鉴定,从而可以更准确地确定序列覆盖深度和总拷贝数变化。使用NGS检测时需要考虑以下几个问题。首先,拷贝数增加和/或减少的检测取决于肿瘤纯度和样本的选择,因为非恶性细胞在分析过程中经常与恶性细胞混杂在一起。其次,使用质量差的DNA(长期储存的肿瘤样本)可以导致噪声水平的增加,使拷贝数的准确性分析变得更加困难。第三,测序深度作为拷贝数评估的关键要素,使用的序列必须具有一定的深度和均匀覆盖度,才能提供准确的临床结果。
qRT-PCR:与FISH和NGS相比,该技术不能很好的测定MET扩增。同样,判定MET扩增的阈值也不同,没有明确的标准化规则。
最后,FISH、NGS、PCR都可以用于MET扩增的检测,其中组织FISH是扩增检测的金标准,仍是更好的MET扩增检测方法。
04 关于MET基因突变
激活突变可发生在MET内不同的位置,包括激酶结构域、14号外显子两侧的内含子剪接位点和胞外结构域。其中以14号外显子跳读最为常见。
作为自身负反馈调节的一部分,MET激活导致MET激酶激活环内14号外显子编码的近膜结构域Y1003残基发生磷酸化,该残基的磷酸化介导MET与c-Cbl E3连接酶的结合,导致泛素化并最终导致MET降解。MET第14号外显子的突变具有异质性,它们均能够干扰该过程并导致MET信号持续增强。这些突变中最常见的是碱基取代或插入缺失,在50%MET突变的患者中均有发生。
大多数MET 14号外显子突变都会干扰RNA剪接。在野生型中,转录本翻译成蛋白质之前,mRNA前体内含子区域会被剪切,然后再翻译成蛋白质。MET 14号外显子突变会干扰该剪接过程,导致14号外显子被跳读。编码的近膜结构域的丢失导致MET上Y1003泛素结合位点的丢失。因此,MET降解减少导致MET表达增加,从而驱动致癌作用。这些剪接位点突变中的大多数都以插入缺失的形式存在,其大小范围很广。
不直接影响剪接的MET突变有相似的表型。例如,Y1003替换的突变能够干扰其与c-Cbl E3连接酶的结合。与MET 14 号外显子RNA剪接位点突变相似,Y1003替换会导致细胞增殖水平提高并促进肿瘤生长。包含14号外显子在内的大片段缺失也会导致携带Y1003的近膜结构域丢失[9]。
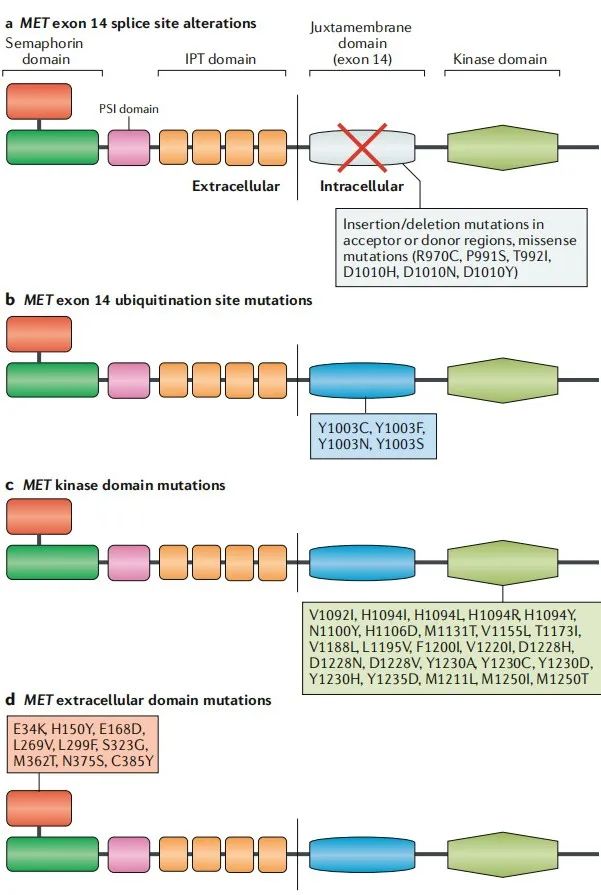
图7.MET突变原理
检测方法:
DNA-NGS:MET 14号外显子的突变高度异质;因此,有效的NGS分析必须能够捕获这些多样的突变。如前所述,基于扩增的NGS和基于杂交捕获的NGS是临床上使用的两种主要检测方法。与基于杂交捕获的方法相比,基于扩增的NGS使用特定引物对目的基因进行测序,虽然检测重复区域和等位基因缺失时容易发生错误和偏倚,但是这种方法缩短检测时间,并能更好地捕获目标区域和难以测序的区域。
这两种方法通常都有很高的覆盖深度,检测结果具有较高的准确性,显然NGS已成检测MET14号外显子突变的一种有效方法。
RNA-NGS:RNA测序平台有力补充DNA-NGS检测的缺点。RNA测序可以直接鉴定MET 14号外显子的转录缺失。此外,由于在mRNA中不存在内含子,RNA的测序避免了对大片段内含子进行测序的挑战。但是,RNA的稳定性差,极容易降解,因此检测样本的保存至关重要。此外,考虑到非恶性和肿瘤组织中mRNA表达的高度多变性以及解释结果的困难性,RNA测序目前被用作传统测序方法的辅助手段。有研究显示基于RNA和DNA的NGS诊断MET外显子14跳跃突变具有高度一致性[10]。
05 关于MET过表达
在许多情况下都应考虑MET表达在肿瘤发生中的作用。首先,在缺氧和/或炎症的情况下,MET可以在癌细胞中被转录诱导,激活细胞增殖,减少细胞凋亡并促进细胞迁移。因此,即使在缺少基因组驱动因素(例如MET扩增,突变或融合)的情况下,肿瘤也可能依赖于MET信号传导。目前正在探索新型的MET靶向策略,例如双特异性抗体(作用于同一目标蛋白的两个不同位点)联合ADC治疗。其次,MET可能在具有激活突变的肿瘤中过表达,例如具有原发和/或继发MET扩增或MET 14号外显子突变的肿瘤。
检测方法:
免疫组化(IHC):许多抗MET抗体已常规用于MET的IHC检测。包括单克隆抗体(例如SP44,cMET和MET4),多克隆抗体(例如多克隆MET AF276)和磷酸化MET抗体(例如pMET Y1349)。在这些抗体中,使用最多的是SP44(一种兔单克隆抗总MET抗体)。病理学家评估的IHC染色的程度和强度是MET蛋白表达的半定量指标[9]。
质谱分析(SRM-MS):SRM-MS能够定量分析福尔马林固定的石蜡包埋组织切片中的MET蛋白。与IHC相比,SRM-MS不容易受到观察者的影响,并且能够检测到较低水平的蛋白质表达。然而,SRM-MS不能区分表达的蛋白为肿瘤组织还是非恶性组织,因此MET定量可能受基质和/或炎症浸润的影响。此外,SRM-MS在技术上比IHC要求更高,成本更高,所以这种方法目前未被广泛采用[9]。
筛查:MET过表达已被研究作为筛选MET激活突变患者的一种方法。但是,MET过表达并不是MET扩增或MET 14号外显子突变的可靠指标。
总结:
从临床应用上,需要定义出对包括MET扩增或MET表达水平在内的连续变量进行标准化的临床意义分界点,才能够确定MET是否发生变异。虽然检测方法有多种,FISH仍是MET基因扩增检测更好的方法;MET 14外显子跳跃突变,基于DNA NGS的检测方法具有较高的检出率,必要时,RNA检测可作为DNA-NGS检测的辅助诊断;免疫组化(IHC)已常规用于MET过表达检测。除此之外,MET靶向治疗在许多MET依赖型肿瘤中均有疗效,MET的突变类型和肿瘤依赖MET信号决定了选用何种靶药及靶药疗效,因此有效检测MET的突变类型对肿瘤治疗非常重要。
参考文献
1.Recondo Gonzalo,Che Jianwei,Jänne Pasi A et al. MET Targeting Dysregulation in Cancer.[J] .Cancer Discov, 2020.
2.Guo Robin,Luo Jia,Chang Jason et al. MET-dependent solid tumours-molecular diagnosis and targeted therapy.[J] .Nat Rev Clin Oncol, 2020.
3.Skoulidis F , Heymach J V . Co-occurring genomic alterations in non-small-cell lung cancer biology and therapy[J]. Nature reviews. Cancer, 2019, 19(6411).
4.Awad Mark M,Oxnard Geoffrey R,Jackman David M et al. MET Exon 14 Mutations in Non-Small-Cell Lung Cancer Are Associated With Advanced Age and Stage-Dependent MET Genomic Amplification and c-Met Overexpression. .J. Clin. Oncol., 2016, 34: 721-30.
5.Wolf J, Overbeck T R, Han J Y, et al. Capmatinib in patients with high-level MET-amplified advanced non–small cell lung cancer (NSCLC): results from the phase 2 GEOMETRY mono-1 study[J]. 2020,9509-9509.
6.Recondo G, Che J, Jänne PA, et al. Targeting MET Dysregulation in Cancer. Cancer Discov. 2020 Jul;10(7):922-934. doi: 10.1158/2159-8290.CD-19-1446.
7.Modi V, Dunbrack RL Jr. Defining a new nomenclature for the structures of active and inactive kinases. Proc Natl Acad Sci U S A. 2019 Apr 2;116(14):6818-6827. doi: 10.1073/pnas.1814279116.
8.Robin Guo, Jia Luo, Jason Chang,et al.MET-dependent solid tumours molecular diagnosis and targeted therapy.Nature Reviews Clinical Oncology volume 17, pages 569–587(2020).
9.Guo Robin,Luo Jia,Chang Jason et al. MET-dependent solid tumours - molecular diagnosis and targeted therapy.[J] .Nat Rev Clin Oncol, 2020, 17: 569-587.
10.Li Yan,Gao Lianju,Ma Di et al. Identification of MET exon14 skipping by targeted DNA- and RNA-based next-generation sequencing in pulmonary sarcomatoid carcinomas.[J] .Lung Cancer, 2018, 122: 113-119.


