EJC:所有胰腺癌,尤其是≤50岁的患者更要重视基因检测!
时间:2023-12-02 14:34:50 热度:37.1℃ 作者:网络
近年来,早发性胰腺癌(EOPC)的发病率急剧上升。本研究旨在描述EOPC的临床和基因组特征,并评估其治疗意义。回顾性分析了2010年至2022年期间在西班牙Vall d'Hebron肿瘤研究所(VHIO)就诊的EOPC(≤50岁)患者的临床、胚系和基因组特征,并同平均发病年龄的胰腺癌患者(AOPC,≥70岁)对照组进行比较。将关键分子发现与公共数据库队列进行比较。纳入了336例患者(EOPC N=139,AOPC N=197)。EOPC与诊断时吸烟状态、较低的糖尿病患病率、较好的体能状态、较高的CA19.9水平和较高的白蛋白水平相关。调整基线协变量后,观察到EOPC组和AOPC组的总生存期(OS)没有差异。在VHIO队列和验证队列中,年龄较大与KRAS突变发生率较高有关。在VHIO和验证队列中,根据ESCAT I–IIIA分类,与AOPC相比,EOPC富含潜在可靶向变异(分别为19% vs 14%和14% vs 8%)。在转移性患者的一线治疗中,EOPC的无进展生存期(风险比[HR]0.61,95%置信区间(CI)0.43-0.87)和OS较长(HR 0.65,95%CI 0.45-0.95),尽管缓解率没有差异。调整治疗线数后,接受靶向治疗的EOPC患者OS长于未接受靶向治疗的EOPC患者(HR 0.34,95%CI 0.12–0.93)。本研究表明,转移性EOPC患者的结局优于转移性AOPC患者。EOPC患者相较AOPC患者富含可靶向变异,可能获益于精准治疗。
研究背景
胰腺癌(PC)是一种侵袭性肿瘤,在过去十年中,5年总生存率(OS)基本保持不变,仅为12%。预计到2040年,PC将成为美国癌症相关死亡的第二大原因。尽管诊断时的中位年龄为71岁,但早发性胰腺癌(EOPC)(≤50岁)的发病率正惊人地增加,尤其是女性患者。EOPC导致潜在寿命不成比例的损失、生活质量的降低以及对专业医疗的要求,造成巨大的个人、社会和经济负担。
关于EOPC临床和基因组特征的数据较少。几项研究分析了EOPC的预后影响,利用全国数据库与平均发病年龄的胰腺癌(AOPC)进行比较,得出了相互矛盾的结果。这些研究的共同局限性是缺乏对重要的基线混杂因素的调整,如体能状态、CA19.9水平或肝转移的存在,以及肿瘤治疗信息不完整。
越来越多的证据揭示了基因检测对PC的作用,临床上将基因检测用于患者个体化治疗。KRAS突变(KRASMUT)见于约90%的PC,是PC的主要早期驱动因素。随后的事件包括TP53缺失和CDKN2A和/或SMAD4失活突变。值得注意的是,其余约10%的KRAS野生型(KRASWT)肿瘤常存在可靶向基因变异,如同源重组基因(包括BRCA1/2、PALB2)、错配修复缺陷(dMMR)、BRAF突变/融合、NRG1和NTRK融合等。这一发现对EOPC尤其相关,因为一些研究表明,该年龄组可能富含KRASWT肿瘤。
晚期PC的治疗依赖于全身化疗,FOLFIRINOX和吉西他滨+nab-紫杉醇方案显示出类似的生存获益。自2019年批准PARP抑制剂奥拉帕利用于胚系BRCA1/2突变以来,正积极探索该疾病的个体化疗法。重要的是,Know Your Tumour项目证明了接受精准治疗的PDAC患者的生存获益。然而,目前尚不清楚EOPC是否富含这些潜在可靶向变异,匹配的治疗是否能为这一特定的PC患者群体带来潜在的生存获益。
为了解决这些问题,本研究比较了2010年至2022年在我中心就诊的EOPC和AOPC的临床、胚系和基因组特征,评估了潜在可靶向变异的发生率,以及靶向治疗在这些人群中的作用。并将关键分子结果与独立队列进行比较。
研究结果
EOPC的临床特征和生存结局
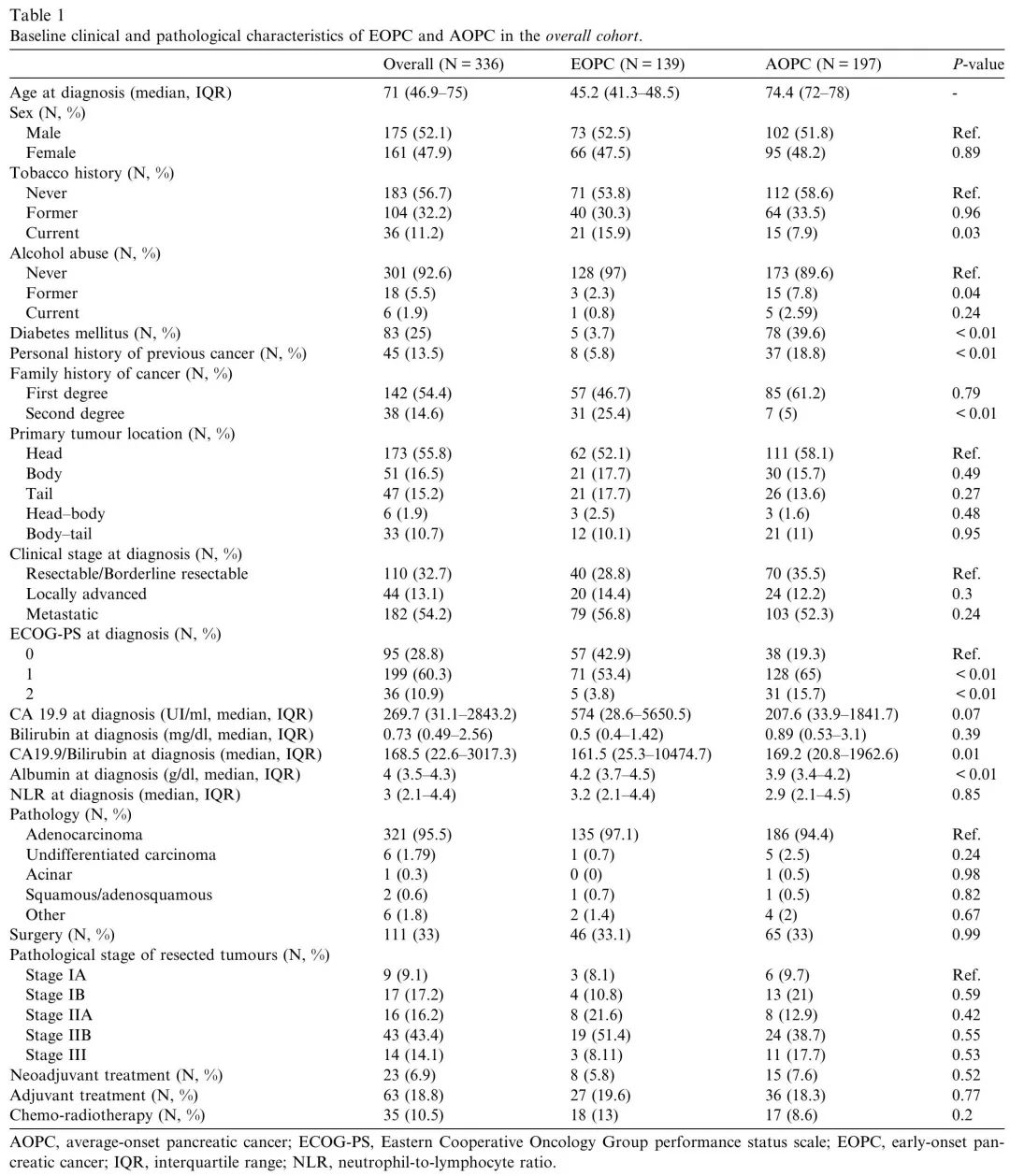
本研究回顾了2010年至2022年期间在西班牙Vall d'Hebron肿瘤研究所(VHIO)新诊断为PC的患者,筛选出EOPC(≤50岁)和AOPC(≥70岁)。在824例潜在符合条件的患者中,336例最终被纳入整体队列,包括139例EOPC和197例AOPC(图1)。EOPC与AOPC的基线临床特征如表1所示。EOPC诊断时的中位年龄为45.2岁(IQR 41.3–48.5岁),AOPC为74.4岁(IQR 72–78岁)。EOPC与较高比例的当前吸烟状态、二级亲属癌症史、较好的体能状态、较高的基线白蛋白水平、较高的基线CA19.9/胆红素比值、较低的2型糖尿病发病率和较低比例的癌症个人史相关(表1)。
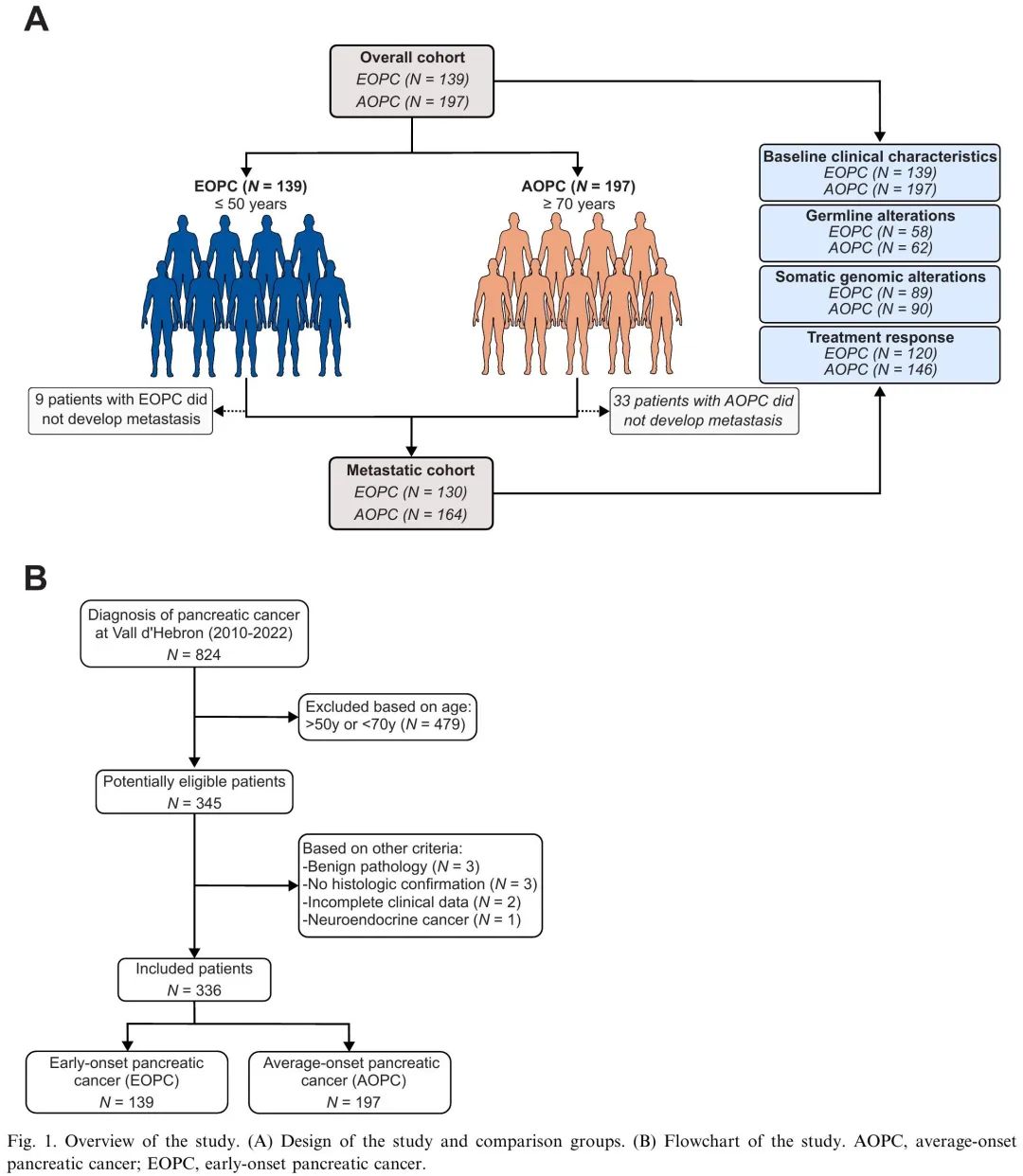
图1. 研究设计和流程
表1. 整体队列中EOPC和AOPC的基线临床和病理特征
中位随访时间为54.8个月(95%置信区间(CI)47.1–63.2个月),EOPC组为58.6个月,AOPC组为39.7个月。我们发现两组的OS没有差异(图2A)。考虑到EOPC和AOPC之间的基线不平衡和潜在混杂因素,使用了IPTW方法(一种统计模型,通过为每个个体分配不同的权重来平衡基线特征)。再次发现OS没有差异(图2B),即使在模型中纳入残留不平衡作为协变量后(HR 0.88 [95%CI 0.61-1.27,P=0.5])。使用多变量Cox回归模型,进一步证实了这些发现(图2C)。有趣的是,切除的EOPC患者显示出比AOPC患者复发时间更短的趋势,先前的研究也观察到类似的结果。
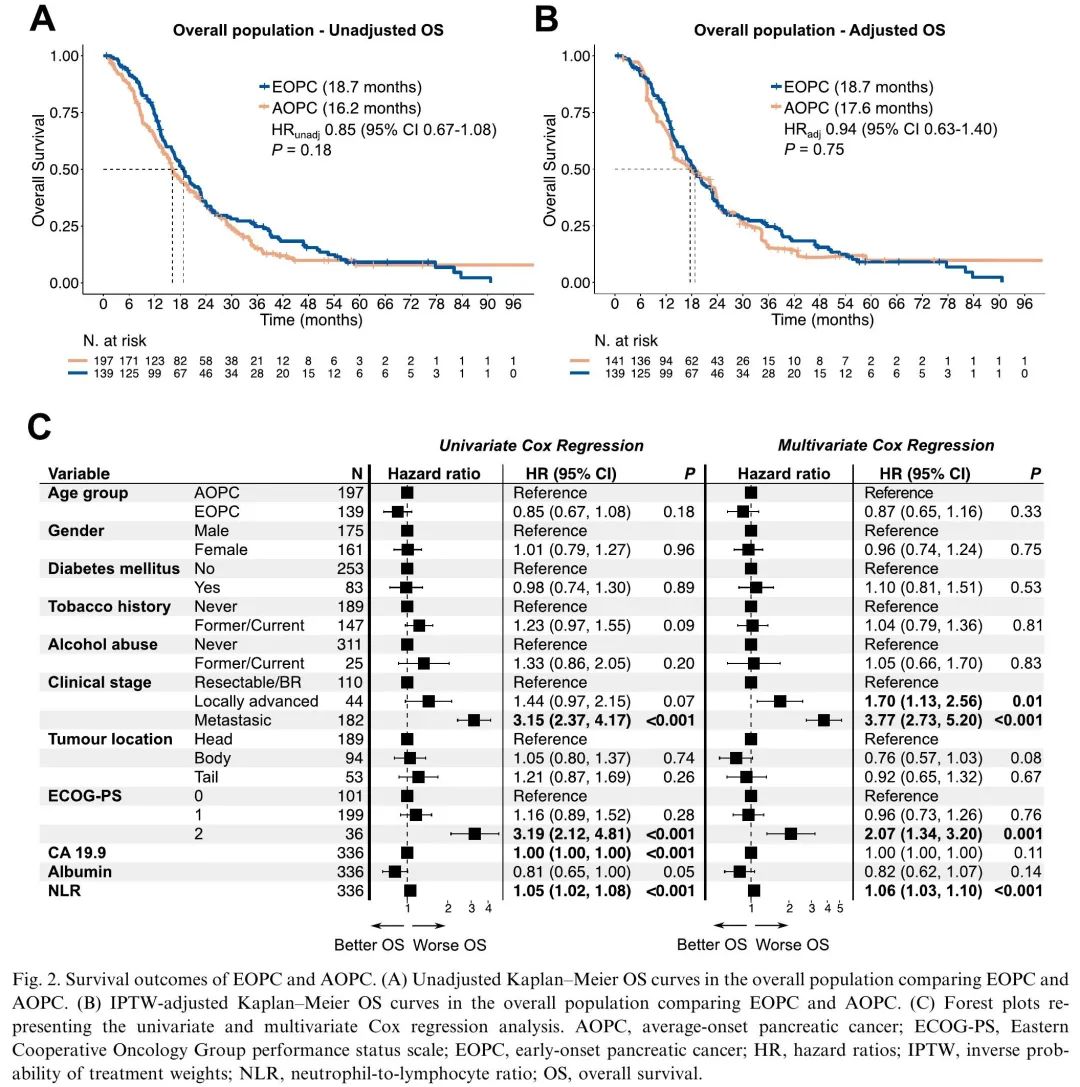
图2. EOPC和AOPC的生存结局
EOPC的胚系变异
接下来,分析了EOPC和AOPC中胚系变异的发生率。58例EOPC患者(41.7%)和62例AOPC患者(31.5%)进行了胚系检测。胚系变异的患者更有可能有癌症个人史,诊断时为转移性疾病。我们发现EOPC中致病性胚系变异(PGV)的发生率在数值上更高,尽管差异无统计学意义(分别为22.4%和12.9%,P=0.18;图3A)。BRCA2胚系变异在EOPC和AOPC中均最常见,但EOPC特征性携带其他基因变异,包括TP53、PMS2或MSH6,这些变异在AOPC中未观察到(图3A)。有趣的是,PGV携带者结局优于未携带者,无论患者年龄组如何(图3B-C),并且在调整诊断时临床分期和ECOG PS后差异仍然显著(HR 0.43 [95%CI 0.24-0.79],P=0.006)。
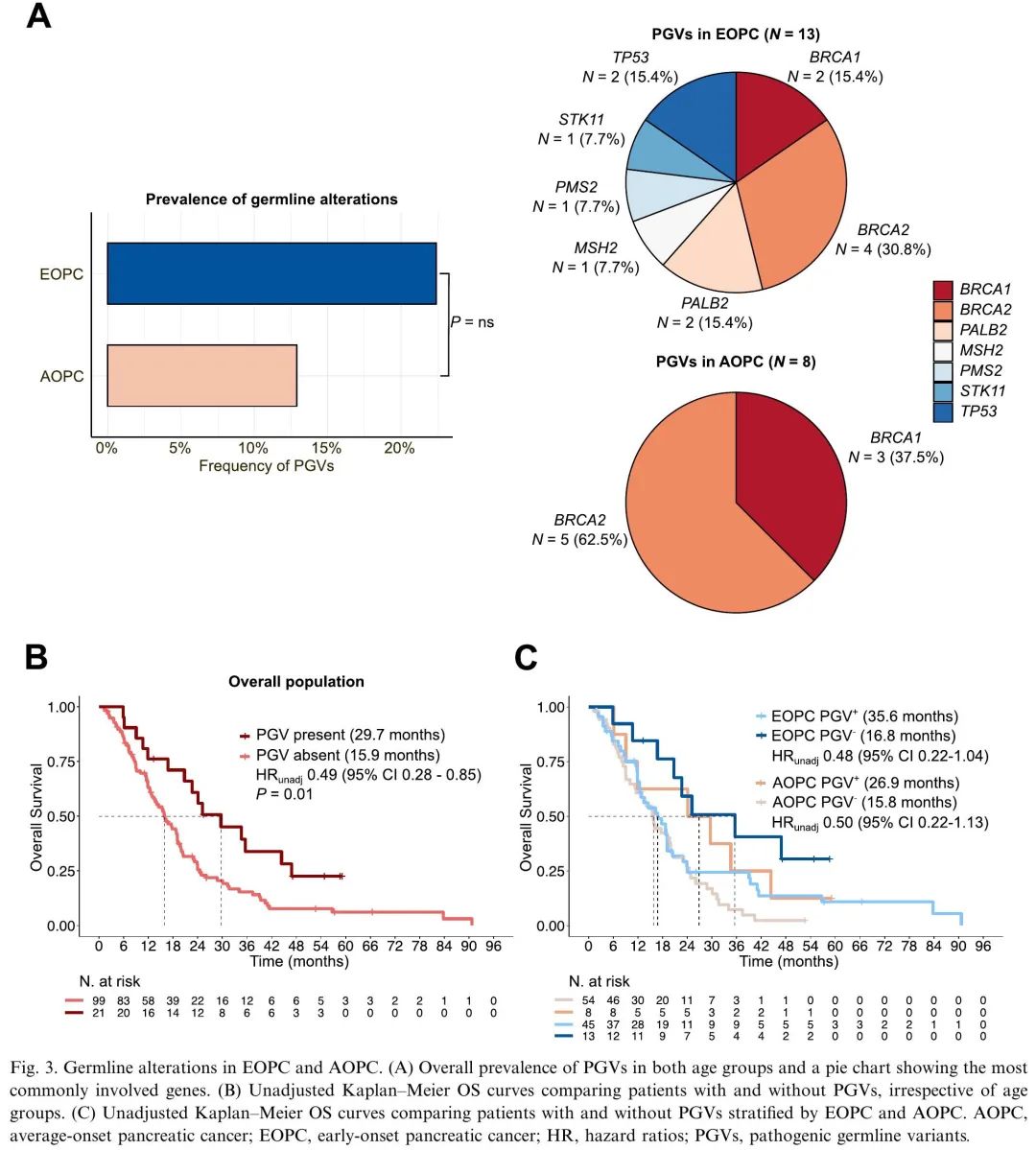
图3. EOPC和AOPC胚系变异
EOPC的基因图谱和可靶向变异
89例EOPC(64%)和90例AOPC(45.7%)患者进行了下一代测序(NGS)(图1A)。进行肿瘤测序的患者比未测序的患者接受手术的比例更高。此外,分析了45例EOPC(32.3%)和50例AOPC(25.4%)患者的融合。将关键结果与cBioPortal MSK MetTropism验证队列(以下简称“MSK队列”)进行比较,该队列包括181例EOPC和622例AOPC患者。正如预期,我们队列中最常见的驱动事件是KRAS、TP53、CDKN2A和SMAD4(图4A)。在VHIO队列(比值比1.03,95%CI 1-1.06,P=0.04)和MSK队列(比值比1.04,95%CI 1.03-1.06,P<0.01)中,作为一个连续变量,年龄较大与KRAS突变发生率较高有关。我们发现EOPC和AOPC之间KRAS变异的分布没有差异。两个年龄组中最常见的KRAS变异均是KRASG12D。关于KRASWT的发生率,在EOPC患者中,VHIO队列为16.9%,MSK队列为17.1%,而在AOPC中,这一比例在VHIO和MSK队列分别降至8.9%和5.5%(P分别为0.12和<0.01,图4B-C)。在40岁以下的患者中,KRASWT在VHIO和MSK队列中的发生率分别为27.3%和30.8%(P分别为0.07和<0.01,图4B-C),尽管该年龄组的患者数量有限。
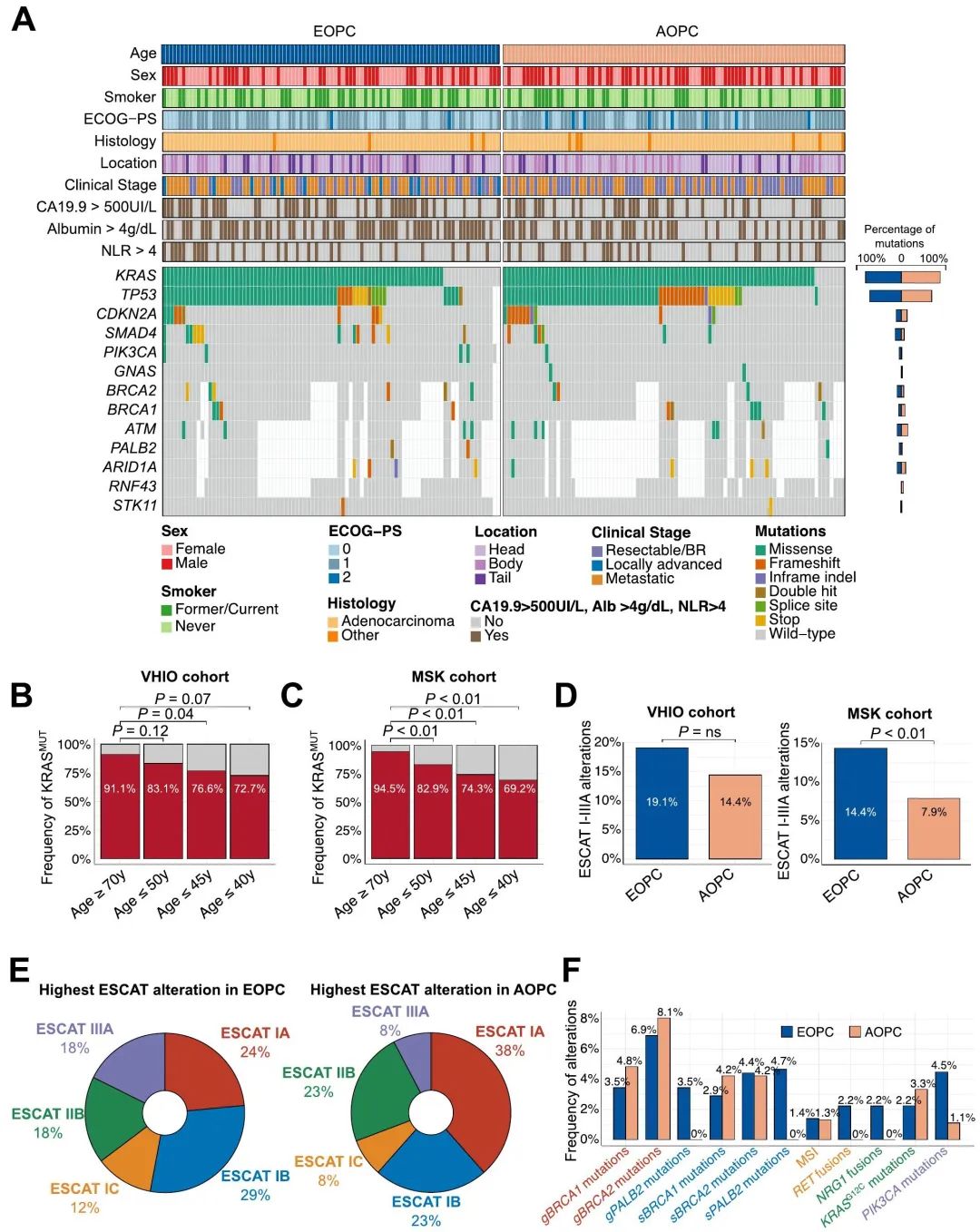

图4. EOPC的基因图谱和可靶向变异
为了确定EOPC中是否富含潜在可靶向变异,我们根据ESCAT指南对分子变异进行了分类,重点关注I–IIIA类别。值得注意的是,我们无法评估MSK队列的胚系变异,但变异可能在肿瘤NGS中检出。在VHIO(分别为19.1%和14.4%)和MSK(分别为14.4%和7.9%)队列中,均是EOPC中ESCAT I–IIIA变异的发生率高于AOPC,尽管这种差异仅在MSK队列显著(图4D)。在两个队列均观察到ESCAT变异在KRASWT患者中富集,无论年龄组如何。在VHIO队列中,两个年龄组中最常见的变异均归类为ESCAT I(图4E),特别是由于BRCA1/2基因胚系变异(图4F)。由于缺乏胚系信息,在MSK队列中,没有变异可以归为IA类。
转移性EOPC的生存结局和治疗反应
接下来,评估了转移性EOPC的生存结局以及对系统治疗反应的潜在差异。纳入了在诊断时或在疾病过程中最终发生转移的130例EOPC患者和164例AOPC患者(图1A)。更高比例的EOPC患者接受了基于5FU的化疗方案(44% vs 15%,P<0.01),而AOPC更有可能接受基于吉西他滨的方案(53.5% vs 74.9%,P<0.01)(图5A)。两个年龄组均有超过90%的患者接受了一线联合治疗。EOPC在疾病过程中接受的治疗线数高于AOPC(中位2 vs 1,P<0.01,图5B)。应用IPTW调整后,EOPC患者的OS优于AOPC(图5C),即使在模型中包括残余不平衡作为协变量(HR 0.68,[95%CI 0.48-0.97],P=0.04)。多变量Cox回归分析,以及一线吉西他滨+nab-紫杉醇治疗患者亚组分析,也获得了类似的结果。
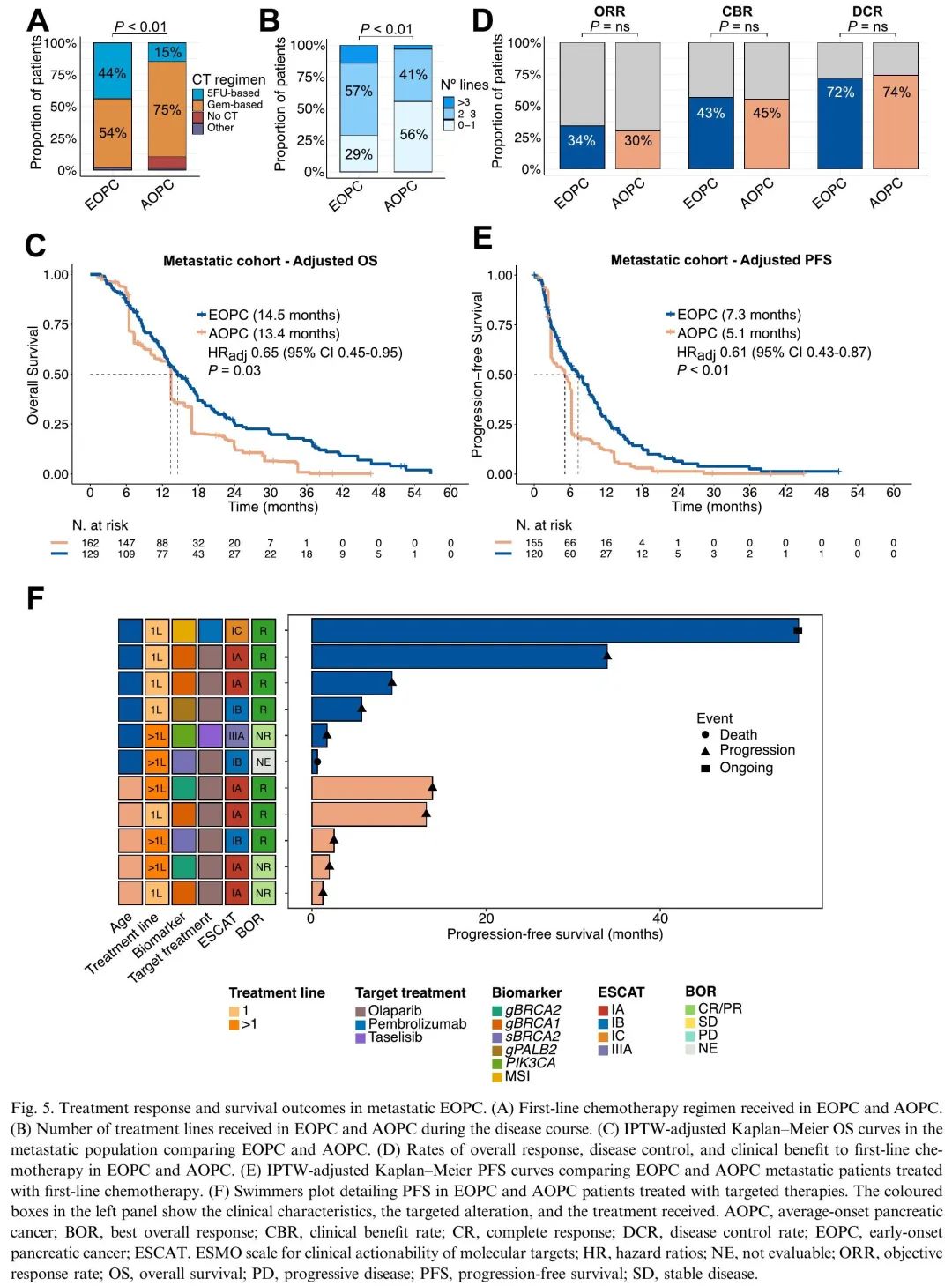
图5. 转移性EOPC的生存结局和治疗反应
为了探索对一线化疗反应的差异,首先评估了客观缓解率、临床获益率和疾病控制率,发现EOPC和AOPC之间没有差异(图5D)。然而,调整后,发现EOPC患者的PFS(HR 0.61,95%CI 0.43-0.87)和OS(HR 0.65,95%CI 0.45–0.95)显著长于AOPC患者(图5E)。多变量Cox回归分析也显示这一结果。
EOPC的靶向治疗
识别了在疾病过程中接受靶向治疗的6例EOPC(占携带ESCAT变异的EOPC患者的30%)和5例AOPC(42%)患者(图5F)。大多数患者携带胚系或体细胞BRCA1/2致病性变异,接受了奥拉帕利治疗。1例EOPC患者携带胚系MSH2致病性变异和MSI-H,接受了帕博利珠单抗治疗,另1例患者存在PI3KCA致病性变异,接受了taselisib治疗。我们发现EOPC和AOPC患者的PFS没有显著差异(图5F),尽管事件数量较少,无法得出明确结论。有趣的是,接受靶向治疗的EOPC患者的OS长于未接受靶向治疗的EOPC患者(HR 0.3,95%CI 0.11–0.83),即使在调整治疗线数后也是如此(HR 0.34,95%CI 0.12–0.93);在AOPC患者中观察到类似的趋势(HR 0.41,95%CI 0.17–1.02),尽管在调整治疗线数后未观察到(HR 0.82,95%CI 0.32–2.11;P interaction = 0.23),可能反映了缺乏统计功效。
讨 论
PC仍然是一种严重的疾病,生存结局令人沮丧,治疗选择有限。尽管EOPC仅占所有病例的5-10%,但其发病率正惊人地上升,可能成为全球健康问题。目前,许多EOPC相关研究都依赖于对缺乏分子信息的国家数据库的分析,或者探索了没有详细临床信息的公共基因组数据库。本研究通过分析有临床信息的139例EOPC和197例AOPC患者队列,并将其与胚系和体细胞变异相结合,对EOPC进行了全面回顾,对临床治疗具有潜在意义。
关于年龄对PC预后的影响,有很多争论。先前的分析得出了相互矛盾的结果,原因可能是对重要预后因素的调整次优。我们收集了详细的临床信息,包括最相关的预后因素,并应用两种不同的统计方法来处理基线不平衡。本研究结果表明,较小的年龄本身不影响预后,EOPC患者的生存与AOPC患者一样差,这与最近的其他回顾性分析一致。相反,本研究表明,诊断为或发展为转移性EOPC的患者生存优于AOPC,这可能是由于接受了更密集的治疗和其他未评估的混杂因素。EOPC患者一线化疗的缓解率没有更高,PFS和OS更长。
一小部分PC患者有易感家族性疾病,携带PGV,临床上可进行靶向治疗。先前美国的研究表明,9.7-19.8%的PC患者携带PGV。本研究显示,高达22%的EOPC和13%的AOPC携带PGV。这可能高于实际,因为并非所有患者都进行了PGV检测,这主要取决于临床医生的判断以及患者的癌症个人和家族史。重要的是,本研究结果表明,携带胚系变异的PC患者生存结局优于未携带者,无论年龄组如何,与先前的研究结果一致。在POLO筛查项目中,BRCA1/2变异的发生率存在区域和种族异质性,未来需要更多研究,来探索PGV发生率的区域和种族差异。
与既往研究结果一致,我们发现EOPC患者富含KRASWT肿瘤,并利用公共基因组数据库验证了这一发现。这些肿瘤的特征是富含潜在可靶向变异。类似地,根据ESCAT分类,约15-20%的EOPC患者存在潜在可靶向变异,而AOPC患者的这一比例为7-14%。此外,接受靶向治疗的EOPC患者生存结局优于未接受靶向治疗的EOPC患者,提示EOPC患者可能获益于精准治疗,促使所有临床医生在临床上积极探索这些变异。
本研究存在几个局限。首先,这是对在我中心接受治疗的患者的回顾性分析,可能不适用于所有国家和地区。第二,尽管EOPC中KRASWT肿瘤比例较高,但这并不能解释EOPC的独特特征。未来评估表观遗传学、微环境和转录组学特征的研究对于阐明EOPC是否遵循独特的致癌过程很关键,进一步评估相关饮食、遗传和环境风险因素很重要。最后,接受靶向治疗的患者人数较少,异质性治疗限制了分析的统计功效,需要在未来进行验证。
总之,本研究对EOPC进行了全面回顾,发现该人群富含可靶向变异,可能获益于精准治疗。本研究结果强调了所有PC患者,尤其是EOPC患者进行基因检测的重要性。
参考文献:
Castet F, Fabregat-Franco C, Castillo G, Navarro V, Sierra A, Acosta DA, López-Valbuena D, Dienstmann R, Tabernero J, Vivancos A, Tian TV, Macarulla T. Clinical and genomic characterisation of early-onset pancreatic cancer. Eur J Cancer. 2023 Sep 9;194:113338. doi: 10.1016/j.ejca.2023.113338. Epub ahead of print. PMID: 37793216.



