Nat Chem Biol:中国药科大学肖易倍/陈美容发现pAgo介导细菌防御系统的新机制
时间:2023-11-18 21:37:30 热度:37.1℃ 作者:网络
短原核Ago占大多数原核Argonaute蛋白(pAgos),并参与保护细菌免受入侵的核酸。与TIR-APAZ (SPARTA)相关的短pAgo已被证明在引导介导的靶DNA识别中寡聚并消耗NAD+。然而,SPARTA抑制和激活的分子基础尚不清楚。
2023年11月6日,中国药科大学肖易倍及陈美容共同通讯在Nature Chemical Biology 在线发表题为“Auto-inhibition and activation of a short Argonaute-associated TIR-APAZ defense system”的研究论文,该研究测定了嗜热Crenotalea thermophila SPARTA在被抑制、瞬时和激活状态下的冷冻电镜结构。
SPARTA单体被它的酸性尾部自动抑制,它占据了导靶结合通道。向导介导的靶标结合排除了酸性尾部,引发了大量构象变化,暴露了Ago-Ago二聚化界面。结果,SPARTA组装成一个活性四聚体,其中四个TIR结构域被重新排列和包装以形成NADase活性位点。该研究为解释SPARTA的自抑制和激活提供了全景视野,并扩大了对pAgo介导的细菌防御系统的理解。

Argonaute蛋白(Agos)是真核生物和原核生物中都存在的防御元件,它利用小的(通常为15-30个核苷酸(nt)长)寡核苷酸作为靶向互补核酸的向导。所有真核Ago蛋白(eAgos)都具有一个N (N端)结构域、一个PAZ (PIWI- argonaute - zwille)结构域、一个MID(中间)结构域和一个PIWI (P-element-induced wimimpy testis)结构域,构成一个双叶支架,用于ssRNA引导的互补RNA沉默。原核Ago蛋白(pAgos)比eAgos具有更高的多样性,大致可分为长a Ago、长b Ago和短Ago。短Ago占pAgos的一半以上,但缺少N域和PAZ域。这种“不完美的”短Ago通常由编码在同一操纵子中的APAZ (PAZ类似物)结构域补充,该结构域通常附加另一个功能结构域,包括Toll -白细胞介素受体(TIR)、沉默信息调节因子2 (SIR2)、Schlafen/Alba、Mrr-like、RecB和RecG/DHS-like结构域。其中,与TIR和Sir2融合的APAZ/short Ago最为丰富,与宿主防御有关。然而,短Ago的详细功能和分子机制仍然知之甚少。
最近的一项研究发现了一种名为short prokaryotic Argonaute TIR-APAZ (SPARTA)的原核免疫系统,它由一个操纵子中的短Ago和TIR-APAZ组成,通过TIR催化的NAD+消耗来保护宿主免受质粒入侵。在SPARTA体系中,短Ago最初与TIR-APAZ结合,形成异源二聚体,其中TIR-APAZ的NADase活性被短Ago抑制。在向导RNA 介导的靶 DNA 结合后,斯巴达异二聚体组装成高级寡聚体,TIR 介导的NADase 活性被释放。与长Ago不同,短Ago在SPARTA系统中可能作为核酸传感器来控制NADase活性,而长Ago通常作为核酸内切酶来沉默引导互补靶标。然而,Ago在多大程度上抑制和激活辅助效应TIR以响应导靶双工结合仍不清楚。
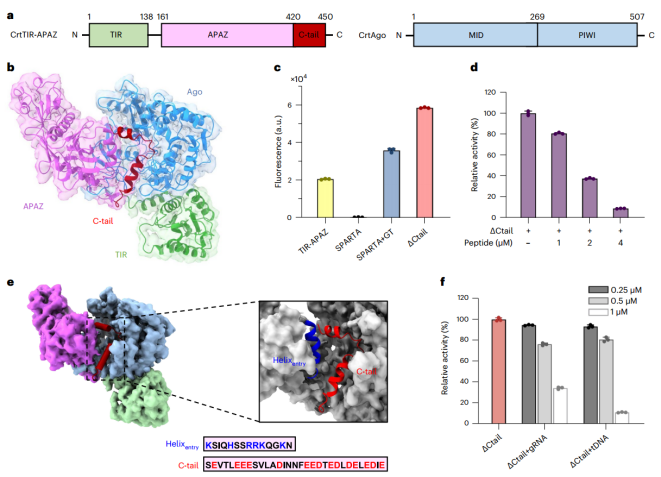
酸性C端尾部对SPARTA的自抑制作用(图源自Nature Chemical Biology )
Toll/白细胞介素-1耐药基因(TIR)结构域作为免疫系统的重要组成部分广泛分布于生命之树中。一般来说,TIR结构域的激活依赖于寡聚化。真核生物的TIR结构域通过自组装或与其他含TIR的伙伴结合,主要起到酶水解NAD+或促进信号转导的支架作用。与真核生物相比,对原核生物TIR结构域组装的认识有限。最近的研究表明,细菌STING相关和嘧啶环化酶相关的TIRs在噬菌体入侵时组装成丝以完成NADase功能。在SPARTA体系中,TIR结构域如何在寡聚的SPARTA中排列以完成NADase的激活还有待研究。
该研究主要探讨了嗜热Crenotalea thermophila SPARTA系统的作用机制。利用冷冻电子显微镜(cryo-EM),获得了一套完整的结构,代表了CrtSPARTA的自抑制状态、三种瞬态和活性状态。结合生物化学证据,该研究结果揭示了自身抑制和靶ssDNA结合诱导的SPARTA激活的详细机制。TIR-APAZ保守的C端酸性尾(C-tail)占据由短Ago和APAZ构成的导靶结合通道,抑制SPARTA活性。这种自抑制作用将在引导介导的靶标结合去除C尾后释放出来。通道中适当的导靶双相形成触发一系列构象变化,从而诱导新的Ago-Ago二聚化界面的暴露,促进SPARTA寡聚化。活化的SPARTA揭示了一个TIR-APAZ4 /短Ago4四聚体,其中四个TIR结构域被重组和包装以形成NADase活性中心。该研究为SPARTA的自我抑制和激活提供了结构基础,并扩展了对细菌防御入侵核酸的短原核Ago的理解。
原文链接:
https://www.nature.com/articles/s41589-023-01478-0


