迟洪波团队最新Nature:利用体内单细胞CRISPR筛选,绘制肿瘤T细胞命运调控网络
时间:2023-11-18 21:21:03 热度:37.1℃ 作者:网络
免疫疗法是治疗癌症的有效方法,如过继细胞疗法(ACT)和免疫检查点阻断疗法(ICB)。CD8+细胞毒性T细胞(CTLs)协调抗肿瘤免疫,并表现出固有的异质性,前体耗竭前体T细胞((Tpex))能够对现有免疫疗法有反应。作为CTL分化基础的基因调控网络以及终末耗竭T细胞(Tex)的反应是否可以在功能上重新激活还不完全清楚。为此,美国圣裘德儿童研究医院迟洪波教授及其团队在体内使用单细胞CRISPR筛选系统地绘制了因果基因调控网络,并发现了CTL分化检查点。首先,Tpex细胞从静止状态中退出,开始向中间Tex细胞连续分化。这一过程受到IKAROS和ETS1的不同调控,它们分别抑制和增加mTORC1相关的代谢活性。IKAROS-缺陷细胞在ICB后,作为一种代谢静止的Tpex细胞群积累,分化潜能有限。相反,靶向ETS1通过促进Tpex向中间Tex细胞的分化和代谢重组,提高抗肿瘤免疫和ICB活性。在机制上,TCF-1和BATF分别是IKAROS和ETS1的靶点。第二,RBPJ-IRF1轴促进中间Tex向末端Tex细胞分化。因此,靶向RBPJ增强Tex细胞向增殖状态的功能和表观遗传重编程,改善了治疗效果和疗效。总的来说,本研究表明,促进Tpex细胞从静止状态中退出和丰富增殖Tex细胞状态是抗肿瘤感染的关键模式,并为整合细胞命运调节和可编程功能决定因素提供一个系统框架。相关研究成果以题为“Single-cell CRISPR screens in vivo map T cell fate regulomes in cancer”的论文于2023年11月15日发表在最新一期《Nature》。

【肿瘤内CTLs的体内scCRISPR筛选揭示共同功能模块和基因程序的连通性】
为了建立共同功能模块和下游基因程序,首先通过比较172个TF扰动(与NTC相比),分析不同的基因表达模式。通过基于液滴测序来评估供体来源的肿瘤浸润淋巴细胞(TILs)的单细胞sgRNA和转录组文库(图1a)。在42209个携带单基因扰动的细胞中,计算每个遗传基因扰动与NTC的比例,NTC显示肿瘤内CTL积累的阳性(Stat5a,Stat5b和Irf4)和阴性(Nr4a3和Fli1)调控因子(图1b)。确定了9个具有缩小或不同功能效应的共功能TF模块,以及4个与效应功能、衰竭、干性和增殖相关的共同调控基因程序(图1c)。这些基因程序在Tpex、Tex和Teff细胞簇中显示出不同的分子特征(图1d)。接下来可视化了9个共功能模块对4个共调控基因程序的扰动效应强度,并确定了6个模块(M2、M3和M5-M8)具有显著效应(图1e)。以上结果表明,这些模块对效应功能、衰竭、干性和增殖程序具有复杂但协同的影响。为了揭示模块内和模块间的调节电路,在6个主要模块之间生成一个聚焦的GRN,并评估相互作用强度(图1f)。Rbpj、Ikzf2和Klf13(M8)、Runx3、Ikzf1和Nfat5(M3)、Foxo1(M6)、Tcf7、Myb和Ets1(M7)、Bach2(M5)和Id2(M2)在各自的模块中具有较大的调节作用(图1g),因此它们是中心枢纽TFs。鉴于在慢性感染中对中间性和暂时性Tex细胞的鉴定,将Tpex和Tex簇分为前体耗竭样状态1(Tpex1)、Tpex2、末端耗竭样状态1(Tex1)和Tex2细胞,通过伪时间分析预测了从Tpex1到过渡性Tpex2和Tex1细胞状态到Tex2细胞的轨迹(图1h、i)。此外,Tpex1细胞状态表达的干细胞相关基因,这些基因在分化过程中逐渐下调(图1j)。

图1 肿瘤内CTLs的体内scCRISPR筛选揭示共同功能模块和基因程序的连通性
【IKAROS-TCF-1轴在Tpex细胞静止时退出】
表达Ikzf1 sgRNA(sgIkzf1)的OT-I细胞显示出有效的Ikzf1基因靶向性,并在转移后第7天在TME中显著积累(图2a)。在Ikzf1扰动后,Tpex细胞增加,而Tex细胞的百分比减少,但数量没有减少(图2b)。因此,IKAROS促进Tpex向Tex细胞分化。scRNA-seq分析显示,sgIkzf1 OT-I细胞在转录上与sgNTC OT-I细胞不同,含有更多的Tpex细胞,特别是Tpex1细胞,但Tex细胞较少(图2c)。伪时间分析显示,sgIkzf1细胞主要在Tpex1细胞状态下积累(图2d)。事实上,sgIkzf1 Tpex细胞在转移后第7天表现出mTORC1相关特征降低和MitoSOX及增殖标志物水平降低(图2e、f)。与sgNTC OT-I细胞不同,sgIkzf1 OT-I细胞在抗PD-L1处理后没有增加,也没有显示出分化状态的改变(图2g、h)。在抗PD-L1处理后,sgIkzf1细胞也没有上调IFNγ或GZMB的表达(图2i)。ATAC-seq分析显示,sgIkzf1 Tpex细胞显示出Tpex选择性开放染色质区域(ocr)可及性增加,但Tex选择性ocr的可及性降低(图2j),表明干细胞相关的增强,衰竭相关的表观遗传程序减少。共同靶向Ikzf1和Tcf7纠正了Tpex细胞的改变和在Ikzf1缺陷细胞中观察到的Tpex与Tex细胞的比例(图2k、l)。以上结果表明,IKAROS主要通过抑制TCF-1来影响Tpex向Tex细胞的分化。

图2 IKAROS促进Tpex1细胞的静止退出
【ETS1-BATF轴限制Tex1细胞的生成】
为了研究ETS1在CTL异质性中的作用,有效地靶向OT-I细胞中的Ets1,并进行scRNA-seq。Ets1缺陷细胞显示Tex1细胞扩增,同时Tpex细胞比例减少(图3a)。此外,Ets1缺失增强TME中OT-I和Tex细胞的积累,但没有增强脾脏或tdLN(图3b、c)。肿瘤内Ets1缺陷细胞也显示出与效应功能、细胞毒性和增殖相关的标记物的表达增加(图3d、e)。在转移Ets1缺陷的Tpex细胞后,由Tpex细胞产生的总OT-I和Tex细胞数量增加,这一发现与更广泛的增殖相关(图3f)。为了测试治疗效果,进行过继细胞治疗实验。转移Ets1缺陷的OT-I细胞或pmel细胞分别降低B16-OVA和B16-F10肿瘤的生长(图3g、h)。针对人CD19(hCD19)的Ets1缺陷CAR-T细胞在表达hCD19的B16肿瘤中也显示出更高的治疗效果(图3i)。与B16-OVA和E.G7-OVA肿瘤中的对照组相比,联合治疗缺乏Ets1细胞的抗PD-L1增强抗肿瘤作用(图3j),表明在CD8+ T细胞中靶向Ets1增强了ICB反应。在晚期基底细胞癌(BCC)患者的CTLs的scRNA-seq分析中,抗PD-1治疗诱导激活的CD8+ T细胞群的ETS1和IFNG表达水平降低(图3k)。TF基序富集和足迹分析显示,Ets1缺陷的细胞增强了BATF的活性,BATF是CTL效应功能的有效调节因子(图3l)。将转导sgNTC、sgEts1、sgBatf或sgEts1和sgAT-I细胞的OT-I细胞转移到B16-OVA荷瘤小鼠中,发现靶向Ets1和Batf逆转了总细胞和Tex细胞积累的增加(图3m)。Batf共靶向也逆转了GZMB+、IFNγ+和Ki67+Ets1缺陷细胞百分比的增加(图3n)。因此,ETS1-BATF轴限制了Tex细胞的积累和效应反应。
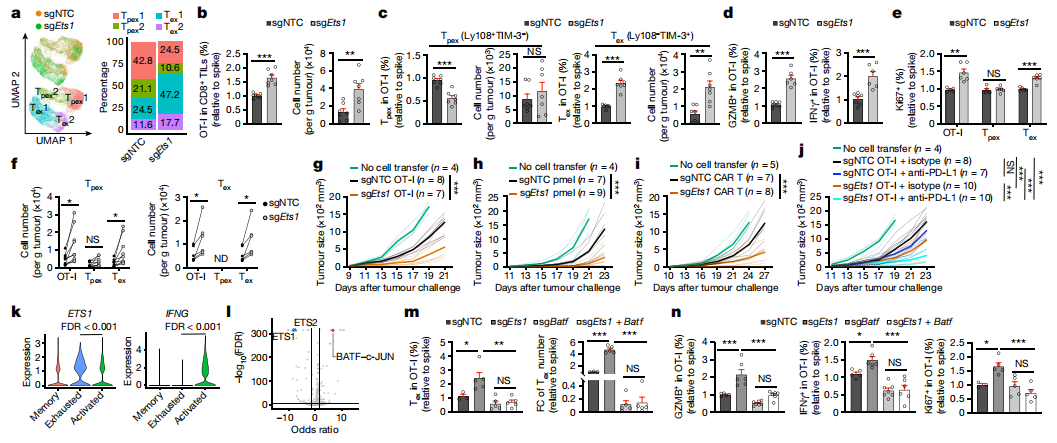
图3 ETS1是Tpex到Tex1细胞过渡的关键
【RBPJ驱动Tex1到Tex2单元的转换】
本研究确定Rbpj扰动是增加Tex1到Tex2细胞比例的首选候选因素(图4a)。观察到在表达这些sgRNAs的细胞中,TME中OT-I细胞积累更大,而不是脾脏或tdLN(图4b)。Rbpj缺失增加了Tex细胞的比例和积累,但降低了Tpex细胞的频率(图4c)。它也增加了Tex细胞增殖,但没有改变细胞凋亡(图4d)。将sgNTC或sgRbpj细胞分别转移到荷瘤小鼠后,也观察到类似的效果(图4e)。因此,RBPJ选择性地限制了Tex细胞在TME中的积累。在Tex细胞中,OT-I细胞中RBPJ的表达高于其他肿瘤内或外周血的CD8+ T细胞群(图4f)。在Tex细胞5,9的二次转移实验中,Rbpj缺失增加Tex细胞的积累,这与增殖增加相关(图4g、h)。接下来进行scRNA-seq分析,发现在Rbpj缺陷的细胞中,Tex1细胞显著增加(图4i、j)。在伪时间分析中,基于Tcf 7和Entpd1的中间表达和Mki67的高表达,Rbpj缺陷细胞聚集在分化轨迹的中间(图4k),这通过增加Ki67+ Tex细胞百分比来验证(图4l)。因此,Rbpj缺失导致Tex1细胞的选择性积累。

图4 RBPJ驱动Tex1向Tex2细胞分化
【耗竭会增加RBPJ在人类癌症中的表达】
来自人类肿瘤组织的CD8+ T细胞中RBPJ增加,并在非小细胞肺癌(NSCLC)患者和结直肠癌(CRC)患者的瘤内CD8+ T细胞中与HAVCR2共表达(图5a)。来自黑色素瘤患者的瘤内CD8+ T细胞获得幼稚样、过渡性和功能障碍状态,RBPJ的表达从幼稚样细胞逐渐增加到功能障碍细胞(图5b)。Rbpj缺陷细胞增加了GZMB+和IFNγ+的频率和数量,也上调了穿孔素和其他效应相关分子的表达(图5c),表明细胞毒性和效应物的特征增强。根据其增强的效应功能,Rbpj缺陷的OT-I细胞更好地控制肿瘤生长,并延长B16-OVA荷瘤小鼠的生存期(图5d)。在将pmel细胞转移到B16-F10荷瘤小鼠后也观察到类似结果(图5e)。与单独治疗相比,这种策略增强了抗肿瘤效果(图5f)。Rbpj缺陷的CAR-T细胞在限制肿瘤生长方面提高了疗效(图5g)。与对照组相比,使用抗PD-L1的Rbpj缺陷OT-I细胞联合治疗E.G7-OVA荷瘤小鼠增强了抗肿瘤作用(图5h),表明在CTLs中靶向Rbpj也能促进淋巴瘤模型中的ICB反应。综上结果表明,在CTL中靶向Rbpj可诱导强大的抗肿瘤作用。对Rbpj缺陷的Tex细胞中可及性增加的ocrTF基序分析发现,IRF1是最富集的基序,以及效应功能相关的TFBLIMP1和BATF16(图5i)。同时靶向Rbpj和Irf1可以减少Rbpj缺失导致的总OT-I和Tex细胞的积累(图5j、k)。Irf1共靶向可以减轻sgNTC和sgRbpj细胞之间转录组谱的改变(图5l)。在验证实验中,这种共靶向逆转了由Rbpj缺失导致的Ki67+、GZMB+和IFNγ+ OT-I细胞百分比的增加(图5m、n)。以上结果表明,IRF1是Rbpj缺陷诱导的Tex细胞增殖和效应功能和抗肿瘤作用所必需的。
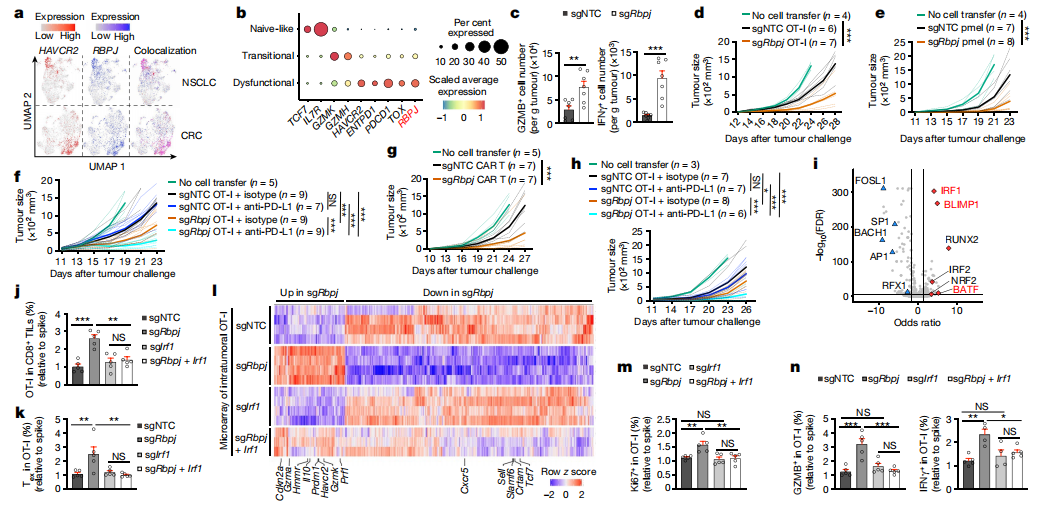
图5 RBPJ缺乏促进CTL功能恢复
【总结】
综上所述,本研究提供了一个基于遗传电路和分子决定因素的肿瘤内CTL反应的功能异质性的系统框架,包括进行性CTL分化的三个检查点。研究结果强调了诱导Tpex细胞的静止退出和丰富增殖的Tex细胞状态,以恢复CTL抗肿瘤反应的功能模式。值得注意的是,共同功能模块的模块内和模块间连接可能揭示未知的遗传相互作用,并扩展系统生物学中的通路映射,这种方法是可扩展的,适用于其他生物系统。总之,这些结果建立了TME中CD8+ T细胞进展分化的扰动图,并确定了Tpex和Tex细胞功能重编程的公认可操作靶点,以改善癌症免疫治疗。
原文链接:
https://doi.org/10.1038/s41586-023-06733-x


