前沿进展 | 胃癌中基于免疫检查点抑制剂疗效预测的生物标志物
时间:2023-11-05 14:40:54 热度:37.1℃ 作者:网络
胃癌(gastric cancer,GC)是世界范围内最常见的恶性肿瘤之一。2020年最新的全球癌症负担数据也显示,我国消化道癌症的新发病例和死亡病例位列全球之首。《癌症临床医生杂志》2016年发表的研究数据指出,中国每年胃癌发病率约68万人,占全球新发病例总数的一半,同时每年死于胃癌的人数大约有50万人[1]。胃癌的发生发展是由多因素引起的,其平均基因拷贝数的变化远高于其他肿瘤类型,表明胃癌是一种异质性极强的肿瘤。而其临床异质性很可能是由于癌细胞分子特征的差异所致[2]。
近年来,随着现代分子生物学技术的迅猛发展,胃癌分子分型的概念悄然而生,从分子分型到免疫分型和免疫与分子特征结合的分型。目前对临床具有一定指导意义的主要是TCGA分型和ACRG分型。2014年TCGA研究者将胃癌分为4种亚型:EB病毒阳性型、微卫星不稳定性(MSI)型、基因组稳定型和染色体不稳定型(CIN)。PD-1/PD-L1抑制剂治疗转移性EB病毒阳性型疗效较好。伴有淋巴样间质的胃癌EB病毒阳性率最高。2015年亚洲癌症研究小组ACRG提出4种分子亚型:上皮间质转化EMT型、MSI型、MSS-p53+型和MSS-p53-型。MSI型总体预后最好[3]。
但以上的胃癌分子分型方法未能广泛应用于临床。《2022 CSCO胃癌诊疗指南》[4]及《2022 NCCN胃癌临床实践指南》[5]均指出根据分子分型指导治疗。《2022 CSCO胃癌诊疗指南》指出HER2检测及MSI/dMMR状态评委作为I级推荐,对拟采用PD-1/PD-L1抑制剂治疗的胃癌患者,推荐胃癌组织中评估PD-L1表达状态。PD-L1表达与肿瘤TMB,EBV对于免疫治疗的疗效预测价值仍有争议。但在TCGA分型中PD-1/PD-L1抑制剂治疗转移性EB病毒阳性型疗效较好。《2022 NCCN胃癌临床实践指南》提出免疫检查点抑制剂(ICI)基于MSI/MMR状态评估,PD-L1的表达检测,或可通过NGS检测肿瘤突变负荷(TMB)。
目前ICI的代表药物如帕博丽珠单抗、纳武力尤单抗能够使胃癌患者获得有效且持久的临床效果,但仍有部分胃癌患者存在ICI治疗不敏感或治疗抵抗现象,因此寻找可靠地预测ICI疗效的生物标志物,对胃癌的个体化治疗,提高ICI疗效至关重要[6]。目前,在胃癌ICI治疗中用于疗效预测的指标包括PD-L1、EBV阳性、高度微卫星不稳地MSI-H、肿瘤突变负荷TMB及肿瘤浸润性淋巴细胞TIL[7]等。本文结合文献就胃癌基于ICI疗效预测的生物标志物研究进展进行汇总。
01 PD-L1作为生物标志物
PD-L1在大约12%-65%的胃癌组织表达阳性,更重要的是,PD-L1阳性患者的OS明显低于PD-L1阴性患者,这间接表明PD-1/PD-L1通路通过影响肿瘤的微环境,调节免疫应答反应来促进肿瘤的侵袭和转移[8]。而在KEYNOTE-59[6]研究中发现,用于PD-1抑制剂的治疗PD-L1(+)晚期胃癌患者比PD-L1(-)患者的ORR更高(22.7% vs. 8.6%)、DOR更长(16.3个月 vs. 6.9个月),可以获得较好疗效,且安全性较好。常采用免疫组化法检测肿瘤组织中 PD-L1 的表达,通过TPS或CPS来评估。在III期KEYNOTE-061实验中,帕博丽珠单抗组(CPS≥10分),患者的OS为10.4个月,紫杉醇组患者为8.0个月,提示帕博丽珠单抗对PD-L1表达较高(CPS≥10分)的患者有更大的作用[9]。
02 EBV阳性作为生物标志物
研究报道,约9%的胃癌组织存在EBV感染状态,这类胃癌被称为EBV相关胃癌(EBVaGC)。EBV阳性的胃癌表现:①肿瘤和免疫细胞中PD-L1表达增加(肿瘤细胞中PD-L1染色比例为50%,免疫细胞中PD-L1染色比例为94%);②IFN-γ基因信号富集;③CD8+肿瘤浸润淋巴细胞密集浸润。因此EBV阳性的胃癌最有可能对ICI产生应答。一项Ⅱ期临床试验对61例接受帕博丽珠单抗治疗的转移性胃癌患者组织分子表征进行研究,发现EBV阳性患者对帕博丽珠单抗的治疗反应良好,总体缓解率高达100%,中位持续时间达到8.5个月[10]。然而,Wang等[11]报道,在EBV阳性的4例胃癌患者中观察到1例部分缓解、2 例疾病稳定和1例疾病进展。因此,需要在更大的临床试验中行进一步的研究。
03 MSI-H作为生物标志物
MSI-H/dMMR发生在肿瘤细胞中,产生高突变并形成能被免疫细胞识别的免疫原性新抗原。因此,MSI-H/dMMR的肿瘤表现为免疫细胞的密集浸润,特别是CD8+肿瘤浸润淋巴细胞,并被认为对ICI敏感。在KEYNOTE-059 [6]试验中,帕博丽珠单抗治MSI-H胃癌患者的ORR为57.1% ,而治疗非MSI-H胃癌患者的ORR为9.0%。此外,KEYNOTE-061[9]试验证明,在MSI-H胃癌患者中,帕博丽珠单抗单药治疗比紫杉醇单药治疗有更好的反应。在可切除的原发性胃癌患者中,MSI与DFS和OS独立相关,是一个可靠的预后指标。MSI-L/MSS胃癌患者从化疗+手术中获益;相反,MSI-H的GC患者则没有获益(如图1所示)。2017 年,FDA批准帕博丽珠单抗用于治疗MSI-H/dMMR的实体瘤,这是通过基础和临床试验的积累将其纳入考量范围的。
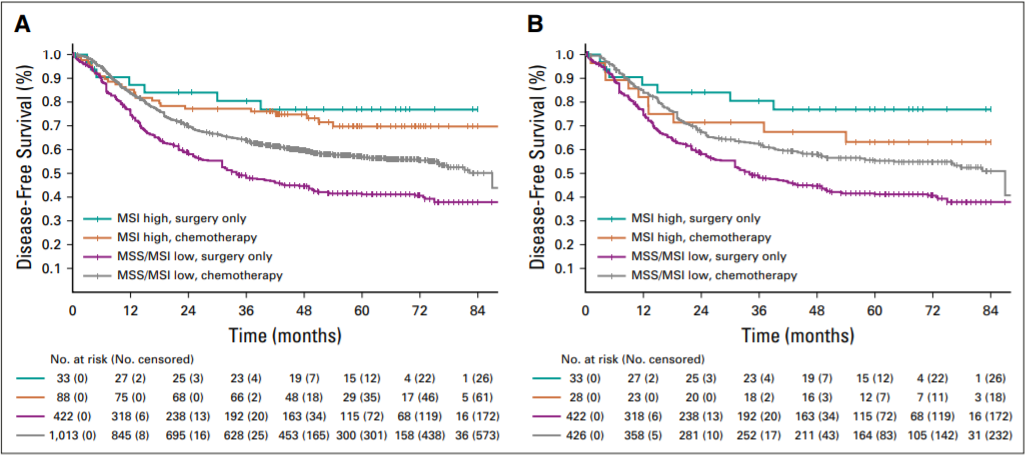
图1:手术切除的胃癌患者MSI与DFS和OS独立相关
04 TMB作为生物标志物
TMB是指一份肿瘤样本中,所评估基因的外显子编码区每兆碱基中发生置换和插入/缺失突变的总数。TMB在不同癌种中的差异较大(突变/兆碱基),胃癌患者中位TMB:3.69突变/兆碱基[12](如图2所示)。TMB与ICI治疗客观反应率呈显著正相关关系,高TMB患者客观反应率明显升高,TMB-H胃癌患者具有良好的总体生存率和无病生存率(如图3所示)。表明在肿瘤呈递的抗原可提高抗PD-1治疗的应答率[13]。基于KEYNOTE-158[14]研究,高TMB(≥10突变/Mb)组患者ORR达29%,非高TMB组患者ORR仅6%。帕博丽珠单抗于2020年获FDA批准用于TMB-H(≥10突变/Mb)的不可切除或转移性实体瘤,并被NCCN指南推荐用于TMB-H胃癌的二线或后线治疗。
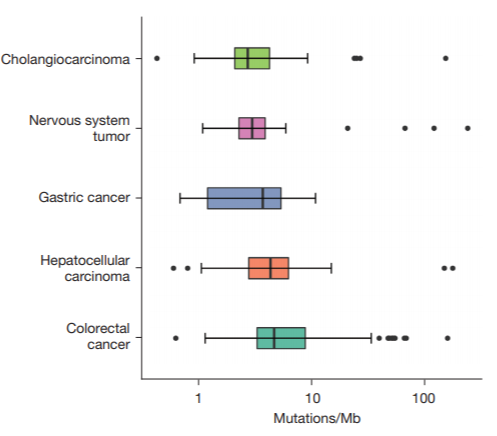
图2:不同癌种中的TMB
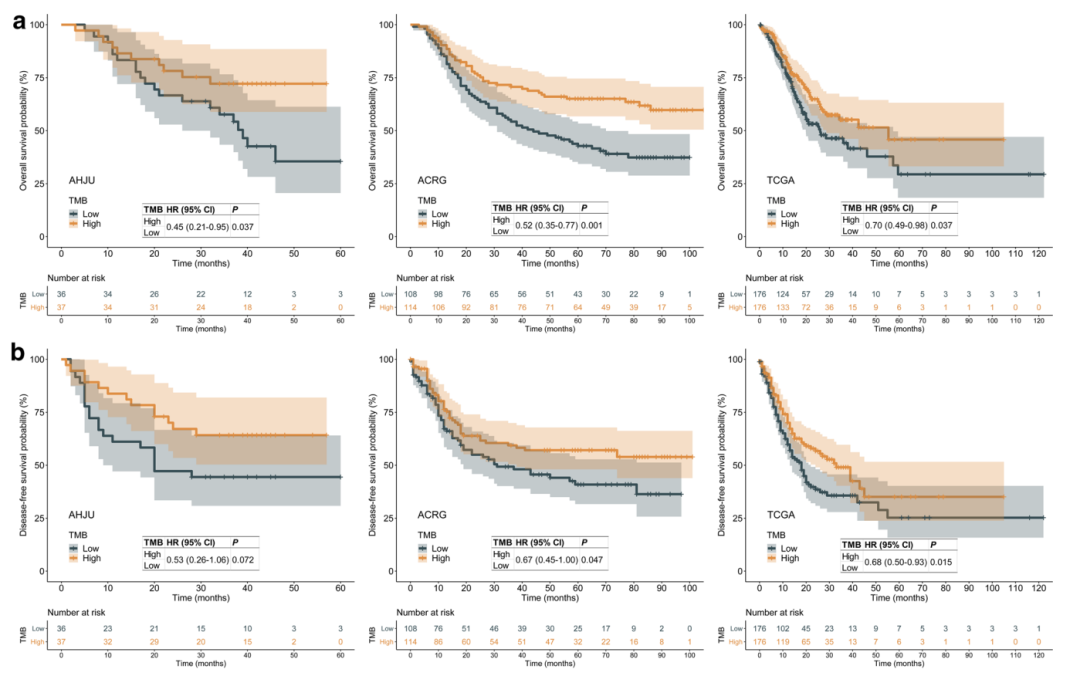
图3:胃癌切除术后TMB与预后的关系-生存曲线(TMB高低分组)
05 TIL作为生物标志物
肿瘤浸润淋巴细胞( tumor infiltrating lymphocyte, TIL)包括T细胞、B 细胞和NK细胞,可以浸润于肿瘤细胞内及其周围基质中。TILs的特异性细胞膜抗原与特异性细胞类型相关:CD3、CD4、CD8 和 FOXP3 的表达与T细胞相关,CD20是B细胞的标志,CD57表达与NK细胞相关。在不同肿瘤中,TIL 中 CD4+T细胞、CD8+T细胞、辅助性T细胞亚群(Th)、调节性T细胞(Treg)、自然杀伤细胞等比例不同,多数以CD8+T细胞为主。肿瘤中 CD8+T细胞的高度浸润能够显著增加肿瘤细胞免疫检查点受体表达,如PD-1、CTLA-4,导致肿瘤对ICI治疗反应更敏感。因而,TIL可作为ICI疗效的预测指标。TIL是宿主对肿瘤细胞免疫反应的表现,其在多种恶性肿瘤中具有免疫调节作用。一项临床研究发现[15],胃癌组织高度TIL浸润对患者预后有利,是具有保护因素的独立预测因子,高TIL患者无进展生存期和总体生存期显著高于低TIL患者,并且在肿瘤间质中TIL可能有助于反映不同Th亚群在肿瘤免疫中的生物学功能。Dai等[16]报道PD-L1表达与GC中TILs密度增加相关,而TILs密度的增加和PD-L1 mRNA水平的升高与患者的预后改善密切相关。GC患者中功能低下的T淋巴细胞比例显著升高,尤其是在进展期患者中,提示GC中的TILs存在T细胞功能障碍,与肿瘤免疫逃逸有关。
随着ICI在胃癌的应用,人们发现了它在治疗上的巨大潜力。但是只有部分人群响应ICI治疗,综上所述,PD-L1、EBV 阳性、MSI-H/dMMR、TMB及TIL等生物标志物均可作为预测胃癌ICI疗效的潜在指标。但目前这些指标在临床研究中的应用还存在许多不足,如已有的生物标志物准确率不高,部分生物标志物(PD-L1)存在时间或空间异质性,对于测量值为连续性变量的标志物,如TMB、PD-L1等,如何划分风险阈值,而且治疗样本较小、研究方法不统一,尚需高质量、标准化的临床研究加以验证,以实现胃癌个体化和精准化治疗目的。
参考文献
[1] 白慧霞. 中国胃癌发病率及死亡率研究进展[J].临床医药文献杂志,2019,6(7):192.
[2] Bang YJ,Kim YW,Yang HK,et al. Adjuvant capecitabine and oxaliplatin for gastric cancer after D2 gastrectomy (CLASSIC):a phase 3 open-label,randomised controlled trial[J]. Lancet,2012,379(9813):315-321.
[3] 宋刚. 胃癌的分子分型的研究进展与临床实践[J]. 肿瘤综合治疗电子杂志,2017,3(1):1-5.
[4] 《2022 CSCO胃癌诊疗指南》
[5] 《2022 NCCN胃癌临床实践指南》
[6] FUCHS C S,DOI T,JANG R W,et al. Safety and efficacy of pembrolizumab monotherapy in patients with previously treated advanced gastric and gastroesophageal junction cancer:phase 2 clinical KEYNOTE-059 trial[J]. JAMA Oncol,2018,4(5):1800-1813.
[7] 田珍. 胃癌免疫检查点抑制剂疗效预测相关指标的研究进展[J].山东医药,2021,61(10):87-90.
[8] Geng Y,Wang H,Lu C,et al.Expression of costimulatory molecules B7-H1,B7-H4 and Foxp3+ Tregs in gastric cancer and its clinical significance[J].Int J Clin Oncol,2015,20(2):273-281.
[9] Shitara K, Özgüroğlu M, Bang Y-J, et al: Pembrolizumab versus paclitaxel for previously treated, advanced gastric or gastro-oesophageal junction cancer (KEYNOTE-061): a randomised, open-label, controlled, phase 3 trial. The Lancet
[10] KIM S T,CRISTESCU R,BASS A J,et al. Comprehensive molecular characterization of clinical responses to PD-1 inhibition in metastatic gastric cancer[J]. Nat Med,2018,24(9):1449-1458.
[11] Wang F, Wei XL, Wang FH, et al. Safety, efficacy and tumor mutational burden as a biomarker of overall survival benefit in chemo-refractory gastric cancer treated with toripalimab, a PD- 1 antibody in phase Ib/II clinical trial NCT02915432[J]. Ann Oncol, 2019, 30(9): 1479-1486.
[12] Estimating tumor mutational burden across multiple cancer types using whole-exome sequencing.Original Article,2021.
[13] Tumor mutation burden as a biomarker in resected gastric cancer via its association with immune infiltration and hypoxia.Gastric Cancer. 2021 Jul;24(4):823-834.
[14] Association of tumour mutational burden with outcomes in patients with advanced solid tumours treated with pembrolizumab: prospective biomarker analysis of the multicohort, open-label, phase 2 KEYNOTE-158 study.oncology Vol 21 October 2020.
[15] CHO J,CHANG Y H,HEO Y J,et al. Four distinct immune microenvironment subtypes in gastric adenocarcinoma with special reference to microsatellite instability[J]. ESMO Open, 2018,3(3):e000326.
[16] 刘 乐.胃癌 PD-1/PD-L1 免疫检查点抑制剂免疫治疗影响因素分析[J]. Chin J Clin Pharmacol Ther 2022 Jan;27(1)


