2022 EA4HP/SH研讨会:11q变异高级别/大B细胞淋巴瘤、IRF4重排大B细胞淋巴瘤等新兴分子亚组
时间:2023-11-01 17:39:32 热度:37.1℃ 作者:网络
2022年在意大利佛罗伦萨举行的欧洲血液病理学协会( EA4HP)/血液病理学学会(SH)研讨会讨论了大B细胞淋巴瘤(LBCL)的新兴实体和分子亚组。该会议重点讨论了新发现的疾病及其诊断方面的挑战。
携带11q变异的高级别/大B细胞淋巴瘤(HG/LBCL-11q)定义为染色体11q获得和端粒缺失。建议采用FISH技术进行诊断。HG/LBCL-11q可发生于共济失调-毛细血管扩张等免疫缺陷状态,且以儿童多见。这些病例的形态学谱比以前认为的更广泛,常有伯基特样形态和粗糙的凋亡小体,具有伯基特样免疫表型(CD10+、BCL6+、BCL2-),但MYC表达弱或阴性,缺乏MYC重排,与伯基特淋巴瘤不同,50%的病例表达LMO2。
伴IRF4重排的LBCL(LBCL-IRF4)主要发生于儿童,但也可发生于成人。LBCL-IRF4预后良好,具有独特的分子特征。IRF4重排虽然是本病的特征,但不是特异性的,并且在与其他染色体易位相关的其他大B细胞淋巴瘤中可以发现IRF4重排。
其他讨论的分子亚型包括具有独特临床表现和分子特征的原发性骨弥漫大B细胞淋巴瘤(PB-DLBCL),以及伴有IGH::MYC易位的B急性淋巴细胞白血病(B-ALL),最近B-ALL从表达TdT的伯基特淋巴瘤中分离出来。B-ALL具有前B细胞的分子特征,常为1q四体性,以及经常发生NRAS和KRAS突变。
本报告将讨论研讨会关于相关病例提出的新发现、诊断建议、悬而未决的问题和诊断挑战。
背景介绍
弥漫大B细胞淋巴瘤(DLBCL)约占非霍奇金淋巴瘤(NHL)的40%,由特定的亚型或疾病实体组成,然而,大多数病例属于“非特指”(NOS)类型。DLBCL NOS是一组异质性疾病,根据B细胞或起源细胞(COO)基因表达谱(GEP)分为生发中心B细胞(GCB)和活化B细胞(ABC)两个亚型。一小部分DLBCL被认为是“未分类的”,不属于任何类别。然而,COO二元分类不足以反映该病的异质性和复杂性。BCL2重排(R)和(或)BCL6-R、MYC-R,即双打击/暗区特征,进一步强调了DLBCL的生物学多样性。最近,包括结构变异、突变谱和体细胞拷贝数变异在内的分子数据整合已经确定了至少7个有临床意义的DLBCL亚组,这表明了DLBCL的复杂性。其他具有特定受累部位和特征性病理特征的LBCL包括原发性纵隔B细胞淋巴瘤,以及被认为是免疫特权部位的中枢神经系统、玻璃体视网膜隔室和睾丸的LBCL。其他引起免疫功能障碍或与EBV或HHV8感染因子相关的疾病也被确定为特定的疾病实体。
2022年EA4HP/SH研讨会专门讨论了LBCL中的新兴实体和分子亚组,共提交了56例病例,代表了诊断这些新发现的儿童和成人淋巴瘤面临的许多挑战。病例分为以下主题组,以说明诊断困境和/或值得关注的生物学特征:
1、伴有11q变异的高级别/大B细胞淋巴瘤(HG/LBCL-11q);
2、伴有IRF4重排的大B细胞淋巴瘤(LBCL-IRF4):儿童和年轻成人(≤25岁),成人(>25岁);
3、伴有IRF4和BCL2/MYC/CCND1重排的侵袭性B细胞淋巴瘤;
4、其他大B细胞淋巴瘤分子亚组。
伴有11q变异的高级别/大B细胞淋巴瘤(HG/LBCL-11q)
HG/LBCL-11q是一种侵袭性成熟B细胞淋巴瘤。HG/LBCL-11q病例表现为局部淋巴结(60-70%;最常见的是头颈部)或结外病变(30-40%;胃肠道)。定义的基因事件是涉及11号染色体长臂(11q)的复杂变异,表现为11q23.2-23.3获得和11q24.1-qter端粒缺失,同时不存在MYC-R。罕见病例不存在11q23.3增加。第5版WHO淋巴瘤分类和2022年国际共识分类(ICC)将仅有端粒缺失和/或仅有端粒杂合性缺失的病例视为真正的HG/LBCL-11q病例。但尚需进一步的研究证实这些病例是否属于同一疾病。如果仅有11q23.3获得被认为是非特异性的,因此不足以用于诊断。与伯基特淋巴瘤(BL)相比,ID3-TCF3通路突变(被认为是BL的生物标志物)在HG/LBCL-11q中未检测到。HG/LBCL-11q的突变谱更接近于GCB型的DLBCL,约50%的病例存在GNA13突变。这些新数据,加上不存在IGH::MYC重排,提示HG/LBCL-11q代表一种不同的成熟侵袭性B细胞淋巴瘤。
在研讨会上,提交了20例诊断为HG/LBCL-11q的病例。18例患者的诊断得到了证实,被认为是HG/LBCL-11q的典型代表。临床病理特征见表1。主要为男性患者(M/F=13/5),中位年龄为22.5岁(7~72岁)。13例为儿童和年轻人(7~31岁),5例>40岁(44~72岁)。在提交的病例中,10例为结内病变,8例为结外病变。1例患者(LYWS-1073,由Rex Au-Yeng提交)在不同的时间点表现出多个受累部位。最初在颈部淋巴结被诊断,2年后复发时在扁桃体出现。值得注意的是,有2例发生在原发性免疫缺陷的情况下(Olga Balague提交的LYWS-1125和Peggy Dartigues提交的LYWS-1442)。这2例患者分别在11岁和13岁时被诊断为共济失调-毛细血管扩张症(A-T)。A-T是最常见的DNA修复障碍,由ATM基因的双等位基因致病性变异引起,其特征是在儿童时期具有极高的发展为血液系统恶性肿瘤的风险,尤其是DLBCL和T细胞急性淋巴细胞白血病(ALL),但很少出现BL。目前尚未见与HG/LBCL-11q相关的报道。据报道,这种特殊的11q获得/缺失变异在移植后患者中尤其常见,这些患者会发展为具有伯基特样形态的B细胞淋巴瘤。在HIV感染的情况下也有描述。
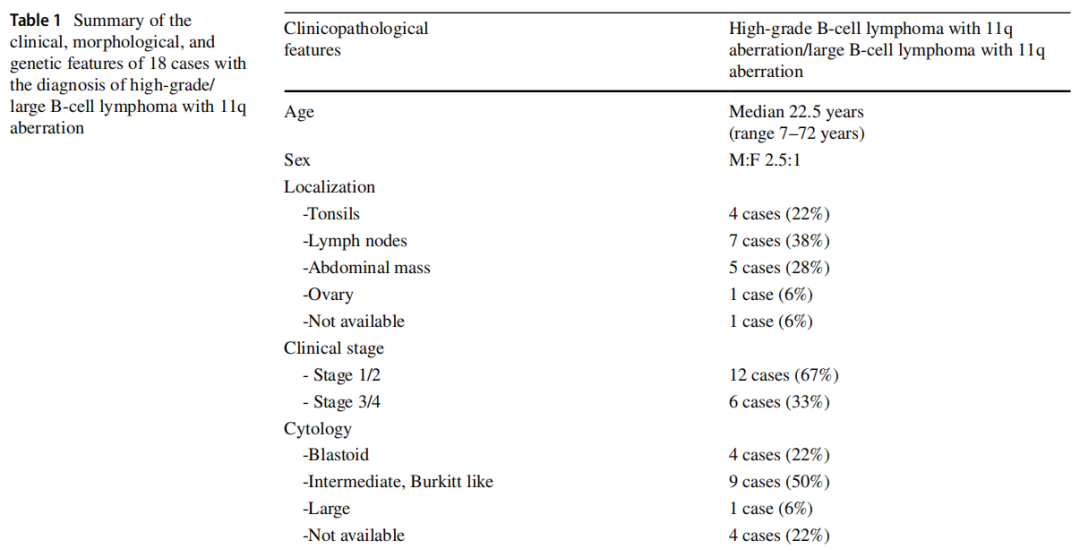

表1
提交病例的形态学谱从母细胞样到中等至大的B细胞淋巴瘤(图1)。中等形态的病例表现为细胞多形性,细胞核大小、形态各异,核仁较大,包括与BL非常相似的病例和更接近DLBCL的病例。仅1例(Snjezana Dotlic提交的LYWS-1242)细胞形态较大。10例可见星形图案,5例可见粗糙的凋亡碎片。在最近的一项研究中,粗糙的凋亡小体被报道为HG/LBCL-11q的特征,也是怀疑诊断和提示FISH分析的重要形态学特征。提交给研讨会的案例证实了这一论点,然而,尽管这是一种有助于怀疑诊断的特征,但在许多病例中未观察到,因此,没有它不能排除诊断。所有病例应用Hans算法(CD10+、BCL6+)均为GCB表型,增殖指数均较高(ki67>90%)。3例表达MUM1和BCL2(LYWS-1129;lyws-1237;lyws-1217)。最近的一项研究表明,使用单克隆抗体SP51,46%的HG/LBCL-11q表达生发中心标志物LMO2,而BL表达阴性。相应的,7/15(46%)的病例为LMO2阳性。研讨会病例证实,在疑难病例中,LMO2是支持HG/LBCL-11q而非BL的有用标志物。每个病例的MYC表达不同,在20%~60%的肿瘤细胞中检测到,但总是显示弱染色。在所有病例中,使用断裂探针(BAP)的FISH分析均未检出MYC-R。然而,BAP不能识别所有MYC阳性病例,4-20%的病例可能会被漏检。专家组对IGH::MYC、IGL::MYC和IGK::MYC易位进行了检测。所有病例均为阴性,从而证实HG/LBCL-11q的诊断。在所有病例中使用BAP FISH检测BCL2-R和BCL6-R,均为阴性。
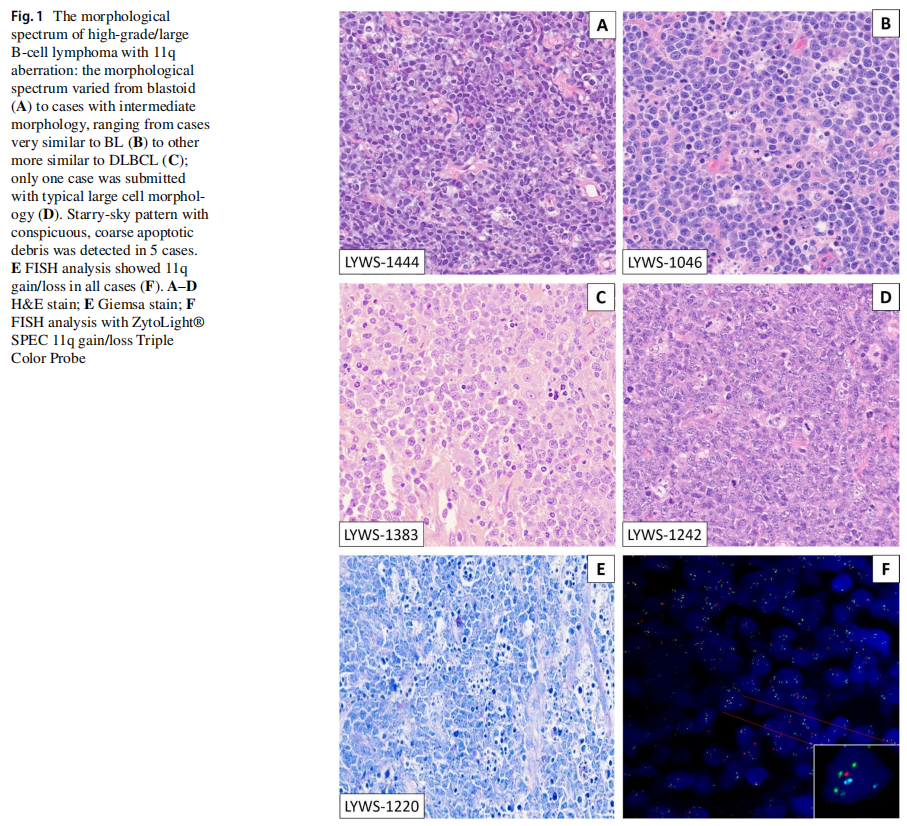
图1
提交者报告了5个病例的NGS结果。在剩余可获得样本的病例中,进行了NGS panel检测。结果报告于图2。研讨会病例的突变情况与之前的研究有相似之处,但也有差异。先前报道的DDX3X、MYC、KRAS、EZH2、CREBBP和FOXO1突变已被证实。未发现典型的BL驱动基因突变(ID3或TCF3),但HG/LBCL-11q中报道的突变频率较高的基因存在一些差异。在研讨会病例中,PTEN、TP53、FOXO1和RHOA突变频繁。值得注意的是,ATM、CCND3和RHOA突变之前在HG/LBCL-11q中未见报道。另外,除了2例A-T病例(LYWS-1125和LYWS-1442),研究者还在另外2例病例(LYWS-1217和LYWS-1220)中发现了ATM突变,其变异丰度分别为49%和39%。这些突变很可能代表杂合胚系变异,与肿瘤发生风险增加相关。因此,这些发现进一步支持并扩大了HG/LBCL-11q与免疫缺陷综合征的关联。最后,图3比较了BL、HG/LBCL-11q、双/三打击高级别B细胞淋巴瘤(HGBL)和DLBCL的突变模式。GNA13、MYC和TP53突变是BL、HG/LBCL-11q、HGBL和DLBCL共有的。BTG2和DYRK1A基因突变被认为是HG/LBCL-11q的典型突变,分别参与FOXO1和细胞周期蛋白的调控,以及TP53通路。
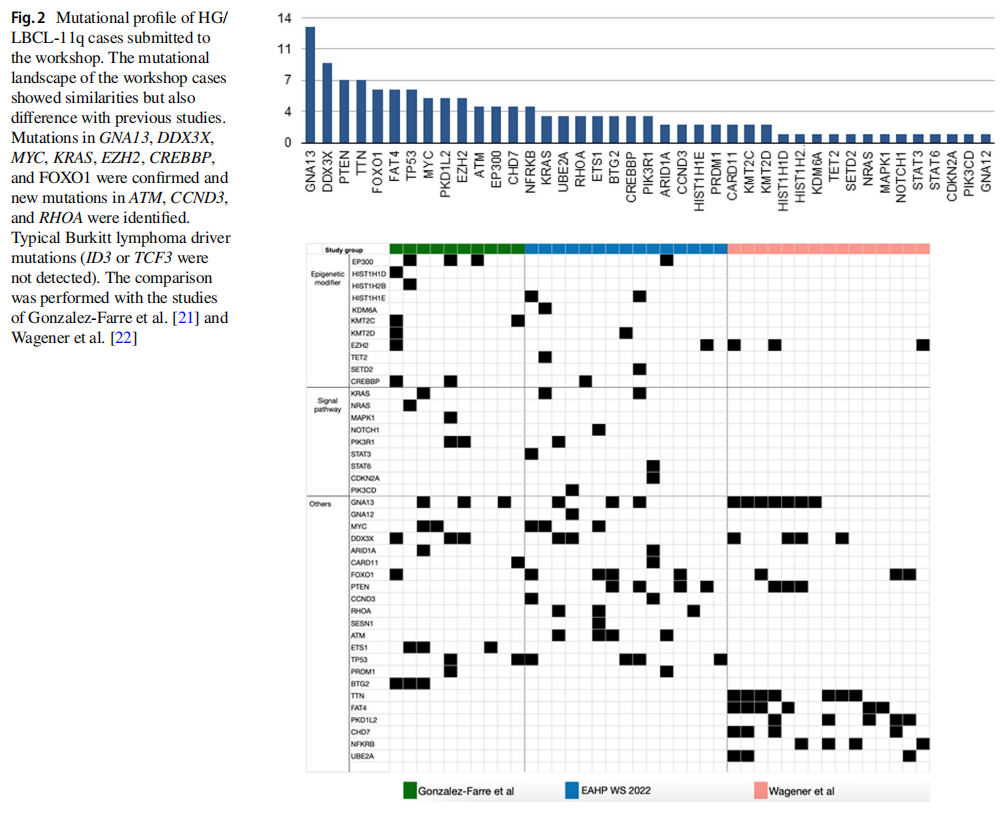
图2
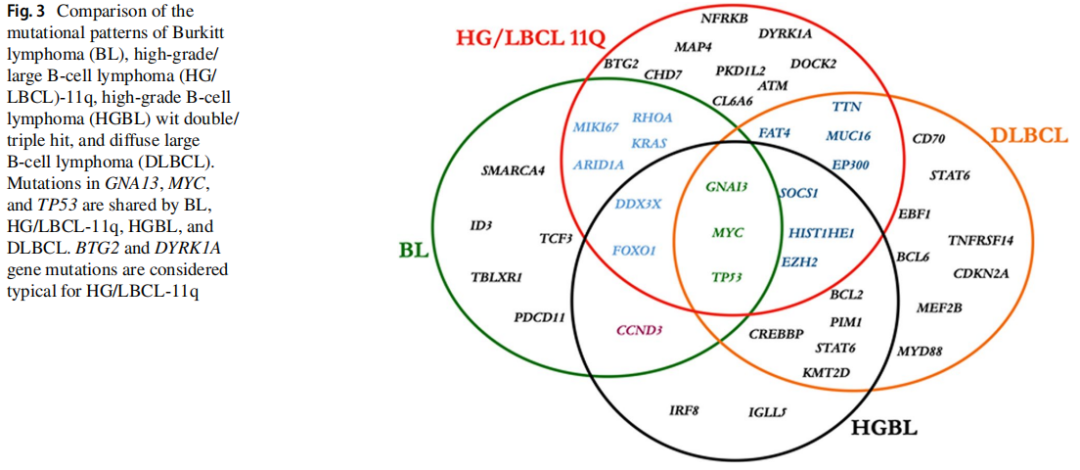
图3
15例患者有可获得的预后信息。11例获得了完全缓解(CR),其中儿童8例,成人3例,治疗方案各不相同(R-CHOP、DA-R-EPOCH或R-EPOCH)。3例复发,仅1例于确诊2周后死于淋巴瘤。值得注意的是,所有儿童患者均接受BL方案获得CR,而3例复发患者均为成人(LYWS-1224;lyws-1234;LYWS-1444)、接受了不同的治疗并且携带TP53突变。TP53基因突变在HG/LBCL-11q中尚未见报道,值得关注的是,所有病例均为成人,且预后不良。问题是TP53突变是克隆进展的标志,还是成人TP53突变伴11q异常的病例与DLBCL NOS的关系更密切。这些病例的其他突变包括HIST1HE1、KMT2D、SETD2、PTEN NSD2和STAT3,这些突变更多是DLBCL的特征。然而,需要进一步的研究来回答这个问题。
在2个病例中(Liu Fang提交的LYWS-1171和Julie Bruneau提交的LYWS-1237),专家组无法确认HG/LBCL-11q的诊断。在LYWS-1171病例中,FISH结果显示仅11q23.3区域出现增加,而11q24.1区域未出现缺失。如前所述,11q增加对于HG/LBCL-11q不是特异性的,因为它也发生于其他成熟侵袭性B细胞淋巴瘤。在该病例中,由于缺乏样本,专家组无法进行进一步检查,并做出了HGBL NOS的最终诊断。第二个病例LYWS-1237,建议诊断为“BCL2异常表达的BL”,其形态学与BL一致,但BCL2和MUM1强表达,以及复杂的核型、MYC-R和11q变异,在BL诊断中相当不典型。与伴有11q变异的HG/LBCL不同,该病例MYC表达强而均匀。NGS分析证实了与HGBL NOS更兼容的突变谱。专家组建议根据突变分析结果将这些病例(MYC-R伴11q变异)归类为HGBL NOS,但这一问题需要进一步的研究来回答。
会议讨论期间提出了一些重要问题,特别是确认诊断的最佳技术方法。专家组建议对所有MYC-R阴性、形态为中等/母细胞样或burkitt样的病例,使用FISH进行11q变异分析。然而,对于FISH无法证明端粒缺失的病例,需要进行额外的分子分析(Oncoscan/CGH)来确诊或排除诊断。讨论的另一个关键问题是是否应在所有MYC-R BL中进行11q的FISH分析,尤其是在那些表型不典型的病例中,以识别潜在的11q变异伴MYC-R,如LYWS-1237病例所示。目前对MYC-R的典型BL病例,不建议进行11q的FISH检测,但对于具有MYC-R基因和不典型形态或表型的BL病例,应鼓励采用此方法。
伴有IRF4重排的大B细胞淋巴瘤(LBCL-IRF4)
由于LBCL-IRF4频繁的滤泡生长模式和良好的预后,其作为一个临时实体被引入了2016年修订版第4版WHO分类中滤泡性淋巴瘤(FLs)组,现在被认为是一个明确的实体,在2022年国际共识分类(ICC)中,LBCL-IRF4仍然属于FL组,在第5版WHO分类中,被移到了LBCL组。LBCL-IRF4好发于儿童和青壮年,有特征性临床表现,好发于扁桃体、韦氏环、头颈部淋巴结等黏膜相关淋巴组织,较少累及肠道。男性略好发,表现为局部疾病(I-II期),无论大细胞细胞学和生长方式如何,预后都很好。据估计,在儿童人群中,大约20%的形态学FL(3级)和DLBCL携带IRF4染色体易位,但仅占所有儿童和青少年淋巴瘤的1-2%。形态学上,LBCL-IRF4常为滤泡型和弥漫型,但也可为纯滤泡型或弥漫型。肿瘤细胞大小中等或较大,呈中心母细胞或母细胞样细胞形态,有时呈星形分布,增殖率高。肿瘤细胞表达B细胞标志物和生发中心标志物,包括CD10和BCL6,并构成性表达MUM1/IRF4。IGH::IRF4重排在大多数病例中检测到。LBCL-IRF4不伴有BCL2-R和MYC-R,但许多病例携带BCL6-R(35%)。尽管IRF4构成性表达,并且IRF4和NFkB相关基因(CARD11, CD79B, MYD88)频繁突变,但分子生物学研究已经揭示了一种GCB型GEP。最常见的染色体变异是17p13缺失,即TP53基因所在位置。
研究表明,DLBCL的生物学和发病机制与年龄有关,临床实践中使用的18岁这一临界值似乎相当武断,并不能反映DLBCL的生物学特征。分子特征提示最佳的临界值可能是35岁左右。最近的两项研究表明,LBCL-IRF4在年轻成人(<40岁)中的定位、形态和遗传学与儿童患者相同。研讨会中提交的病例有16例诊断为LBCL-IRF4,研究者任意设定了25岁的临界值,将儿童和年轻成人患者与成年患者区分开来,以比较两组的临床病理特征。所有病例均为LBCL-IRF4的典型代表,部分病例具有独特特征。
≤25岁的LBCL-IRF4患者:
根据提交的病例描述了该病的临床、形态学和遗传谱(表2)。男5例,女2例,中位年龄8岁(6~25岁)。发生于扁桃体4例,颈部淋巴结、肠道、脾脏各1例。脾脏表现(病例LYWS-1163, E. Shuyu提交)是一种例外,发生于一名18岁男性,表现为单个10 cm的肿块(图4A-D)。重要的是,所有患者均为I期或II期且均达到CR,其中4例经全身化疗后。1例未行全身化疗(病例LYWS-1112,Dehua Wang提交),是一名7岁男孩,回肠末端2.2 cm肿块,因肠套叠手术切除(图4E-L)。形态学上,淋巴瘤呈滤泡型,具有典型的表型和基因型。该病例与病例LYWS-1395以及文献中报道的其他未经全身治疗而达到CR的病例一起提出了一个问题,对于那些具有滤泡生长模式和局部疾病切除后的病例,是否可以减少化疗或遵循观察等待策略。因此,在NHL-Berlin-Frankfurt-Münster组发表的儿童队列中,由于这些患者的预后良好,建议在未来的临床试验中将治疗降级。形态学上,3例为滤泡型和弥漫型,2例为弥漫型,2例为滤泡型。6例免疫表型显示CD10、BCL6和MUM1共表达。这三种标志物的异常共表达提示应考虑LBCL-IRF4的诊断。仅1例CD10阴性(LYWS-1049)。正如之前报道的,3例(3/7,43%)CD5弱表达(LYWS-1279、LYWS-1112、LYWS-1395), 6例(6/7,86%)表达BCL2,无t(14;18)易位。FISH分析显示6/7例患者的IRF4断裂,提示IRF4易位。1例(病例LYWS-1279,Rachel Mariani提交)具有典型的定位、形态和免疫表型(图5A-I),FISH BAP分析IRF4断裂阴性。NGS显示IGH::IRF4并列,支持隐藏的IRF4易位的存在。据估计,大约10%的LBCL-IRF4无法用FISH探针证实IRF4断裂。在隐匿性病例中,IGH/IGK/IGL重排的存在有助于诊断。此外,病例LYWS-1279还携带IRF4突变。一个或多个突变以异常体细胞超突变模式影响IRF4基因是IRF4易位的标志。因此,在正确的情况下,在第2号外显子中高度保守的N端DNA结合域存在IRF4突变,可以作为IRF4重排存在的替代标志物。专家组进行的突变分析表明,在分析的5个病例中,有4个(80%)存在多个IRF4突变。唯一一个没有IRF4突变的病例(LYWS-1202)由Eric Hsi 提交。该病例的独特之处在于,RNA测序证实IRF4重排发生在21号染色体上的未知伴侣。在目前报道的所有病例中,IRF4的易位伴侣要么是IGH要么是较少见的IGL或IGK。非IG伴侣的意义尚不清楚。令人惊讶的是,3例(3/5,60%)显示致病性TP53突变(LYWS-1279、LYWS-1163和LYWS-1202),然而,TP53突变的存在似乎并不意味着预后不良,因为所有3例患者在诊断后18、27和38个月均处于CR。在对LBCL-IRF4的最初研究中,6例17p缺失的病例中有3例发现了TP53突变。随后在儿童人群中进行的一项研究表明,25%的病例存在17p/TP53缺失,但未发现TP53突变。在成人队列中也报道了类似的结果。TP53突变在本病中的发生率尚不清楚,其预后意义仍有待确定。专家组对所有无易位证据的病例进行了BCL2、BCL6和MYC的FISH分析。4例接受GEP检查的病例均为GCB型。
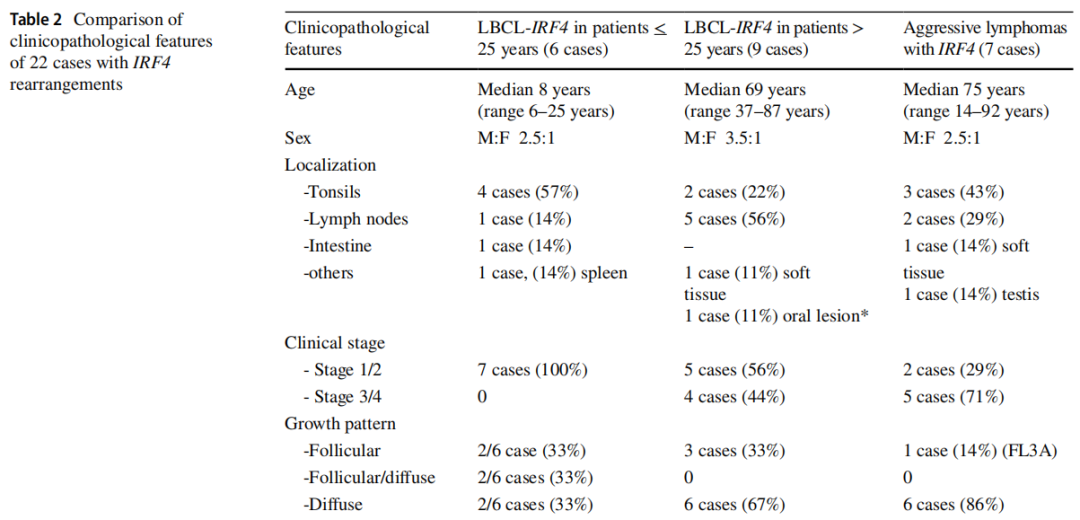

表2
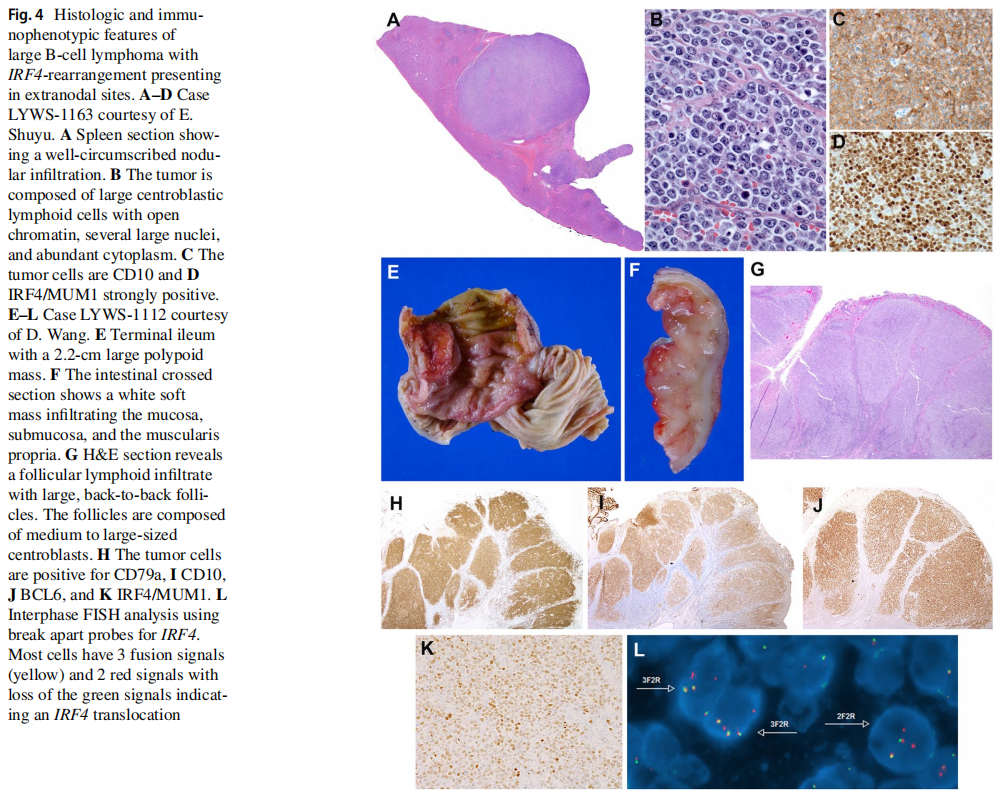
图4

图5
由Francisco Llamas-Gutierrez提交的病例LYWS-1276是一个值得关注的病例,一个14岁的男孩,表现为右侧扁桃体肿瘤。虽然形态学和表型(CD10+,BCL6+ MUM1+)提示LBCL-IRF4诊断,但FISH检测未发现IRF4断裂,RNAseq分析也未能证实存在IRF4重排。相反,BCL6易位被证实。基因突变分析显示具有DLBCL相关的典型基因突变,但未发现IRF4突变,GEP显示ABC型特征。专家组同意诊断为DLBCL,NOS,ABC型,伴有BCL6易位,类似于LBCL-IRF4。该病例强调了FISH和分子检测对正确诊断的重要性。
>25岁的LBCL-IRF4患者:
提交的9例成人患者诊断为LBCL-IRF4(表2)。男性7例,女性2例,中位年龄69岁(范围37-87岁)。在2例患者中发现复合淋巴瘤,可能与患者年龄有关,其中1例为淋巴浆细胞淋巴瘤(LPL)(LYWS-1076),另1例为边缘区淋巴瘤(LYWS-1320)。与儿童病例相比,成人病例多为淋巴结型(5例),仅有2例扁桃体受累,1例前臂软组织受累,1例HIV+患者口腔受累。最近的一项研究表明,皮肤/软组织受累在老年患者中相对常见,这是以前未被认识的表现。虽然成人病例更多表现为高临床分期(III/IV期)(4/9;44%),但所有患者接受R-CHOP(利妥昔单抗-环磷酰胺、羟基柔红霉素、癌因肽和泼尼松)治疗后均达到CR。形态学上,3例表现为FL3B样形态,6例为弥漫型。免疫表型与儿童人群相似(CD10+、BCL6+、BCL2+),但成人患者均不表达CD5, 2例CD10阴性。病例LYWS-1076由Dominik Nann提出,临床III期的74岁患者,FL3B样形态,骨髓(BM)由克隆无关的LPL浸润。该病例除IRF4易位外,还伴有BCL6易位。在该病最初的描述中,BCL6易位的发生率为35%(8/23),其中6例为成人。然而,在所有提交研讨会的病例中,无论是儿童还是成人,只有该病例携带BCL6易位(1/14;7%)。一般来说,对于形态学为FL3B的成人患者,如Bettina Bisig提交的病例LYWS-1370所示(图6A-F),建议进行MUM1/IRF4染色,如果阳性,则进行IRF4的FISH分析。与FL3B病例不同,这些病例的预后很好,可达10年完全缓解。病灶出现在扁桃体的两个病例分别为一名57岁男性(LYWS-1142,由Austin Gray提交)和一名79岁女性(LYWS-1238,由Konnie Hebeda提交),临床分期分别为I期或II期。这两个病例在临床、形态学和遗传学上与儿童人群的病例没有区别,证实了LBCL-IRF4在老年患者中的存在与儿童患者没有区别。另外,还可能表明,不论患者发病时的年龄如何,发生于扁桃体、韦氏环或肠的病例可能代表一种不同的临床病理实体。
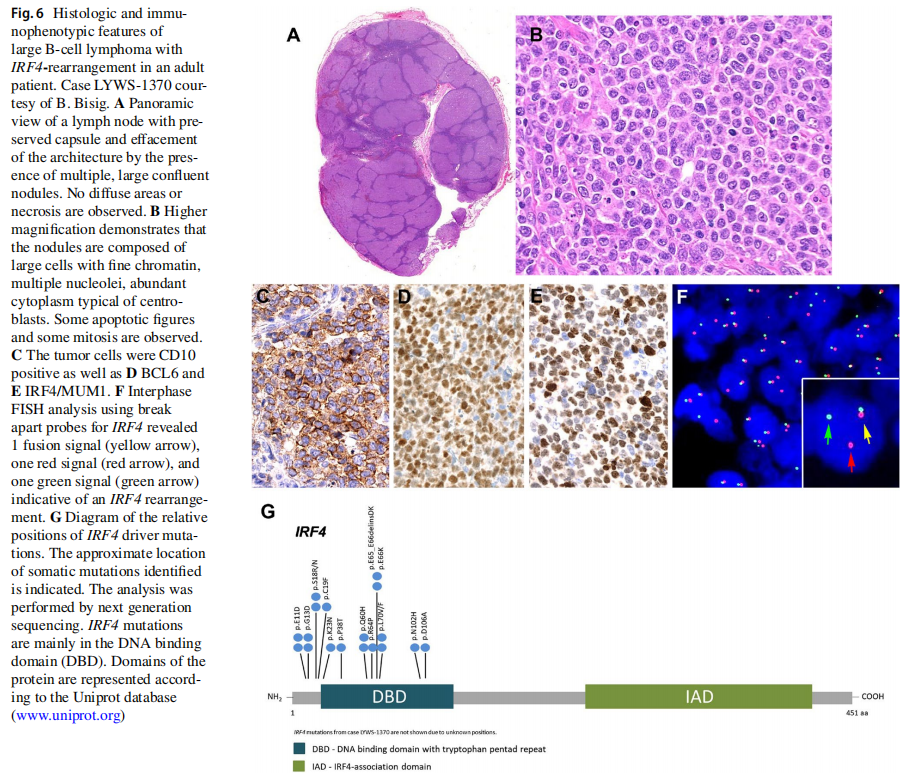
图6
在提交的16例诊断为LBCL-IRF4的患者中,专家组在有分子研究样本的情况下进行了突变分析和GEP。8例(8/10;80%)患者2号外显子出现多个IRF4突变(图6G),而GEP显示这些病例为GCB型特征(8/8;100%)。
伴有IRF4和BCL2/MYC/CCND1重排的侵袭性B细胞淋巴瘤
7例患者携带IRF4-R和其他基因变异,即BCL2-R、MYC-R和CCND1-R(表2)。其中男性5例,女性2例,中位年龄75岁(范围14-92岁)。唯一的儿童患者是一名14岁的浆母细胞淋巴瘤(PBL)女孩,伴IGK::IRF4和IGH::MYC重排。另外6例为老年患者。病例LYWS-1024由Holly Berg提供,为一名因IIIA期头皮肿块就诊的92岁女性。该病例CD10+、BCL6+、MUM1+、BCL2+、CD5弱阳性。FISH分析显示IRF4和BCL2重排。基因突变分析发现DLBCL特征性基因突变,包括KMT2D、CREBBP、BCL2、CCND3、NOTCH2和DNMT3A,未发现IRF4突变。James Cook提交了类似的病例(病例LYWS-1086)。最近的研究表明,在老年患者中,伴有IRF4和BCL2重排的大B细胞淋巴瘤的突变谱更接近DLBCL。Maria Rodriguez-Pinilla提交的病例LYWS-1408是一名75岁的男性,该病例独特,患者处于扁桃体受累的I期疾病,仅使用利妥昔单抗治疗2年后完全缓解。免疫表型为CD10+、BCL6+、MUM1+、BCL2+、cyclin D1+和SOX11阴性。该病例同时携带IRF4-R和CCND1-R。专家组进行了突变分析,发现了3种CD70突变,以及SOCS1和TMSB4X突变。临床上,该病例表现为惰性,与套细胞淋巴瘤不同。专家组将其诊断为伴有IRF4和CCND1重排的DLBCL NOS。有2例FL(LYWS-1099和LYWS-1133),其中1例3A级伴BCL2和IRF4重排,另1例由FL转化为高级别淋巴瘤,在转化过程中发生了MYC和IRF4重排。IRF4重排在其他侵袭性淋巴瘤中的意义尚不清楚,需要进一步研究。重要的是,这些病例不应被诊断为LBCL-IRF4。
其他大B细胞淋巴瘤分子亚组
该组中包含的13例病例异质性很大,代表了不同分子亚组的单个例子。研讨会期间深入讨论了代表淋巴瘤生物学和分类新概念的3个病例。Gabriel Caponetti介绍的病例(LYWS-1026)是一名69岁男性,有2周的疲劳和呼吸短促病史。外周血分析显示白细胞增多(57.3/L),血小板减少(68,000/L),无贫血,28%的原始细胞呈伯基特样形态(图7A-O)。患者有淋巴结肿大和脾大。骨髓穿刺显示81%为原始细胞。虽然不存在祖细胞标志物CD34和TdT,但肿瘤细胞无CD20和表面免疫球蛋白(sIg),这些现象在不成熟时可见。肿瘤细胞表达CD19、PAX5、CD10、MUM1和MYC,增殖率为100%。核型显示异常的男性核型:47,XY,+i(1)(q10),t(8;14)(q24.2;q32)[8]/46,XY[12]。FISH检测证实为MYC基因重排。突变分析发现1个NRAS突变和2个TP53突变。文献中已经报道过类似的病例,即BL具有额外同染色体1q,导致1q四体性。然而,最近的研究表明,这些病例更适合归类为“伴有MYC重排的B-急性淋巴细胞白血病(B-ALL)”。伴MYC重排的B-ALL在2022年ICC中被认定为一个特定实体,并被纳入第5版WHO分类的“伴其他重排的B-ALL”组。该病多见于男性患者(范围3-75岁),肿瘤细胞表型不成熟,常表达TdT和CD10,不表达CD20、BCL6和sIg,但不存在CD34。TdT表达缺失(如本例)并不排除这一诊断。IG::MYC易位源于不成熟B细胞的异常(框外)VDJ重组,而不是像BL那样的生发中心B细胞。分子遗传学上,这些病例也不同于BL,常表现为染色体1q21.1-q44的增加以及NRAS和KRAS的突变。如本例所示,预后较差,患者在初次诊断后5个月死亡。专家组同意伴MYC重排B-ALL的最终诊断。
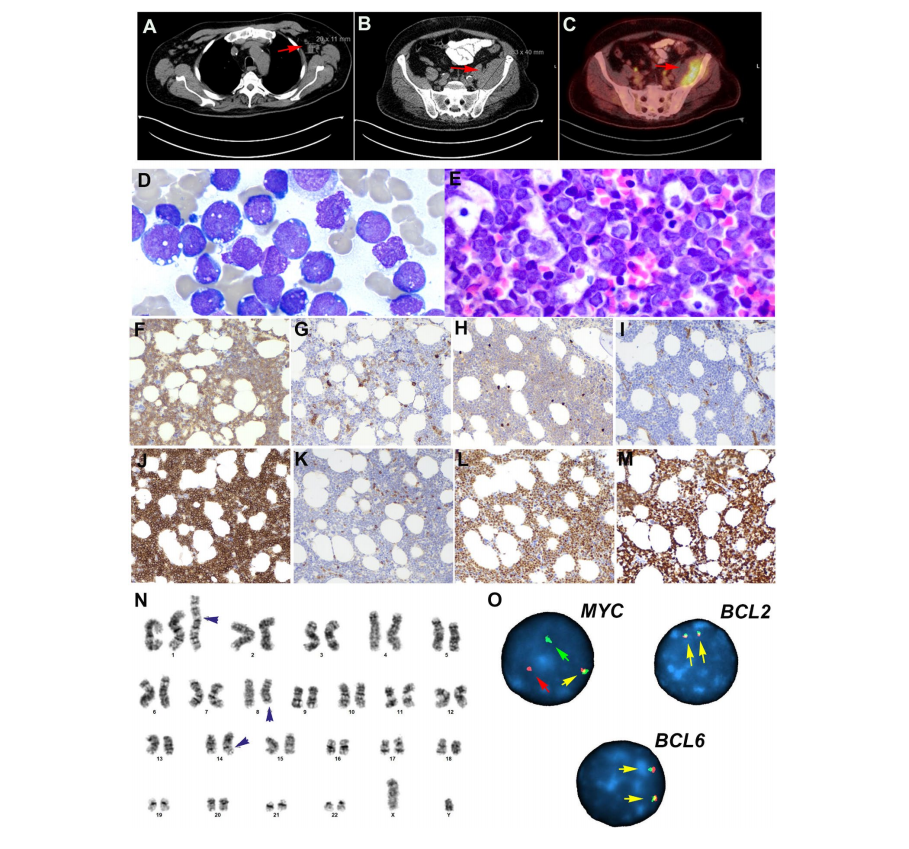

图7
另一个有趣的病例(LYWS-1231)是由Yen-Chun Liu提出,患者是一位24岁女性,左膝疼痛3年(图8)。影像学检查显示左侧股骨有一个分叶状肿块,从中段骨干延伸至包括股骨内、外侧髁在内的远端骨骺(图8A-B)。未发现其他病变。骨活检诊断为DLBCL,CD20和BCL6阳性,但CD10、MUM1、cyclin D1和EBER阴性。全基因组测序显示存在以下突变:EZH2 Y646N、IRF8 Y23H、TNFRSF14和UBR5,以及复杂的染色体变异。患者接受了2个周期的化疗(阿糖胞苷和甲氨蝶呤),并在过去3年中得到完全缓解。PB-DLBCL是一种具有特征性临床表现、形态学和遗传学特征的疾病。PB-DLBCL往往影响年轻患者,多发于股骨,其次为骨盆、椎骨和肱骨,并且预后良好。与大多数结外淋巴瘤不同,PB-DLBCL表现出中心细胞样GCB型GEP和与FL相似的特征性突变谱,包括B2M、EZH2、IRF8和TNFRSF14变异。PB-DLBCL具有独特的临床病理特征,提示PB-DLBCL是DLBCL的结外表现,然而,不能排除以大中心细胞为主的结外t(14;18)阴性FL(类似于原发性皮肤滤泡中心淋巴瘤)的可能性。需要进一步研究来更好地确定这类淋巴瘤的特征。
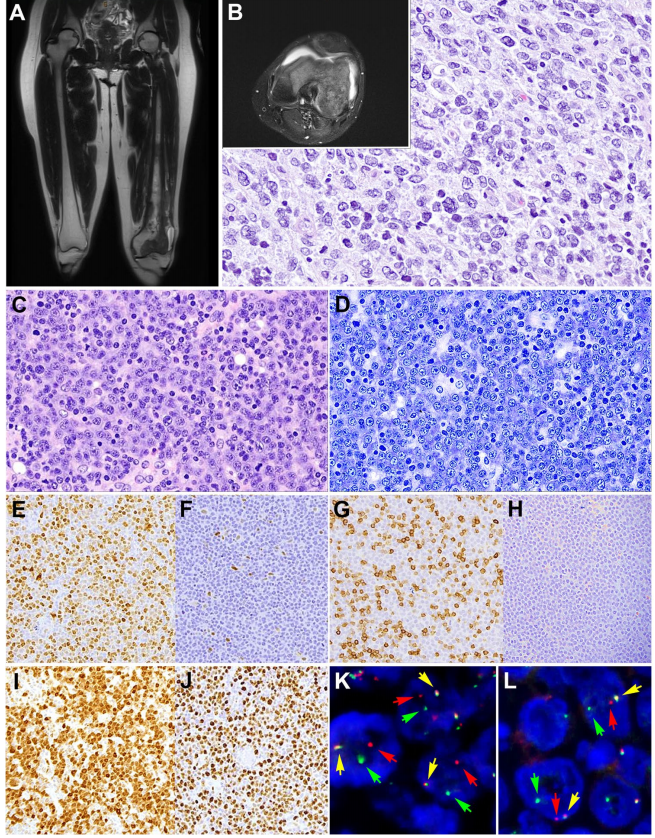

图8
cyclin D1在DLBCL中的过表达主要与CCND1基因拷贝数增加相关。IGH::CCND1重排导致cyclin D1过表达可发生在DLBCL中,并对母细胞样或多形性套细胞淋巴瘤的诊断提出了挑战。据报道,大多数病例伴有其他染色体易位,包括BCL6、BCL2和MYC。在DLBCL和其他淋巴瘤如CLL和FL的进化过程中,易位多被报道为继发性基因事件。Katrin S. Kurz提供的病例LYWS-1380对应的是一名临床分期为IIA期的58岁男性。形态学上,淋巴结显示CD20+、MUM1+和BCL2+的大细胞弥漫性浸润(图8C-L)。肿瘤细胞CD10、BCL6、CD5和SOX11均阴性。细胞增殖率为90%,MYC阳性细胞约为50%。有趣的是,cyclin D1仅在部分淋巴结强阳性,其余部分仍为阴性。BAP FISH分析显示CCND1的断裂仅发生在cyclin D1阳性的区域,表明该易位确实是该淋巴瘤进化过程中的一个继发性基因事件。此外,MYC-R基因也在同一区域被发现。BCL2和BCL6 FISH检测结果正常。基因突变分析发现CARD11、CD79B、FOXO1、PIM1、SOCS1等多种基因突变,支持DLBCL的诊断。专家组进行的GEP确认了ABC型特征。一般来说,对于细胞形态较大、cyclin D1阳性而CD5、SOX11表达缺失的病例,DLBCL的可能性高于MCL。MUM1或FOXP1的表达可能有助于正确诊断。
小B细胞NHL向侵袭性淋巴瘤的组织学转化是公认的。然而,转化为具有浆母细胞形态和表型的侵袭性淋巴瘤非常罕见。浆母细胞转化已在CLL、FL和罕见的LPL中被报道。虽然这些转化肿瘤与原发性PBL相似,但它们不伴有免疫缺陷,并且很少有EBV感染或MYC变异。此外,它们的特征表明是从小B细胞淋巴瘤而不是新生PBL克隆进化而来的。提交给研讨会的两个病例(Silvia Tse Bunding提交的LYWS-1167和Anu Peter提交的LYWS-1405)代表了进展/转化为具有PBL样特征的侵袭性淋巴瘤的典型案例。病例LYWS-1405为68岁男性,有8年CLL病史,近3年接受过包括伊布替尼在内的不同治疗。患者出现右侧腹股沟肿块,经活检诊断为PBL伴MYC-R。分子生物学研究表明,CLL和PBL具有克隆相关性,并具有相同的TP53突变。值得注意的是,最近的报道将CLL治疗与BTK抑制剂伊布替尼和模拟PBL的Richter转化相关联。需要进一步研究来了解CLL和其他淋巴瘤的PBL样转化。
总 结
由于用于标准诊断和转化研究的新改进技术,发现了越来越多的基因变异,这些变异不同程度地出现在大B细胞淋巴瘤中,有助于诊断或了解某些疾病的生物学和发病机制。其中一些变异(IRF4-R和11q变异)成为新兴疾病实体的定义性基因变异。
HG/LBCL-11q由染色体11q获得和端粒丢失定义,可发生于免疫缺陷的情况下,包括移植后和HIV+患者,但也可发生于A-T患者。该病多见于儿童,形态学谱系广泛,免疫表型呈伯基特样,但MYC表达弱或阴性,缺乏MYC-R,并且与BL相比具有不同的基因突变谱。LMO2是一种有用的标志物,但仅在50%的病例中表达。对于诊断不明确的病例,建议行FISH检测,必要时进行更复杂的染色体分析。在成人患者中同时发现的TP53突变是否代表克隆进化或伴有TP53和11q异常的DLBCL,需要进一步研究。尽管如此,TP53突变在该队列中显示了不好的预后。
LBCL-IRF4主要发生于儿童和青壮年,但也发生于成人和老年患者。儿童和青壮年更常出现在韦氏环和处于临床I/II期,而成人则更常表现为淋巴结疾病和较晚期的临床阶段,但预后良好。在形态学和遗传学上,这种疾病在儿童和成人中似乎是相同的。CD10、BCL6和MUM1/IRF4异常表达提示应行IRF4 FISH检测。在提交给研讨会的病例中,与其他已发表的系列相比,BCL6-R罕见(7% vs 35%)。对于FL3B的病例,应进行MUM1检查,如果阳性,建议进行IRF4 FISH。基于FISH的隐匿性IRF4-R发生在约10%的病例中,然而,在正确的情况下,IGH、IGK和IGL断裂以及IRF4突变支持诊断。提交研讨会的病例也提出了未来需要解决的重要问题:(1)TP53突变的预后意义是什么?(2)具有卵泡生长模式的局部疾病是否需要全身治疗,尤其是对于儿童和青壮年,在这些人群中,等待观察策略似乎是合理的?(3)已报道的ABC型GEP病例是否属于同一疾病?
IRF4-R可在多种与其他染色体易位相关的侵袭性B细胞淋巴瘤中观察到。IRF4-R可能是初始事件,但也可能是继发事件或在转化过程中获得。这些病例不应诊断为LBCL-IRF4。需要更多的研究来更好地确定这些病例的特征。
最后,研究者还讨论了一些新的分子亚组,强调了一些需要特别关注的亚组的挑战性特征,如PB-DLBCL、伴IGH::MYC重排的B-ALL、伴CCND1-R的DLBCL和PBL样转化。
结 论
HG/LBCL-11q由染色体11q获得和端粒丢失定义,可发生于免疫缺陷的情况下,包括移植后和HIV+患者,但也可发生于共济失调-毛细血管扩张患者。
推荐FISH检测用于HG/LBCL-11q的诊断。
LMO2是HG/LBCL-11q的有用诊断标志物,但仅在50%的病例中表达。伯基特淋巴瘤LMO2阴性。
LBCL-IRF4主要发生于儿童和青壮年,但也发生于成人和老年患者。
儿童和青壮年的LBCL-IRF4主要影响韦氏环,临床分期为I/II期,相比之下,在成人中,更多是一种淋巴结疾病,出现在晚期临床阶段(III/IV)。
LBCL-IRF4是一种预后良好的惰性淋巴瘤。
形态学上,LBCL-IRF4可为滤泡型、滤泡/弥漫型、弥漫型,常表现为CD10、BCL6和MUM1的异常表达。CD5表达并不少见,尤其在儿童中。
在成人中,IRF4重排可在多种与其他染色体变异相关的侵袭性B细胞淋巴瘤中观察到。这些病例不应诊断为LBCL-IRF4。
参考文献:
Quintanilla-Martinez, Leticia et al. “Emerging entities: high-grade/large B-cell lymphoma with 11q aberration, large B-cell lymphoma with IRF4 rearrangement, and new molecular subgroups in large B-cell lymphomas. A report of the 2022 EA4HP/SH lymphoma workshop.” Virchows Archiv : an international journal of pathology vol. 483,3 (2023): 281-298. doi:10.1007/s00428-023-03590-x


