Nature:环状RNA可能是下一代重磅药物研发方向?
时间:2023-10-10 08:40:18 热度:37.1℃ 作者:网络
基于 RNA 的疫苗是 COVID-19 大流行的英雄,它们创下了历史上最快疫苗开发时间的记录,从开发到获FDA批准上市仅仅用时一年时间。同时,他们也创造了历史上最高收入的药物上市记录,并得到了今年的诺贝尔生理学或医学奖的认可。 Katalin Karikó 和 Drew Weissman 因发现了核苷碱基修饰,从而开发出了有效的mRNA疫苗来对抗COVID-19,而获得了2023年诺贝尔生理学或医学奖。
但众所周知,这项技术有一个关键缺点:通常的线性形式的 RNA 寿命很短。 几小时内,细胞中的酶就会降落在分子上,将其切成碎片。
我们很早就知道,RNA技术有一个关键的缺陷——RNA通常以线性形式存在,而这种形式的mRNA的寿命很短。再几小时内,细胞内的核酸酶就会把他们降解掉。
RNA 的短暂性对于疫苗来说并不是一个大问题:它只需要在短时间内编码蛋白质即可触发免疫反应。 但对于大多数治疗应用来说,如果 RNA 能停留更长时间,那就更好了。
这就是环状 RNA(circRNA) 发挥作用的地方。其共价闭合环形结构可以保护自身免受核酸酶的降解,从而具有更好的稳定性和更长的寿命。理论上,即使在低剂量水平上,环状RNA也能增加其治疗潜力。
加利福尼亚州斯坦福大学医学院的分子遗传学家、马萨诸塞州剑桥 Orbital Therapeutics 的科学联合创始人 Howard Chang 说:“通过一次递送,你就可以获得相当持久的蛋白质生产。” 生物技术公司现在正在寻求基于工程环状 RNA 的治疗方法。
这些生物技术公司在过去三年中总共筹集了超过 10 亿美元的风险投资资金,许多大型制药公司现在也涉足该技术。 他们坚信,无论线性 RNA 能做什么,其弹性更强的环状 RNA 都能做得更好。
支持者预计 circRNA 将成为制药行业的首选 RNA 平台,并可能催生从下一代疫苗、罕见疾病治疗到抗癌药物等产品。 此类药物的首次人体试验于八月开始。
但环状 RNA 距离开启一场革命,或者像一家初创公司预测的那样,在本世纪末实现 100 个新药物项目的承诺,还有很长的路要走 (go.nature.com/3pwbkjx)。 circRNA 的增强弹性是否使其能够超越其他持久的治疗方法(例如传统基因疗法或新兴基因编辑技术)仍然是一个持续的研究和科学探究领域。
“别误会我的意思,我认为环状 RNA 就是狗屎,”Strand Therapeutics 的联合创始人兼首席执行官杰克·贝克拉夫特 (Jake Becraft) 说道。Strand Therapeutics 是一家位于马萨诸塞州波士顿的合成生物公司,该公司在其一些药物中使用了 circRNA。 “但人们完全忽视了数量惊人的挑战。”
环状RNA的发现和发展
1976 年,研究人员在自然界中发现了第一个环状 RNA(circRNA),当时德国的一个团队在植物中描述了一系列呈闭合环状形式的小型病毒样 RNA 病原体,当时被认为是细胞内mRNA剪接错误带来的副产物。 十五年后,研究人员在人类和其他哺乳动物细胞中鉴定出了这些分子。
然而,直到 2010 年代,研究人员才真正了解环形 RNA 在各种细胞类型中的范围,并发现它们在指导生物活性方面的多方面作用。
在大多数情况下,它们的作用是与调节分子结合以介导基因表达。 但一些 circRNA 也可以编码蛋白质——科学家们很快意识到,如果他们有办法从头开始制造 RNA 环,这种功能可能具有治疗潜力。
在细胞中,这些圆圈是通过一种非常规的信使 RNA 加工模式(称为反向剪接)产生的。 通常,RNA 剪接的运作方式与电影剪辑非常相似,即切除非编码片段并将剩余的编码部分连接在一起。 但在某些情况下,RNA 会发生意想不到的转向,自行折叠、夹断并形成一个独立的环。
反向剪接需要各种蛋白质之间复杂的舞蹈,所有这些蛋白质都天然存在于细胞内,但在实验室工作台上不容易获得。 因此,在 20 世纪 90 年代初,研究人员提出了两种可能的解决方法来创建合成环状 RNA。
一种酶使用 DNA 桥将 RNA 链的末端固定在一起,而另一种酶则将其密封,这一过程称为连接 3。 另一种利用特殊 RNA 序列本身的酶特性。 当两个这样的序列以发夹形式配对时,它们可以启动交叉连接反应,形成一个环。
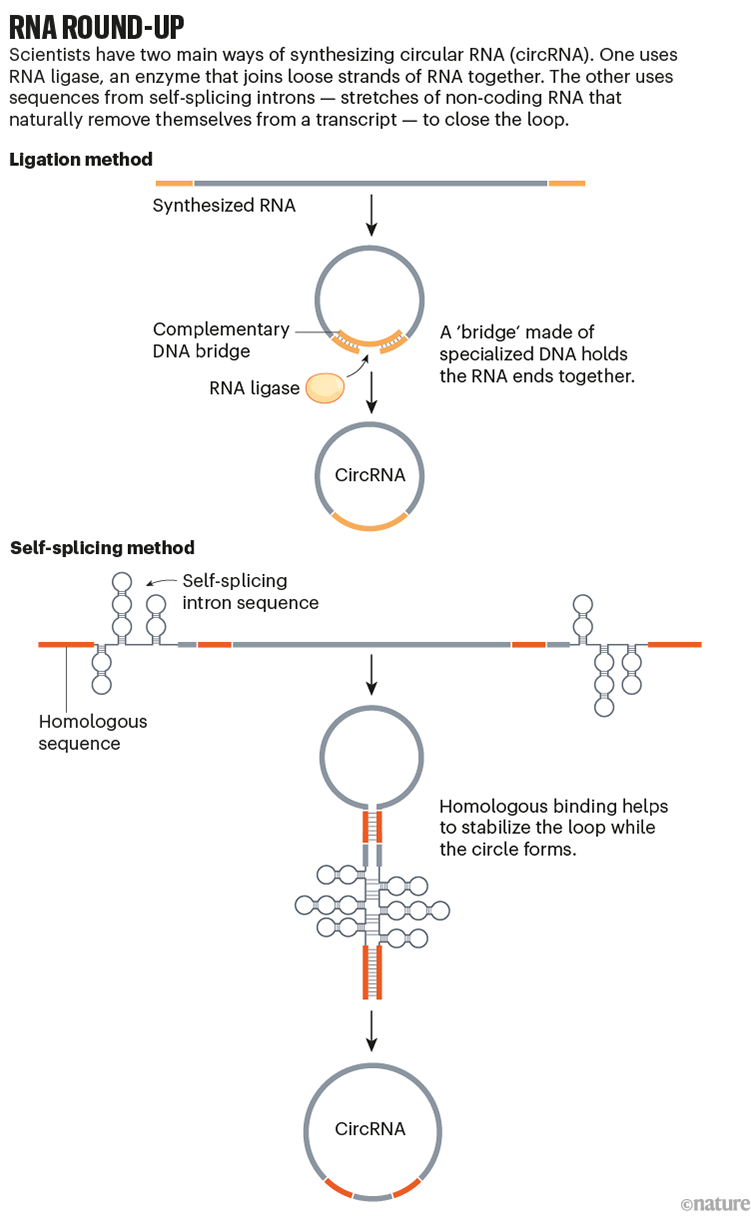
1995 年,丹佛科罗拉多大学的一个小组研究出了如何使用一种名为 IRES6 的特殊序列从此类实验室制造的圆圈中合成蛋白质。 IRES 是内部核糖体进入位点的缩写,它允许核糖体(细胞的蛋白质制造机器)与环状 RNA 转录物结合并开始连续生产蛋白质。 “核糖体永远不需要脱落,”康涅狄格州纽黑文耶鲁大学医学院的 RNA 生物学家 Grace Chen 说。
然而,研究人员只能创建短的环状序列——通常最多只有几百个核苷酸。 在接下来的 20 年里,该领域一直受到这种大小限制,无法生成解决囊性纤维化或血友病等疾病所需的长蛋白质编码转录本。
2013年,Nature 期刊同期发表两篇环状RNA研究论文,指出环状RNA是一类具有调控作用的非编码RNA,通过作为miRNA的海绵(sponge)来调控其他基因表达。这让沉寂30多年的环状RNA一鸣惊人,成为新一代明星分子,并陆续被发现在细胞分化、组织稳态、疾病发展,以及免疫代谢中发挥重要调节作用。
2018年7月,是环状RNA发展史上的一个关键转折点,麻省理工学院(MIT)的 Daniel Anderson 等人在 Nature Communications 期刊发表论文,首次证实工程化的环状RNA可在真核细胞中稳定、高效表达蛋白,开创了外源环状RNA在真核细胞中表达蛋白的新应用,也证明了环状RNA是线性mRNA的有效替代品。

环状RNA创业热潮
基于上述研究,2019 年,Wesselhoeft 和 Anderson 与生物技术企业家 Raffaella Squilloni 一起创立了一家公司来将该平台商业化。 这家初创公司最初被称为 Oroboros Bio,得名于神话中的蛇,它形成一个环来吞噬自己的尾巴,后来更名为 Orna Therapeutics。该公司的核心技术在于其开发RNA环化技术,他们实现了超长环状RNA构建,将编码杜氏肌营养不良(DMD)所缺乏的肌营养不良蛋白(Dystrophin)的mRNA实现环化,该mRNA长达12000个核苷酸。
作为 Orna 分子生物学的负责人,Wesselhoeft 继续完善和优化该过程。 最终,他制作了一种编码肌营养不良蛋白的超长环状RNA,肌营养不良蛋白是杜氏肌营养不良症所缺乏的大量蛋白质。 该转录本包含近 12,000 个核苷酸。 韦塞尔赫夫特说,抗肌萎缩蛋白“大约是人类基因组中你想要表达的最大的东西”。
但 Orna 并非唯一一家致力于开发环化技术的初创公司,还有一些公司正在采用不同的方法来构建环状RNA。例如,Torque Bio公司是将产生环状RNA的指令放到病毒中,让其细胞内部剪接产生环状RNA。
另一家公司,纽约市的 Chimerna Therapeutics,正在使用基因工程细菌来制造其 circRNA,其首席执行官 Brian Pickering 表示,与完全实验室生成的分子相比,“可以节省大量成本和时间”。
8 月,韩国城南生物技术公司 Rznomics 的一个团队描述了一种用于环化 RNA 的系统,该系统可以避免在 circRNA9 中留下任何不需要的自剪接序列。 中国两家公司,上海的环码生物(CirCode Biomedicine) 和苏州科锐迈德( CureMed Biopharma Technology)的研究人员去年分别发布了预印本,开发了新型RNA环化技术。
“最终的 circRNA 仅包含编码区和 IRES”,并且不包含任何不需要的序列或人工产物,苏州科锐迈德研发主管 Chijian Zuo 表示。
目前,已有十几家工程化环状RNA公司创立,这些公司筹集了超过10亿美元的融资。其中最受关注的当属Flagship孵化的 Laronde,该公司已融资近5亿美元。此外,一些大型制药企业也开始涉足环状RNA技术。他们相信,线性RNA能做的,环状RNA也能做,甚至能做的更好。
环状RNA的增强和放大
谈及环状RNA的优势,斯坦福大学的张元豪(Howard Chang)认为,只需要一次注射,你就能得到足够耐用的蛋白质。
2022年7月,张元豪团队在 Nature Biotechnology 期刊发表论文,该研究通过多处优化设计,成功环状RNA翻译表达的蛋白质产量提高了数百倍,可在体内实现有效且持久的蛋白质生产。

之后,张元豪与mRNA技术先驱、2023年诺贝尔生理学或医学奖得主Drew Weissman等人创立了一家名为 Orbital Therapeutics 的公司,该公司在今年上半年完成了高达2.7亿美元的A轮融资。
环状RNA技术的支持者预计,环状RNA将成为制药行业的首选RNA平台,并可能开启下一代疫苗、罕见疾病疗法,以及抗癌药等产品。
但关于 circRNA 是否触发免疫的报道各不相同。 上海生物化学与细胞生物学研究所的RNA生物学家陈玲玲说:“这实际上取决于你如何制作圆圈。” 在 2021 年首次在线发表的一篇论文中,她和她的同事详细介绍了自剪接基序留下的序列如何倾向于扭曲 RNA 折叠,从而产生结构不规则的圆圈,从而引发免疫反应。
将环状RNA开发为疗法时,我们需要去除成环过程中的额外序列,从而避免引起不必要的免疫反应。哥本哈根 Aloop Therapeutics 公司的联席首席执行官 Thomas Kirkegaard Jensen 表示,如果你想要一种可以在一生中一次又一次接受的治疗,这一点就很重要。Aloop Therapeutics 是一家旨在利用 circRNA 治疗罕见遗传性疾病的公司。“我们确实需要考虑导致免疫原性的每一个因素,并尽可能地减轻它,”他说。
然而,大约在同一时间,RNA 生物化学家奥利弗·罗斯巴赫 (Oliver Rossbach) 和他在德国吉森贾斯特斯·李比希大学 (Justus Liebig University of Giessen) 的同事报告称,污染物可能是造成这种情况的原因,并且通过正确的纯化步骤可以最大限度地减少或消除反应。 “它必须超级干净,”罗斯巴赫说。
中国科学院分子细胞科学卓越创新中心的陈玲玲研究员认为,这其实取决于构建环状RNA的具体方式。她于2021年11月在 Molecular Cell 期刊发表的研究显示,在构建环状RNA时,自剪接基序留下的序列会扭曲RNA折叠,从而导致结构不规则的环形结构,从而引发免疫反应。

但在某些情况下,免疫反应又是必需的。
对于癌症和传染病疫苗来说,激发免疫系统可以刺激抗体和 T 细胞的产生。 这是北京大学基因组编辑科学家魏文生和他的同事在使用 circRNA 开发冠状病毒 SARS-CoV-2 疫苗时发现的结果。
2022年3月,北京大学魏文胜团队在 Cell 期刊发表论文,该研究在小鼠和猴子上证实,与线性mRNA疫苗相比,环状RNA疫苗诱导产生了更多的中和抗体,以及更有效的T细胞反应。此外,环状RNA在环境温度下比线性mRNA更稳定,因此,基于环状RNA的疫苗可以无需冷链储存和运输。
魏创办的一家位于北京的初创公司圆因生物(Therorna)目前正在人体中测试环状RNA新冠疫苗,该试验被认为是第一个在人体中测试合成 circRNA 药物的试验。明年可能会有其他一些药物进入临床,其中包括来自苏州 CureMed 的一种癌症治疗药物,该药物编码一种名为白细胞介素 12 (IL-12)的免疫刺激分子。
Orna 公司准备在2024年开始一项环状RNA疗法的临床试验,这款环状RNA疗法可以重新编程免疫细胞来攻击血癌。在今年 5 月份的美国细胞基因治疗行业会议(ASGCT)上,Orna 科学家展示了临床前研究结果,显示这种 circRNA 候选药物,即使以低剂量给药,也可以根除白血病小鼠模型中的肿瘤,而不需要任何复杂的细胞工程或高强度的预备药物方案。
环状RNA的优化
合成的 circRNA 不仅仅可以编码治疗性蛋白质。 当折叠成特定形状时,这些分子可以像抗体一样发挥作用并直接与靶标结合,从而产生一种称为适体(aptamer)的药物。 它们可以捕获和隔离不同种类的调节分子,有效地将它们从细胞环境中清除。
它们还可以充当“反义剂”,与基因转录物结合并阻断或改变其表达。 此外,它们可以作为 RNA 编辑应用的引导分子,将专门的酶引导到需要校正的突变疾病基因转录本上。 所有这些应用程序都在被各种初创公司积极探索。
但最大的投资是在蛋白质表达方面,早期的研究和开发主要集中在寻找提高 circRNA 平台生产效率的方法。 “如果你优化得足够多,它就会更加稳健,”CirCode 联合创始人、上海计算生物学合作研究所的 RNA 生物学家 Zefeng Wang 说。
对于大多数研究团队来说,这个过程从 IRES 开始。 例如,在去年首次发表的结果中,Chang 和他的同事系统地表征了来自各种病毒的数十种 IRES 元件,发现许多元件比科学界常用的元件能够实现更强大的蛋白质表达。 通过微调其他一些设计元素,他们还成功地将 circRNA 的生产力提高了数百倍,从而实现了长达数天的持续蛋白质水平。
人工智能助力环状RNA研究
2023年5月,百度美国研究院黄亮、张亮(现为中国药科大学教授),联合斯微生物,在国际顶尖学术期刊 Nature 发表论文。通过人工智能(AI)工具来优化mRNA疫苗序列,从而帮助创造更有效、更稳定的mRNA。

这项研究不仅为mRNA疫苗提供了一种及时和有前途的工具,而且还为mRNA疗法提供了巨大的潜力,有望彻底改变医疗保健现状。该研究开发的线性设计工具——LinearDesign,可以优化编码所有治疗性蛋白的mRNA,包括单克隆抗体和抗癌药物。
2023年7月,团队在预印本 bioRxiv 发表论文,进一步开发出了用于环状RNA结构预测与序列设计算法平台——circDesign。

研究团队将circDesign算法应用于基于环状RNA的狂犬病疫苗和带状疱疹疫苗的序列优化设计中,在小鼠模型中增强了环状RNA的序列稳定性、蛋白翻译效率和免疫原性,成功验证了circDesign平台在环状RNA序列设计优化上的有效性。
据悉,这是国际上首个通过人工智能算法优化设计环状RNA的案例,有望简化环状RNA的序列优化设计,提高环化效率、稳定性和蛋白翻译水平。
circDesign算法开发人、LinearDesign共同一作、中国药科大学张亮教授表示,相比线性RNA,针对环状RNA的序列设计需要考虑的因素更多,目前团队正在积极探索针对不同RNA平台的设计算法,希望人工智能技术能够加速RNA疫苗和药物的开发。
环状RNA面临的问题与挑战
环状RNA领域不断取得新进展,但随着该领域的发展,也不断暴露出一些问题。
今年6月份,环状RNA领域融资最多的公司之一——Laronde,其核心研究项目——使用环状RNA表达GLP-1用于减肥,被曝光涉嫌数据造假。这一事件也引起了人们对于对于环状RNA潜力的怀疑。
Laronde 首席执行官约翰·门德林 (John Mendlein) 表示,这些挫折“并不代表今天的公司,也不代表科学或人民”。 尽管如此,这一事件还是让某些观察家对 circRNA 的潜力产生了怀疑。
一家基于合成生物学的mRNA疗法开发公司 Strand Therapeutics,他们也曾开发基于环状RNA的疗法,但该公司的联合创始人兼CEO Jake Becraft 博士表示:环状RNA就是垃圾!开发基于环状RNA药物或疗法将会面临的难题数量难以置信,而人们通常忽略了这一点。
基于环状RNA的药物的首次人体试验已于今年8月启动。但环状RNA距离开启一场药物开发的革命,或实现 Laronde 公司所做的承诺——到本世纪末开发100款基于环状RNA的新药项目,还有很长的路要走。环状RNA的优势是否会使其胜过其它的持久治疗方法,例如传统的基因疗法,以及新兴的基因编辑疗法,仍然是一个正在进行的调查和科学探究领域。
环状和线性并不是编码基于 RNA 的疗法的唯一方式。 许多研究人员认为,即使是更持久的技术,例如可以在细胞中自我复制的自我扩增 RNA,也有必要将合成 RNA 转化为许多慢性疾病的可行治疗方法。
现在担任剑桥麻省总医院布里格姆基因和细胞治疗研究所 RNA 治疗主任的 Alexander Wesselhoeft 仍然看好环状分子。 尽管线性 mRNA 疫苗取得了巨大成功,但他仍将 circRNA 视为未来。 “这将成为首选的 RNA 治疗技术,”他说。
Nature 622, 22-24 (2023) doi: https://doi.org/10.1038/d41586-023-03058-7
https://www.nature.com/articles/d41586-023-03058-7


