STTT:上海交通大学赵维莅等团队发现TP53突变的弥漫性大B细胞淋巴瘤的潜在治疗靶点
时间:2023-10-08 17:21:21 热度:37.1℃ 作者:网络
P53突变(TP53mut)发生在10-20%的弥漫性大b细胞淋巴瘤(DLBCL)病例中,是DLBCL进展的不利生物标志物。它对免疫化疗、高剂量化疗、自体干细胞移植和抗CD19嵌合抗原受体T细胞治疗具有耐药性。靶向治疗TP53mut仍然是DLBCL治疗中的一个重大挑战。
2023年10月6日,上海交通大学赵维莅及Wang Li共同通讯在Signal Transduction and Targeted Therapy在线发表题为“Human endogenous retroviruses as epigenetic therapeutic targets in TP53-mutated diffuse large B-cell lymphoma”的研究论文,该研究发现人内源性逆转录病毒可以作为TP53突变的弥漫性大B细胞淋巴瘤的表观遗传治疗靶点。该研究评估了667例新诊断的DLBCL患者的TP53mut,包括576例接受免疫化疗利妥昔单抗、环磷酰胺、阿霉素、长春新碱和泼尼松(R-CHOP)治疗的患者和91例地西他滨加R-CHOP的患者。TP53mut独立预测R-CHOP治疗的DLBCL预后较差,尽管DR-CHOP治疗可以缓解这种情况。
基因集富集分析显示,在TP53mut患者中,多种病毒调控途径受到抑制,导致免疫调节受到抑制。TP53mut DLBCL表现出甲基转移酶SUV39H1表达和H3K9三甲基化(H3K9me3)的增加,有助于抑制内源性逆转录病毒(ERVs)和免疫抑制肿瘤微环境。在TP53mut DLBCL细胞系中,地西他滨下调SUV39H1,抑制ERV上H3K9me3的占用,触发ERV表达,从而释放干扰素程序,激活CD4+T/CD8+T细胞。SUV39H1的分子沉默显著消除了地西他滨诱导的H3K9me3抑制和ERV表达。

DLBCL是最常见的非霍奇金淋巴瘤亚型,TP53突变(TP53mut)是一种重要的不利遗传改变,主要发生在DNA结合域(DBD) 。从功能上讲,TP53突变体分为结构突变体(R175、R249、G245和Y220)和DNA接触面突变体(R248和R273)。结构突变降低了蛋白质的热稳定性,导致在生理温度下折叠不当和DNA结合活性的丧失。DNA接触面突变体位于DNA核心结合区内,阻碍DNA与蛋白质的结合。
由于肿瘤微环境(TME)的免疫抑制、干扰素(IFN)应答的抑制和T细胞活化的抑制,TP53mut 不仅对常规免疫化疗具有耐药性,而且对DLBCL的自体干细胞移植(ASCT)、和嵌合抗原受体T细胞(CAR-T)治疗也具有耐药性。IFN家族包括两大类:I型和II型IFN。这两种IFN均通过直接作用于肿瘤细胞和间接增强抗肿瘤免疫来抑制肿瘤。I型IFN(主要是IFN-α和IFN-β)在宿主防御病毒感染中起关键作用II型IFN (IFN-γ)是由IFN-α-或IFN- β介导的STAT4激活诱导的。
地西他滨是一种低甲基化药物,通过重新激活肿瘤抑制基因而表现出抗肿瘤活性在骨髓增生异常综合征(MDS)和急性髓系白血病(AML)中,地西他滨治疗可显著改善TP53mut 患者的预后。最近,作者报道了一项地西他滨联合R-CHOP (DR-CHOP, NCT02951728)的I/II期试验,发现所有5例TP53mut 患者均获得持久缓解。地西他滨的应答与血清IFN-γ的显著升高和外周血CD3+CD4+T和CD3+CD8+T细胞的升高有关。然而,地西他滨在TP53mut DLBCL中TME重编程中的作用有待进一步研究。
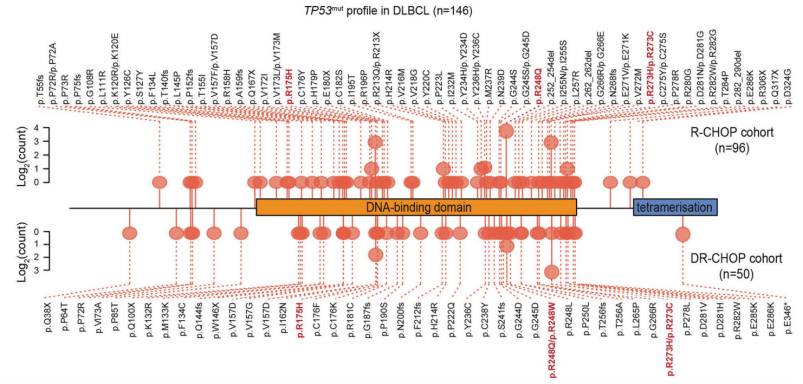
DLBCL患者TP53mut的突变谱(图源自Signal Transduction and Targeted Therapy)
人类内源性逆转录病毒(ERV)是祖先病毒感染的残余,并永久整合在人类基因组中赖氨酸9 (H3K9me3)上。组蛋白H3的DNA甲基化和三甲基化是调节ERV表达、抑制IFN-γ产生和损害T细胞活化的重要表观遗传机制。DNA甲基转移酶1(DNMT1)是诱导DNA甲基化的主要因子;同时,DNMT1的消耗导致ERV去抑制。地西他滨通过DNMT1缺失诱导DNA去甲基化,恢复ERV转录,激发抗肿瘤活性SUV39家族成员和PRDM家族成员是H3K9的主要甲基转移酶。SUV39家族成员通过H3K9甲基化抑制ERV转录。地西他滨是否可以靶向H3K9甲基化仍然是一个很大的兴趣。ERV所发挥的病毒模拟抗肿瘤作用也备受关注。
该研究表明,地西他滨通过SUV39H1-H3K9me3-ERVs轴对TP53mut DLBCL患者进行增敏化疗并与R-CHOP协同,表明地西他滨通过调节组蛋白甲基化而具有新的抗肿瘤机制。这些发现进一步明确了ERV作为重编程TME治疗TP53mut驱动型癌症的潜在表观遗传治疗靶点的临床依据。并提供了体外和体内证据,证明ERV在TP53mut驱动的癌症中作为一种新的表观遗传治疗靶点。
原文链接:
https://www.nature.com/articles/s41392-023-01626-x


