帕金森病:左旋多巴引起的运动障碍(Levodopa-Induced Dyskinesia,LID)
时间:2023-09-08 11:02:03 热度:37.1℃ 作者:网络
论坛导读:左旋多巴已成为治疗帕金森病的基础,并且至今仍是运动控制疗法的主要治疗选择。不幸的是,随后出现的异常不自主运动,称为运动障碍,是一个常见的缺点。尽管对这种并发症有深入的了解,但就临床现象学和左旋多巴治疗期间的时间关系而言,对其背后的病理生理学机制还不太清楚。随着疾病的发展,运动皮质和基底神经节神经元的特定振荡活动和左旋多巴代谢的变化,就多巴胺受体刺激模式和周转率而言,是运动障碍发作的基础。
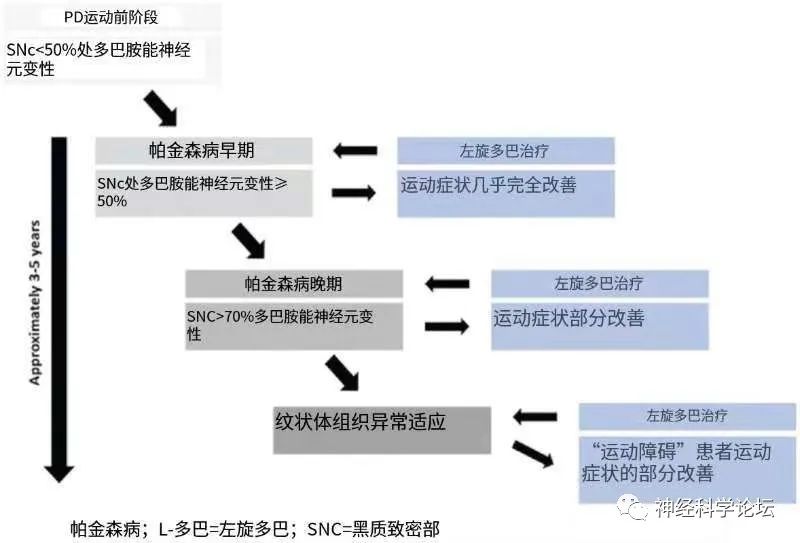
帕金森病(Parkinson’s disease, PD)是第二种最常见的神经退行性疾病,其特征是进行性运动症状,包括震颤、运动迟缓、强直和姿势受损。这些运动症状是由多巴胺能黑质纹状体通路的退化引起的,多巴胺能黑质纹状体通路是基底神经节的关键功能,并负责身体运动。对PD最有效的治疗是l-3,4-二羟基苯丙氨酸(左旋多巴),它补充PD中的多巴胺水平。左旋多巴在给药的最初几年非常有效,因为在PD的早期阶段,存在多余的多巴胺(DA)神经元,其能够储存外源性多巴胺并调节其释放,并维持纹状体内正常的生理性DA受体刺激。
然而,随着帕金森病的发展,帕金森病的常见运动症状被逆转为左旋多巴诱导的运动障碍(Levodopa-Induced Dyskinesia,LID),左旋多巴引起不自主运动。多巴胺受体的去神经超敏感性被广泛认为是LID最合理的机制。这种超敏感性可能是受体数量和细胞分布变化的结果,或者是受体激活下游信号通路变化的结果。由于D1多巴胺受体功能增强可能伴随着运动障碍的产生,因此LID的潜在机制可能涉及直接通路。

大约80%的PD患者发展为LID,其中30%在左旋多巴治疗3年后发展为LID。LID的特征是运动障碍,包括肌张力障碍、肌阵挛、舞蹈病和手足徐动症,这种情况也进一步损害PD患者的生活质量,随着时间的推移,他们的症状会恶化和衰弱。运动障碍可能成为治疗的限制因素,因为随着疾病的进展增加左旋多巴的剂量可能会加剧不自主运动并降低患者的生活质量。随着左旋多巴继续用于治疗,LID逐渐恶化直至成为治疗的限制,因为随着疾病进展增加左旋多巴剂量会加剧不自主运动并降低患者的生活质量。
PD最常用的治疗方法是左旋多巴,与卡比多巴联合使用。事实上,所有PD患者在疾病发展过程中都使用左旋多巴进行多巴胺替代治疗。然而,尽管左旋多巴是PD治疗中的“黄金标准”,并具有显著缓解帕金森病症状的能力,但它在晚期PD中具有副作用。左旋多巴替代疗法仍然是目前PD患者的临床治疗选择,但是大约80%接受治疗的PD患者在疾病的晚期发展为LID。更好地了解LID的病理机制和可能的改善手段将显著改善PD患者的预后,减少用药的复杂性,降低不良反应,从而改善患者的生活质量,延长其生命周期。
尽管对PD进行了广泛的研究,但仍然没有生物标志物可以表明PD的早期发病,并且目前对该疾病的治疗形式很少,如抗胆碱能药、金刚烷胺(NMDA拮抗剂)、单胺氧化酶抑制剂(MAOIs)、儿茶酚-O-甲基转移酶抑制剂(COMTIs)和多巴胺激动剂。现有的药物仅旨在减轻症状,而不是控制疾病的发展。LID仍然是一个重要的并发症,在几年的治疗后表现出来,其治疗选择仍然有限。已经在临床上测试了几种5-羟色胺型1A (5-HT1A)受体激动剂,它们具有不同水平的功效和在其他部位的相互作用。测试5-HT1A激动剂的临床试验在缓解运动障碍方面产生了不一致的结果,尤其是观察到的抗运动障碍益处经常伴随着对运动功能的不利影响。
目前,左旋多巴作为PD运动症状控制的最有效口服治疗尚未被超越。运动并发症,如不自主运动(即运动障碍)和衰减现象经常发生在PD中,随着疾病的进展,以及在左旋多巴慢性治疗的估计6.5年内。这种运动障碍会导致日常生活活动(ADL)和生活质量(QoL)受损。除了减少左旋多巴剂量外,对于出现棘手的运动障碍的晚期PD患者,可以考虑减少或停用单胺氧化酶(MAO)-B抑制剂或其他多巴胺能药物。因此,通常很难选择一种既能改善疲劳又不会使患者新出现运动障碍或加重原有运动障碍的治疗方法。左旋多巴诱导的运动障碍(LID)的发展归因于多巴胺神经元的减少或左旋多巴间歇刺激直接通路纹状体神经元时D1受体的刺激。此外,动物和临床研究都表明LID与细胞外谷氨酸盐的增加有关。然而,驱动LID的确切病理生理学机制仍然未被阐明。
研究发现与左旋多巴单一治疗相比,左旋多巴-罗匹尼罗联合治疗后血管生成标记物的表达和血脑屏障通透性显著降低。特别是,调节D1受体信号传导的化合物在左旋多巴单独治疗组中有更强的作用,而金刚烷胺和选择性NMDA拮抗剂MK801在左旋多巴-罗匹尼罗联合治疗的动物中产生明显更强的抗PD作用。罗匹尼罗的联合治疗改变了LID相关的神经可塑性和药理学反应特征。在临床和实验环境中研究LID机制和候选干预措施时,应考虑多巴胺受体激动剂辅助治疗的影响。另外,证据表明,血清素(5-HT)系统中的神经可塑性有助于LID的发作、持续和严重程度。这已经得到研究的支持,研究显示靶向5-HT1A/1B受体和/或5-HT转运蛋白(SERT)的5-HT化合物可以降低LID。
参考文献
Kwon DK, et al. Levodopa-Induced Dyskinesia in Parkinson's Disease: Pathogenesis and Emerging Treatment Strategies. Cells. 2022 Nov 23;11(23):3736. doi: 10.3390/cells11233736.
Budrow C, et al. Broad Serotonergic Actions of Vortioxetine as a Promising Avenue for the Treatment of L-DOPA-Induced Dyskinesia. Cells. 2023 Mar 8;12(6):837. doi: 10.3390/cells12060837.
Pandey S, Srivanitchapoom P. Levodopa-induced Dyskinesia: Clinical Features, Pathophysiology, and Medical Management. Ann Indian Acad Neurol. 2017 Jul-Sep;20(3):190-198. doi: 10.4103/aian.AIAN_239_17.
Espa E, et al. Dopamine Agonist Cotreatment Alters Neuroplasticity and Pharmacology of Levodopa-Induced Dyskinesia. Mov Disord. 2023 Mar;38(3):410-422. doi: 10.1002/mds.29301.
Al-Kassmy J,et al. 5-HT1A agonists for levodopa-induced dyskinesia in Parkinson's disease. Neurodegener Dis Manag. 2023 Apr;13(2):101-112. doi: 10.2217/nmt-2022-0039.
Hattori N, et al. Long-term effects of safinamide adjunct therapy on levodopa-induced dyskinesia in Parkinson's disease: post-hoc analysis of a Japanese phase III study. J Neural Transm (Vienna). 2022 Oct;129(10):1277-1287. doi: 10.1007/s00702-022-02532-2.


